电化学N-酰化醛缩合制备酰胺
张辉先,王启化,王 博*
(1.海南大学 化学工程与技术学院,海南 海口 570228;2.山东省单县园艺社区卫生服务中心,山东 菏泽 274300)
酰胺类化合物在药物和生物活性化合物中均广泛存在,而作为有机化学中最重要的反应之一,酰胺键形成的方法却已经达到了其固有的极限。因此,开发新的化学方法来高效、便捷、环境友好、可持续地合成酰胺已变得越来越重要。酰胺制备的传统方法主要包括使用酸及其相应的酰卤化合物与胺及其盐酸盐或N-卤代化合物进行反应,其中酸与胺所需要的反应条件主要有直接高温反应、叠氮化物、羰基二咪唑类、卤化试剂、酸酐及其类似物、生物酶以及金属催化剂等[1-4];酰卤化合物则通常需要额外的碱来捕获卤化氢,并避免酰胺转化为盐等。
合成酰胺大多趋向于操作简单、绿色、新颖、高效、可持续等,因此开发新的官能团一步合成酰胺也逐渐引发了研究者的兴趣,醛因其具有易得性和毒性较低等优势,是合成酰胺类化合物的重要载体。已经探索出了多种合成策略,如金属催化剂Ru,Rh,Pd,Ir,Fe,Go和Cu等[5-11];各类强氧化剂如TBHP等[12];复杂光催化剂[13];碘催化剂[14];N-杂环卡宾[15];纳米材料[15]以及球磨法等[12]。但以上方法大多需要额外的强碱如MeOK或有机碱DBU等[16-17];苛刻的反应条件如惰性气体保护,高压[18],高温[19],反应时间漫长[13]等。
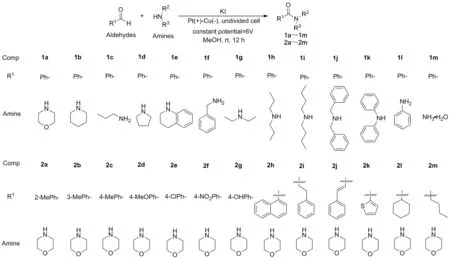
近年来研究者开始探索通过电化学辅助催化剂高效合成酰胺的方法,Green[20]等开发了一种以醛和醇为原料,N-杂环卡宾为催化剂,DBU为碱,在THF/DMSO混合溶剂中,通过将N-杂环卡宾有机催化与有机电合成相结合,在常温常压下实现了催化醛和醇高效生成酯的方法。该作者随后在此基础上改溶剂为DMF,在60 ℃条件下将底物范围拓展至醛与胺,成功实现了电化学合成酰胺[21]。此方案虽然实现了电化学合成酰胺,但也存在反应温度较高,催化剂相对复杂昂贵等缺点。Wang[22]等开发了以二芳氧磷和胺类化合物为原料,KI为电解质及催化剂,EtOH为溶剂,Pt-Pt为阴阳电极,在温和、无金属的条件下,电化学高效合成了多种膦酰胺。受此启发,探索了一种以系列醛和胺为原料,KI为电解质及催化剂,MeOH为溶剂,Cu和Pt分别为阴阳电极,在温和、无金属的条件下,电化学高效合成酰胺的方法(Scheme 1)。
Scheme 1
1 实验部分
1.1 仪器与试剂
YRT-3型熔点仪;Bruker Avance 400 MHz 型核磁共振仪(CDCl3-d或DMSO-d6为溶剂,TMS为内标);SPD-16型液相色谱仪。
碘化钾,广东光华科技股份有限公司;其余所用试剂均为分析纯。
1.2 合成
依次称取0.1 mmol醛、0.1~1.0 mmol胺、0.01~0.3 mmol催化剂及电解质KI,n-Bu4NBF4,0~0.1 mmol碱或酸溶解于10 mL溶剂中,加装气球后设置电压调控电流在常温常压下开始反应,反应过程中使用薄层色谱及液相色谱仪追踪检测,反应完毕后用旋转蒸发仪去除溶剂,加入50 mL乙酸乙酯溶解,稀盐酸(3×20 mL)洗涤,再用稀碱液(3×20 mL)洗涤,收集有机相,无水硫酸钠干燥,蒸除溶剂,残余物经硅胶柱层析(洗脱剂:乙酸乙酯/石油醚=4/1,V/V)纯化得产物。
N-苯甲酰吗啡啉(1a)[23]:淡黄色液体,收率91%,m.p.74~75 ℃;1H NMRδ:7.28(s,5H),3.55(d,J=43.4 Hz,6H),3.30(s,2H);13C NMRδ:170.13,135.31,129.72,128.42,127.02,66.68,48.06,42.48。
N-苯甲酰哌啶(1b)[23]:黄色油状液体,收率93%;1H NMRδ:7.36(d,J=1.2 Hz,5H),3.68(s,2H),3.31(s,2H),1.82~1.31(m,6H);13C NMRδ:170.27,136.50,129.34,128.38,126.76,48.73,43.10,26.51,25.64,24.57。
N-正丙基苯甲酰胺(1c)[24]:淡棕色固体,收率73%,m.p.69.5~70.5 ℃;1H NMRδ:7.92~7.72(m,2H),7.44(td,J=7.3 Hz,1.6 Hz,1H),7.35(t,J=7.6 Hz,2H),7.13(s,1H),3.53~3.17(m,2H),1.60(p,J=7.4 Hz,2H),0.92(dd,J=8.3 Hz,6.7 Hz,3H);13C NMRδ:167.86,134.84,131.17,128.37,127.03,41.82,22.86,11.45。
N-苯甲酰四氢吡咯(1d)[24]:淡黄色固体,收率89%,m.p.47.5~48 ℃;1H NMRδ:7.52~7.40(m,2H),7.34(dd,J=5.2 Hz,2.1 Hz,3H),3.59(t,J=7.0 Hz,2H),3.36(t,J=6.7 Hz,2H),1.89(p,J=6.7 Hz,2H),1.80(p,J=6.4 Hz,2H);13C NMRδ:169.65,137.20,129.73,128.20,127.03,49.56,46.14,26.34,24.40。
(3,4-二氢喹啉-1(2H)-基)(苯基)甲酮(1e)[24]:淡黄色固体,收率92%,m.p.75~76 ℃;1H NMRδ:7.45~7.35(m,3H),7.34~7.27(m,2H),7.19(dd,J=7.6 Hz,1.4 Hz,1H),7.03(td,J=7.5 Hz,1.3 Hz,1H),6.90(td,J=7.7 Hz,1.5 Hz,1H),6.77(d,J=8.3 Hz,1H),3.95(t,J=6.5 Hz,2H),2.88(t,J=6.6 Hz,2H),2.08(p,J=6.6 Hz,2H);13C NMRδ:170.31,139.34,136.35,131.65,130.15,128.63,128.42,128.13,125.76,125.47,124.62,44.54,27.00,24.20。
N-苄基苯甲酰胺(1f)[25]:白色固体,收率71%,m.p.105~106 ℃;1H NMRδ:7.89~7.80(m,2H),7.57~7.46(m,1H),7.45~7.26(m,8H),4.60(d,J=5.9 Hz,2H);13C NMRδ:167.73,138.52,134.42,131.49,128.68,128.52,127.78,127.41,127.22,43.97。
N、N-二乙基苯甲酰胺(1g)[26]:淡黄色油状液体,收率78%;1H NMRδ:7.38(q,J=3.3 Hz,5H),3.55(d,J=8.1 Hz,2H),3.25(d,J=7.0 Hz,2H),1.46~1.15(m,3H),1.11(d,J=7.3 Hz,3H);13C NMRδ:171.32,137.30,129.11,128.42,126.28,43.31,39.25,14.25,12.95。
N、N-二正丙基苯甲酰胺(1h)[26]:黄色油状液体,收率82%;1H NMRδ:7.35(q,J=4.1 Hz,3.5 Hz,5H),3.45(t,J=7.5 Hz,2H),3.14(t,J=7.5 Hz,2H),1.84~1.38(m,4H),0.96(t,J=7.6 Hz,3H),0.71(t,J=7.4 Hz,3H);13C NMRδ:171.76,137.38,128.97,128.32,126.41,50.66,46.27,21.88,20.70,11.40,10.99。
N、N-二正丁基苯甲酰胺(1i)[26]:淡黄色油液体,收率71%;1H NMRδ:7.29(s,5H),3.43(t,J=7.6 Hz,2H),3.12(t,J=7.8 Hz,2H),1.59(t,J=7.8 Hz,2H),1.48~1.25(m,4H),1.05(q,J=7.5 Hz,2H),0.91(t,J=7.5 Hz,3H),0.70(t,J=7.6 Hz,3H);13C NMRδ:171.65,137.37,128.99,128.30,126.43,48.75,44.46,30.79,29.66,20.28,19.71,13.90,13.59。
N、N-二苄基苯甲酰胺(1j)[26]:白色固体,收率72%,m.p.107~108 ℃;1H NMRδ:7.49(dd,J=6.7 Hz,3.0 Hz,2H),7.40~7.20(m,11H),7.21~7.06(m,2H),4.62(d,J=66.5 Hz,2H),4.38(d,J=6.2 Hz,2H);13C NMRδ:172.34,137.03,136.51,136.26,129.74,128.94,128.88,128.83,128.64,128.59,128.50,128.31,127.69,127.13,126.80,51.64,46.96。
N、N-二苯基苯甲酰胺(1k)[26]:淡黄色固体,收率54%,m.p.181.5~182 ℃;1H NMRδ:7.58~7.47(m,1H),7.46~7.29(m,3H),7.24(dt,J=20.7 Hz,7.6 Hz,4H);13C NMRδ:170.69,143.96,136.15,130.21,129.21,129.15,127.90,127.54,126.39。
吗啡啉(邻甲苯基)甲酮(2a)[7]:白色固体,收率66%,m.p.42~43 ℃;1H NMRδ:7.35~7.22(m,3H),7.18(dd,J=7.5 Hz,1.4 Hz,1H),3.67(s,4H),3.50(s,2H),3.19~3.07(m,2H),2.24(s,3H);13C NMRδ:169.11,136.51,134.21,130.66,129.15,126.28,126.20,66.72,66.59,47.23,41.84,41.16,23.76,19.04。
吗啡啉(间甲苯基)甲酮(2b)[7]:白色固体,收率89%,m.p.132~133 ℃;1H NMRδ:7.34(t,J=7.5 Hz,1H),7.30~7.25(m,1H),7.24~7.16(m,2H),3.73~3.49(m,6H),3.38(s,2H),2.35(s,3H);13C NMRδ:169.63,138.30,136.05,130.60,128.72,127.92,124.46,66.57,41.15,23.75,21.33。
吗啡啉(对甲苯基)甲酮(2c)[7]:淡黄色油状液体,收率92%;1H NMRδ:7.27(dd,J=8.1 Hz,1.6 Hz,2H),7.17(dd,J=8.2 Hz,1.6 Hz,3H),3.55(d,J=67.6 Hz,8H),2.33(s,3H);13C NMRδ:170.52,139.98,132.33,129.10,127.21,66.84,48.24,42.63,21.36。
吗啡啉(对甲氧苯基)甲酮(2d)[7]:白色晶状固体,收率93%,m.p.43~44 ℃;1H NMRδ:7.29(dd,J=8.8 Hz,2.3 Hz,2H),6.81(dd,J=8.8 Hz,2.2 Hz,2H),3.71(d,J=2.4 Hz,3H),3.55(d,J=19.6 Hz,8H);13C NMRδ:170.22,160.81,129.12,127.23,113.69,66.76,55.25,41.33。
吗啡啉(对氯苯基)甲酮(2e)[27]:白色固体,收率75%,m.p.74~75 ℃;1H NMRδ:7.46~7.27(m,4H),3.56(d,J=96.5 Hz,8H);13C NMRδ:169.22,135.85,133.66,128.78,128.67,66.74,48.12,42.63。
吗啡啉(对硝基苯基)甲酮(2f)[27]:淡黄色固体,收率78%,m.p.101~103 ℃;1H NMRδ:8.36~8.16(m,2H),7.68~7.37(m,2H),3.78(s,4H),3.62(s,2H),3.38(s,2H);13C NMRδ:167.63,148.02,141.09,127.79,123.55,66.32,47.63,42.16。
吗啡啉(对羟基苯基)甲酮(2g)[10]:白色固体,收率68%,m.p.63~64 ℃;1H NMRδ:9.10(s,1H),7.33~7.14(m,2H),6.82~6.58(m,2H),3.69(s,8H);13C NMRδ:171.61,159.08,129.27,125.16,115.63,66.87,48.67,43.14。
吗啉(萘-1-基)甲酮(2h)[10]:淡黄色晶状固体,收率84% m.p.109~111 ℃;1H NMRδ:7.85~7.80(m,1H),7.80~7.74(m,2H),7.50~7.31(m,4H),3.92(dd,J=11.2 Hz,6.2 Hz,1H),3.86~3.67(m,3H),3.42~3.30(m,2H),3.06(dt,J=10.1 Hz,4.8 Hz,2H);13C NMRδ:169.21,133.76,133.40,129.54,129.22,128.46,127.07,126.47,125.17,124.65,123.91,66.91,66.82,47.50,42.13。
1-吗啉-3-苯基丙烷-1-酮(2i)[11]:淡黄色液体,收率86%;1H NMRδ:7.25(dd,J=8.0 Hz,6.9 Hz,2H),7.17(dt,J=8.1 Hz,2.1 Hz,3H),3.55(s,4H),3.44(t,J=4.8 Hz,2H),3.28(t,J=4.8 Hz,2H),2.99~2.88(m,2H),2.56(dd,J=8.7 Hz,6.9 Hz,2H);13C NMRδ:170.77,141.08,128.51,128.46,126.23,66.76,66.42,45.91,41.91,34.69,31.45。
N-肉桂酰吗啡啉(2j)[28]:白色固体,收率78%,m.p.73~75 ℃;1H NMRδ:7.70(d,J=15.4 Hz,1H),7.57~7.47(m,2H),7.42~7.31(m,3H),6.85(d,J=15.4 Hz,1H),3.79~3.57(m,8H);13C NMRδ:165.59,143.20,135.09,129.77,128.83,127.80,116.57,66.82,46.23,42.49,41.83。
吗啉(2-噻吩基)甲酮(2k)[29]:淡黄色油状液体,收率91%;1H NMRδ:7.39(dd,J=5.0 Hz,1.1 Hz,1H),7.21(dd,J=3.6 Hz,1.1 Hz,1H),6.97(dd,J=5.0 Hz,3.6 Hz,1H),3.70~3.65(m,4H),3.65~3.61(m,4H);13C NMRδ:163.46,136.63,128.91,128.87,126.76,66.74,45.75。
环己基(吗啉)甲酮(2l)[30]:无色油状液体,收率68%;1H NMRδ:3.60(q,J=4.4 Hz,4H),3.57~3.51(m,2H),3.43(t,J=4.8 Hz,2H),2.37(tt,J=11.6 Hz,3.4Hz,1H),1.74(td,J=5.6 Hz,2.8 Hz,2H),1.68~1.57(m,3H),1.46(qd,J=10.9 Hz,10.1 Hz,6.2 Hz,2H),1.26~1.12(m,3H);13C NMRδ:173.77,66.00,65.88,44.91,40.93,39.24,33.00,28.32,24.80,23.98。
N-正戊酰吗啡啉(2m)[30]:白色油状液体,收率83%;1H NMRδ:3.63~3.57(m,4H),3.54(dd,J=5.6 Hz,3.6 Hz,2H),3.43~3.37(m,2H),2.34~2.18(m,2H),1.64~1.46(m,2H),1.30(dq,J=14.6 Hz,7.3 Hz,2H),0.86(t,J=7.3 Hz,3H);13C NMRδ:171.90,66.92,66.67,46.04,41.83,32.82,27.33,22.53,13.85。
2 结果与讨论
2.1 反应条件筛选
选用苯甲醛和吗啡啉作为基准物进行最佳反应条件筛选,针对电解质种类、电极材料、溶剂、催化剂种类、碱/酸种类进行探究,结果如表1所示。

表1 反应条件筛选aTable 1 Reaction condition screeninga
在以KI为催化剂和电解质、Pt为阳极、Cu为阴极,MeOH为溶剂,不额外使用任何碱和电解质的反应条件下可以得到最高产率91%(Entry 4)。对于电解质的影响,当KI用量为0.06 mmol,使用n-Bu4NBF4时产率为64%;KI用量增加至0.30 mmol时,产率增加至91%,此时若不再使用n-Bu4NBF4作为特定电解质产率依旧为91%(Entry 3),故采用增加KI用量而不使用额外电解质。对于催化剂种类,发现仅碘盐KI最高,其余卤化物及I2产率均低于10%(Entry 4~10)。对于电极材料,Pt-Cu时最高(Entry 4,11~14),故选取Pt为阳极、Cu为阴极材料。对于溶剂,其中MeOH最高(Entry 4,15~23),故选取MeOH为溶剂。对于各类常见酸碱,当KI用量均为0.06 mmol且同时使用n-Bu4NBF4作为特定电解质时,两种有机酸条件下的产率均微量(Entry 35~36),在有碱存在条件下,碱性越强,产率越高,但当KI用量增加至0.30 mmol后是否再使用碱已无影响,均可达91%(Entry 24~31),故选择增加KI用量而不使用额外的酸碱。
苯甲醛与吗啡啉的当量为1/10,催化剂及电解质KI当量为1/3.0,Pt为阳极、Cu为阴极,恒压6 V,MeOH为溶剂,在不使用任何碱和额外电解质的反应条件下反应12 h为最佳反应条件,最高产率91%(Entry6)。对于反应物当量,当苯甲醛与吗啡啉当量逐渐增加至1/10时达最高,继续增加基本无影响(Entry 1~7),综合考虑选取反应当量为1/10。对于催化剂KI用量,从不使用到1/3.0逐渐增加,继续增加产率开始下降(Entry 6,8~14),故选取KI用量为1/3.0。对于电压电流选择,当电压从0 V依次增加至6 V时产率最高,继续增加产率开始降低(Entry 6,15~18),故选定电压为6 V。对于反应时间,通过分别在0、0.5、1、2、4、6、8、10和12 h取样进行HPLC测定以计算产率,结果如图1所示。
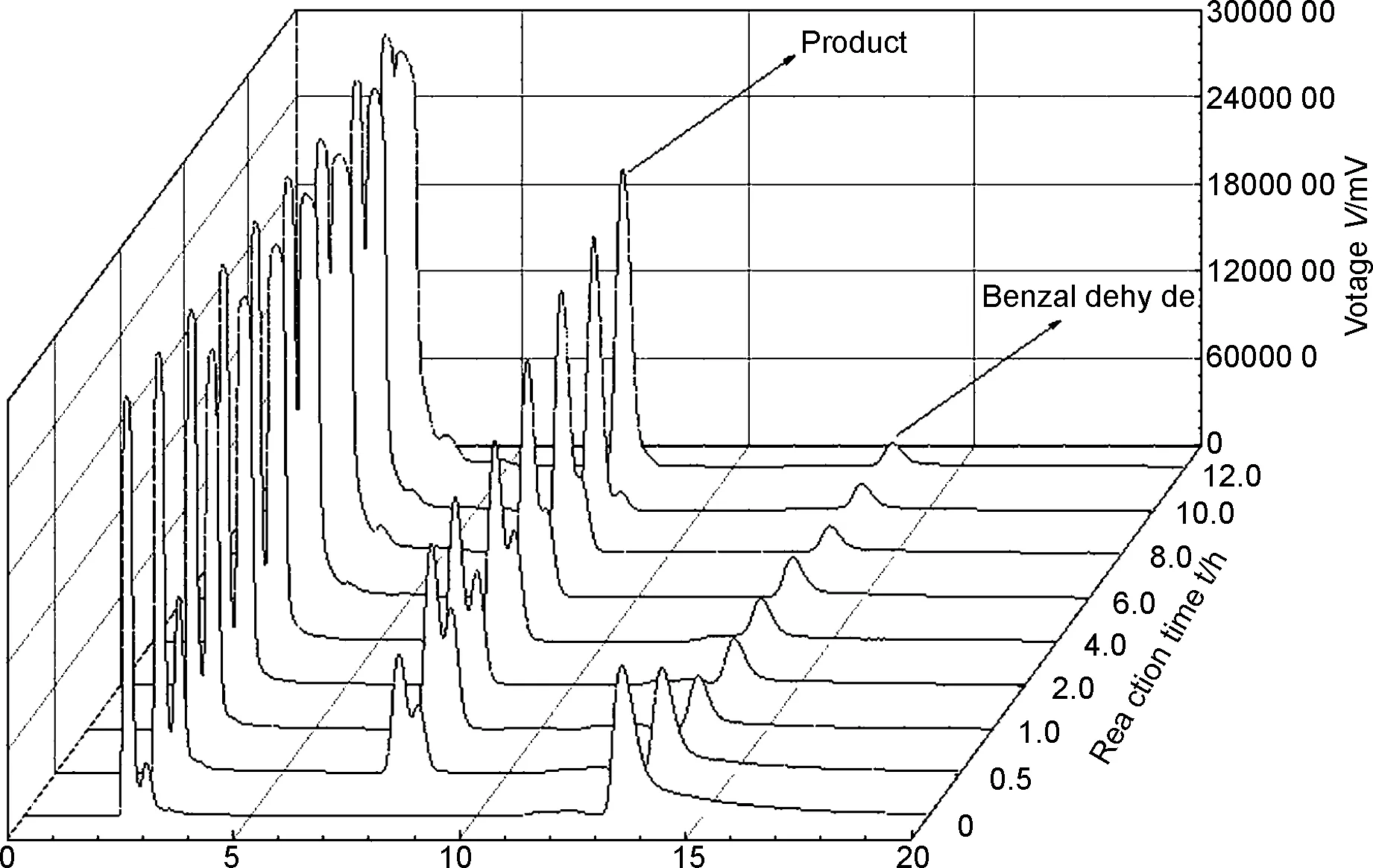
t/min图1 系列反应时间取样HPLC图Figure 1 HPLC of series reaction time sampling
如图1及表2所示,随着反应时间延长产率逐渐增加,在12 h时达到91%,继续延长反应时间至24 h时为93%,产率几乎不再增加(Entry 6,19~27),故选取反应时间为12 h。对于反应氛围,使用Air、N2和O2或直接暴露于空气中均影响不大(Entry 6,28~30),考虑到生成的氢气和溶剂挥发易造成一定危险,故使用空的气球收集产生的H2以及阻止溶剂挥发至空气中。

表2 反应条件优化aTable 2 Optimization of reaction conditions screeninga
总之,在KI为催化剂及电解质,用量300%,Pt为阳极、Cu为阴极,MeOH为溶剂,苯甲醛与吗啡啉的当量为1/10,不使用任何碱、额外电解质和氧化剂以及惰性气体保护的反应条件下恒压6 V反应12 h为最佳反应条件,可得到最高产率91%(Entry 6)。
2.2 反应底物拓展
在2.1筛选出的最佳反应条件基础上,选取不同取代胺和醛进行底物拓展,以检验该反应条件的实用性,结论如Scheme 1所示。通过对系列带有不同取代基团的一级和二级胺进行底物拓展,结果表明,大部分反应如预期进行顺利,得到了相应的产物,其中最高收率可达93%(1b),最低54%(1k)。与环烷胺相比,二烷基和二苄胺的收率较低(1f~1k);在相同的条件下与伯胺和苄胺的收率较低(1c,1f),苯胺和氨水(1l,1m)则几乎不反应。为了进一步扩大醛的范围,使用吗啡啉作为固定胺对不同醛进行底物拓展,结果表明,所有反应都有较高的收率,部分高达93%(2d)。比较不同取代基发现,芳香环上不同位置的取代基对产物的收率有明显的影响,如对甲基苯甲醛和间甲基苯甲醛在相应位置上均有一个给电子基团甲基,分别以89%和92%的收率得到相应的产物2b和2c,而邻位的收率则相对较低(2a);仅考虑对位,不同取代基如p-OH、p-Me、p-Cl、p-MeO和p-NO2,对所得收率影响较小(2c~2g)。同时,本方法也适用于不饱和醛、脂环醛和环醛,得到相应的产物2j,收率为78%,2l和2m分别为68%和83%。
报道了一种以KI同时作为催化剂和电解质电化学合成酰胺的方法,该体系无需额外氧化剂、强碱以及贵金属催化剂,在常温常压条件下即可高效催化醛和胺合成系列酰胺,同时该反应体系底物应用范围较广,部分收率高达93%,其余大部分底物也都有较高的收率。
——吗啡

