基于蛋白质组学技术研究8 w中等强度低负荷量运动对增龄大鼠肝脏蛋白质组的影响
苏醒 苏巍
(1淮安信息职业技术学院基础部,江苏 潍安 223003;2上海交通职业技术学院)
衰老机体内环境生物学特性改变,引起结构变化和功能失调及相关疾病的发生〔1〕。肝脏是体内最大实质器官,约占人体总重量的2%,具有储存、分泌、解毒等代谢功能。肝脏是个体衰老过程中最易受累的器官之一。研究表明相对于年轻个体,老年个体更容易罹患肝脏疾病,如肝炎、非酒精性脂肪肝、肝脏纤维化等〔1,2〕。系列文献报道,增龄性大鼠的肝脏组织伴有过度的氧化应激〔3〕、纤维化〔4〕、炎症反应〔5〕、肝细胞再生能力下降〔6〕、糖脂代谢失调〔7〕、肝细胞线粒体生物更新和自噬能力下降〔7〕、肝细胞凋亡〔8〕等过程,这些增龄性功能改变将显著增加肝脏的胰岛素抵抗、脂肪肝病变、肝纤维化和肝癌的风险。因此,探究肝脏的抗衰老机制对于揭示预防衰老相关的肝脏病变的药物靶点、开发有效的干预手段具有重要的理论和现实意义。
体育运动对包括肝脏在内的多种组织具有系统性的抗衰老效应〔9〕。研究表明,中等强度的有氧运动能提高增龄大鼠肝脏的抗氧化酶活性〔10,11〕,提高老龄大鼠肝脏线粒体氧化磷酸化〔12〕和能量代谢水平〔13〕及胰岛素的敏感性〔14〕,抑制炎症因子表达和纤维化程度〔15〕。研究发现,中等强度耐力运动能经G蛋白调控增龄大鼠肝细胞胰高血糖素(glucagon)受体介导的信号通路、核转录因子-κB介导的氧化还原信号和胰岛素受体底物(IRS)-1介导的蛋白酪氨酸磷酸酯酶(PTP)-1B胰岛素敏感性信号通路〔14〕。有研究认为运用“组学(-omics)”研究技术将是未来揭示体育运动延缓衰老分子机制的重要途径〔16〕。包括蛋白质组学(Proteomics)在内的组学技术均以其高分辨率、高流通量等优点,广泛应用于对疾病机制研究〔17,18〕。尤其近年来在肝脏生物学领域的应用较为普遍〔19〕,然而,在运动科学领域鲜有研究。因此,本研究通过双向凝胶电泳(2-DE)串联质谱技术和蛋白组学技术,研究8 w中等强度低负荷量运动对18月龄増龄大鼠肝脏组织的蛋白质组表达图谱的影响,揭示长期训练延缓肝脏衰老的整体机制,为体育运动延缓衰老的分子机制研究提供理论依据。
1 材料与方法
1.1仪器与试剂 IPGphor等电聚焦电泳系统(Amershan Pharmacia公司)、聚丙烯酰胺凝胶电泳垂直平板电泳槽(购自bio-rad公司)、MDLDI-TOF MS质谱仪(Bruker Daltonics公司)、GDS 8000pc凝胶成像分析系统(中晶科技);固相pH梯度等电聚焦千胶条(Immobilise dry strip pH3~10、长度18 cm,Amersham公司)、载体两性电解质pH3~10和pH5~8(Amersha公司); V5111胰蛋白酶(Trypsin,Promega公司);基质-氰-4-羟肉桂酸(美国ICN生物医学公司);碘乙酰胺、丙烯酰胺、甲叉丙烯酰胺和三羟甲基氨基甲烷(Tris)均为化学分析纯(上海生物工程技术有限公司);线粒体丙二醛(MDA)、锰离子超氧化物歧化酶(MnSOD)、还原型谷胱甘肽(GSH)和氧化型谷胱甘肽(GSSH)试剂盒(南京建成生物工程研究所)。
1.2样品制备
1.2.1分组与实验方案 12只18月龄清洁级雌性SD大鼠购于广州中医药大学动物中心,体重(378±11)g,清洁级。分笼饲养,每笼4只,室温20~24℃、光照7∶00~19∶00。适应性喂养1 w,随机分为对照组和运动组。负荷强度参照李方晖等〔18〕。运动组进行8 w中等强度低负荷量运动(速度15 m/min,60%~70% max)跑台坡度5°,每组15 min,5 d/w。
1.2.2肝脏组织的蛋白提取 运动训练结束后24 h,运动组和对照组同时麻醉,测量体重和肝脏称重。对照组和运动组大鼠肝脏组织40 mg,置于2 ml离心管中,剪成小块;然后加入蛋白酶抑制剂苯甲基磺酰氟(PMSF)后超声,12 000 r/min离心10 min,收集沉淀,重复该步骤两次。常温干燥5 min后,30℃恒温水浴溶于裂解液中,体积比1∶8加入裂解液{7 mol/L尿素;4% 3-〔3-(胆酰胺丙基)二甲氨基〕丙磺酸内盐(CHAPS);2 mol/L硫脲;60 mmol/L 二硫苏糖醇(DTT);10 mmol/L 三(羟甲基)氨基甲烷(Tris);1 mmol/L乙二胺四乙酸(EDTA);1 mmol/L PMSF;0.5 %两性电解质(CA)},室温下12 000 r/min离心10 min,取上清,并再次离心取上清。收集样品置于-80℃冰箱内。
1.32-DE分离、染色和图像分析 双向电泳分离参照Amersham Biosciences公司,具体实验条件参照文献〔17,18〕。银染法显色2-DE重复3次实验,GDS 8000pc凝胶成像分析系统采集图像,Image Master 2D 5.0软件对图像蛋白质斑点检测背景扣除匹配分析。
1.4基质辅助激光解吸电离飞行时间质谱鉴定差异表达蛋白鉴定 酶解选择重复性好、无明显变形拖尾的蛋白质点,然后将肽段提取液干燥后,加入2.5 L的0.5%(V/V)三氟乙酸(TFA)溶液溶解肽段,具体实验步骤参照文献〔17,18〕,以MALDI-TOF质谱分析进行多肽质量指纹图谱的分析与比较。
1.5MDA、MnSOD、GSH及GSSH测定 依南京建成生物工程研究所试剂盒说明操作。
1.6统计学分析 采用SPSS17.0统计软件进行独立样本t检验。用Image Master 2D Platinum V5.0分析软件检验差异蛋白点相对含量的差别是否有统计学意义。
2 结 果
2.1运动对增龄大鼠肝脏抗氧化酶的影响 与对照组相比,运动组GSH、MnSOD活性、GSH/GSSH比值分别增加了138% (P<0.05)、33% (P<0.05)和306% (P<0.01);MDA和GSSH分别减少了60% (P<0.05)和71%(P<0.05)。见表1。

表1 两组MDA、GSH、GSSH、MnSOD比较
2.2运动对增龄大鼠肝脏组织全蛋白质影响 绝大多数蛋白质分子量位于20~90 kD,对照组蛋白质斑点数目约为600个。运动组肝脏全蛋白质斑点数目分布规律和分子量大小与对照组很相似,只存在着少量差异蛋白质斑点,如图1标识号码为 A1~A19和图 2标识号码为 B1~B16共35个蛋白质斑点,无蛋白缺失。其中,与图2相比,图1中7个斑点(A2、A8、A9、A10、A12、A13和A16)上调超过2倍;与图1相比,图2中的5个斑点(B2、B5、B6、B8和B10)上调超过2倍;其他的23个差异斑点变化均在1~2倍。
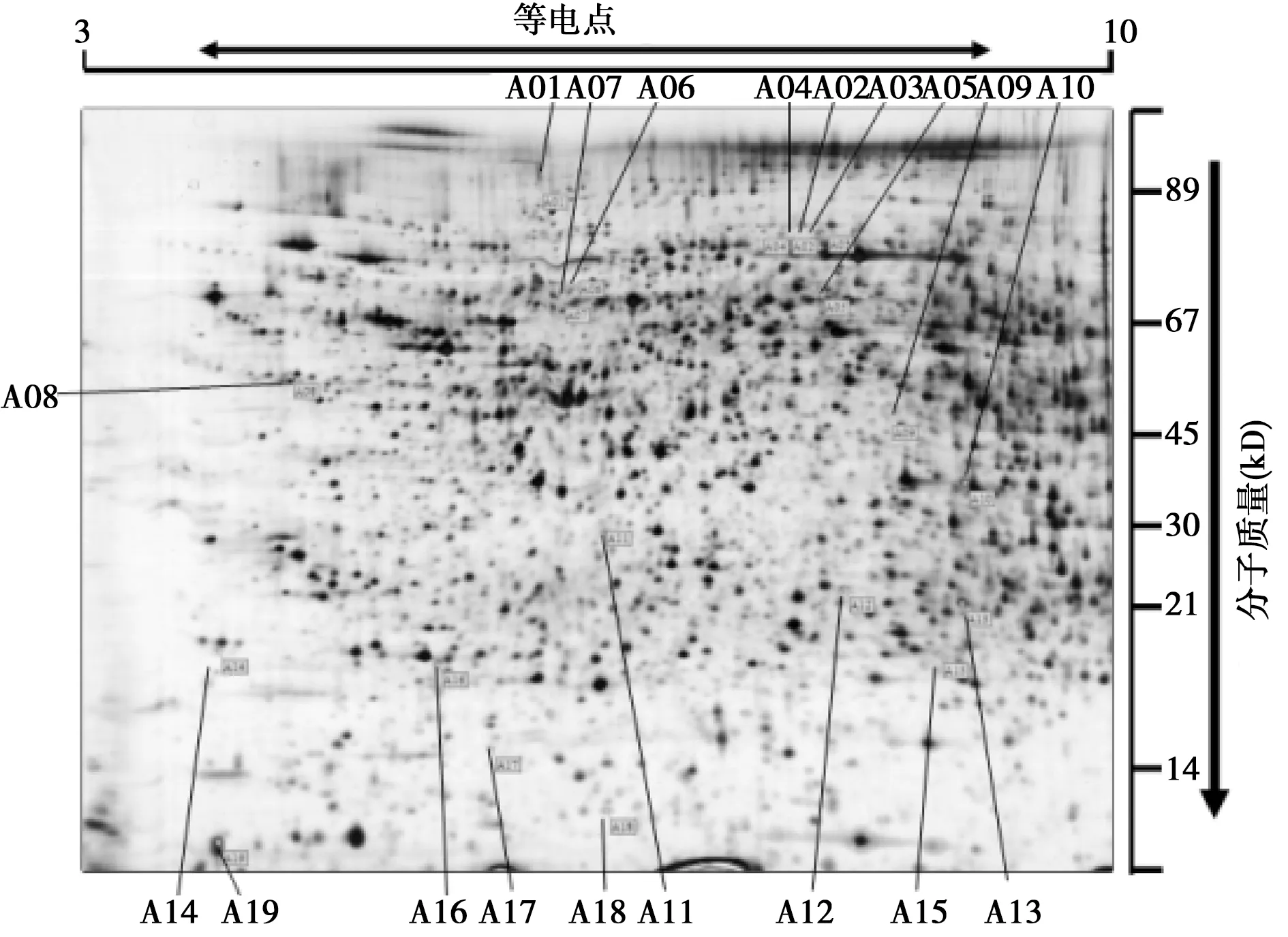
图1 运动组肝脏全蛋白2-DE
2.3差异蛋白质鉴定 对图3所显示的差异蛋白质进行逐一鉴定与分析(PMF和MASCOT网站提供的检索工具)。检索基本条件为:PMF图谱中的肽片段质量为600~3 000 Da,最大允许误差为0.2 Da,离子类型选择单同位素分子量〔M+H〕+,酶解的漏切位点为1/2个。对12个差异蛋白质斑点,其检索与比对结果见表2。蛋白质斑点均获得有意义检索结果,得分均>50分,具有一定的可信度。
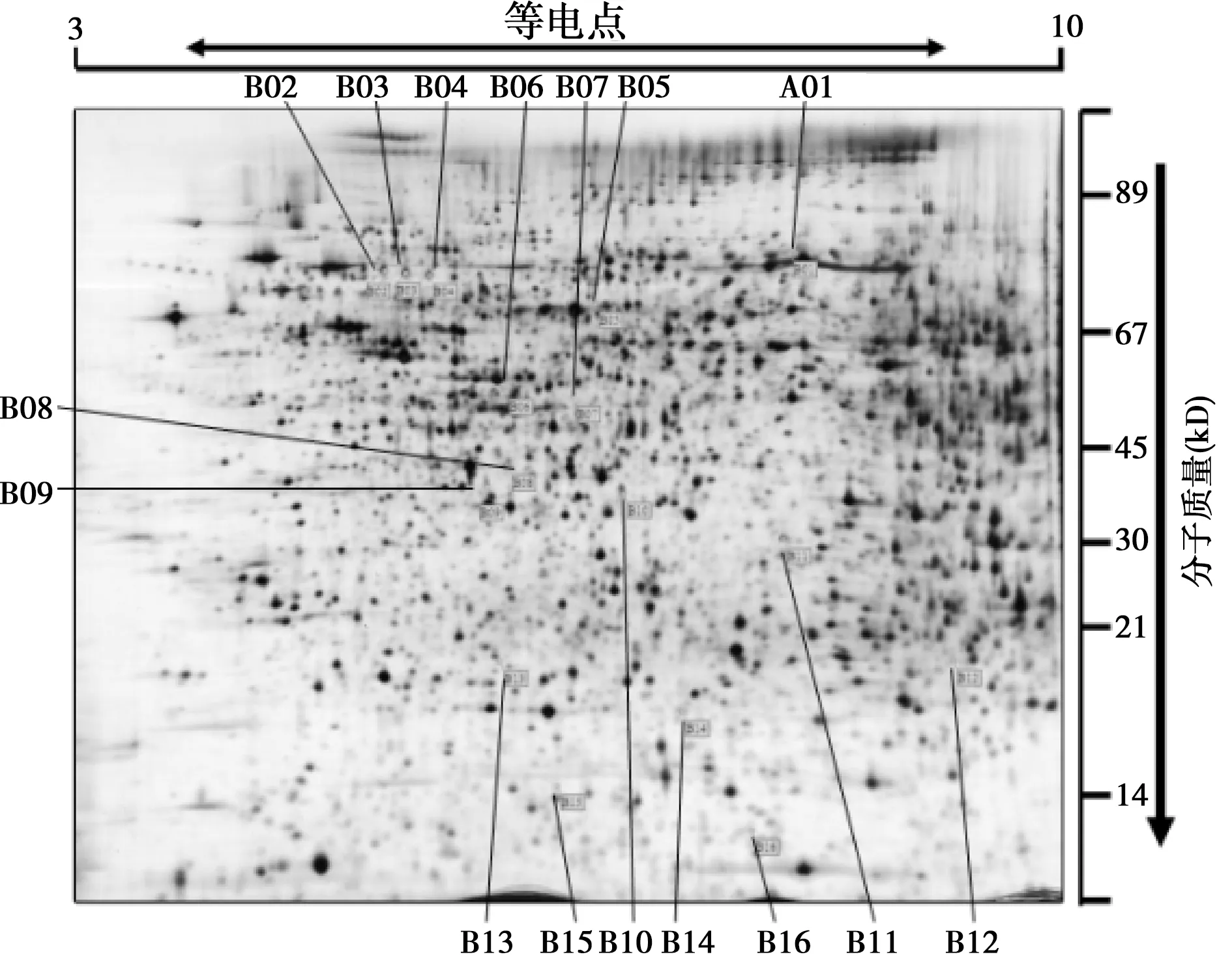
图2 对照组肝脏全蛋白2-DE

A.:对照组;B:8 w运动组图3 大鼠肝脏表达的差异蛋白质斑点局部放大图(×10)

表2 运动后增龄大鼠肝脏表达的差异蛋白质鉴定结果

续表2 运动后增龄大鼠肝脏表达的差异蛋白质鉴定结果
3 讨 论
3.1运动对增龄大鼠肝脏氧化-抗氧化系统的调节 除了作为体内最大实质消化器官,肝脏还兼具储存、分泌、解毒等代谢功能。如肝脏在增龄过程会因抗氧化酶活性下降导致肝细胞氧化应激损伤。Momchilova等〔20〕研究发现,增龄大鼠肝脏MnSOD、GSH活性显著降低,而活性氧和表征脂质过氧化的MDA显著增加。蒋春笋等〔11〕研究表明,中等强度有氧运动可通过降低线粒体膜通透性转换开放的敏感性来抑制衰老组织线粒体活性氧(ROS)产生,进而减轻线粒体的氧化损伤。研究证实,抗氧化物白藜芦醇也能通过调节GSH、MnSOD活性来保护增龄大鼠肝脏组织的氧化应激损伤〔20〕。总之,中等强度耐力运动可通过MnSOD、GSH活性来抑制增龄大鼠肝细胞线粒体活性氧的产生,进而维持肝细胞的氧化-抗氧化稳态。
3.2运动对肝脏蛋白质图谱的影响 本文参见万莉莉等〔17〕选用的丙酮/三氯乙酸(TCA)沉淀法提取大鼠肝脏全蛋白质,并进行了比较分析。结果表明,全蛋白质经2-DE分离后,选用丙酮/TCA沉淀法制备的大鼠肝脏全蛋白质斑点均有较高的分辨率,分布趋势较为均匀,蛋白分离较好,重复性较好。其中,经比较分析发现,pH3.0~10.0范围的载体两性电解质是最佳等电点分离区域,可有效分离全蛋白质和蛋白质组学研究。
本研究中对照组图谱与Hu等〔21〕文献中报道的大鼠肝脏组织的全蛋白图谱一致,但不同于大鼠的骨骼肌〔18〕、脑组织〔22〕和心肌组织〔23〕等全蛋白质分布特点。本研究结果推测,差异蛋白质斑点与运动提高肝脏抗氧化活性、延缓肝脏组织衰老的应激适应性蛋白质有关。
3.3运动对增龄大鼠肝脏蛋白质图谱差异蛋白分析 表2中的 12个差异蛋白质分别可分为5个功能类别:(1)脂肪酸合成及其炎症反应;(2)糖代谢;(3)抗氧化、解毒;(4)蛋白质稳态调节;(5)应激反应蛋白。
3.3.1脂代谢相关蛋白 脂肪酸合成酶(FAS)(A2)和11-羟化类固醇脱氢酶(11β-HSD1)(A10)主要存在于肝脏、脂肪等组织中,分别作为合成脂肪酸和催化无活性的可的松为氢化可的松关键酶,在调节机体糖脂代谢和炎症反应发挥重要作用。刘云〔24〕研究发现,11β-HSD1刺激3T3-Ll细胞的分化过程中与FAS的上调有关。快速老化小鼠(SAMP8)和增龄大鼠(22月龄)实验表明,增龄会诱导肝脏组织脂质代谢倾向于脂肪过度合成〔25〕,导致肝脏炎症反应和衰老的加剧,FAS〔26〕和11β-HSD1〔27〕扮演重要角色。与自然衰老大鼠模型相似,非酒精性脂肪肝大鼠模型进行运动训练后,发现小鼠肝脏FAS〔28〕、11β-HSD1〔29〕表达显著减少,从而有利于降低体内脂肪堆积和炎症反应。
3.3.2糖代谢相关蛋白 α-烯醇化酶(α-enolase)(A9)和葡萄糖磷酸变位酶(PGM)(B5)分别是糖酵解和糖原合成及分解的关键酶,二者与机体糖代谢、炎症反应和细胞凋亡密切相关。然而,肝细胞病变过程中,肝脏组织α-enolase分泌增加导致诱导肝脏纤维化和肝细胞损伤〔30〕;PGM表达水平减少导致肝细胞线粒体能量代谢水平及ATP合成降低,诱发肝细胞凋亡〔31〕。Lushchak等〔32〕研究发现,运动训练可增加肝细胞PGM蛋白表达,进而维持肝脏组织的能量平衡。
3.3.3抗氧化、脱毒性和凋亡相关蛋白 乙基丙二酸脑病变相关蛋白(ETHE1)(A13)基因编码硫加氧酶(SDO),在肝脏中高度表达,参与将线粒体中硫化氢(H2S)催化为无毒的硫酸盐〔33〕。ETHE1蛋白表达与机体的最大吸氧量呈正相关〔34〕,ETHE1蛋白表达下调易导致细胞内硫代谢途径失调,引发线粒体功能失调〔33〕。此外,ETHE1也能通过调节组蛋白去乙酰化酶(HDAC)1活性抑制p53诱导的肝细胞凋亡〔35〕。作为肝实质细胞角蛋白的重要组成之一,角蛋白8(K8)被认为是肝组织损伤和肝细胞凋亡的标示物〔36〕,对维持肝细胞结构和功能的完整具有重要的生理作用〔37〕,同时参与调控肝细胞线粒体的能量代谢和氧化应激过程〔38〕。S-腺苷甲硫氨酸合成酶(SAMs)催化底物L-甲硫氨酸和ATP生成S-腺苷甲硫氨酸(SAM),后者是主要体内的甲基供体及GSH的前体物质。肝脏组织SAMs失活导致的甲硫氨酸代谢途径失调引起肝细胞FAS表达增加和脂肪酸过度堆积,同时肝脏炎症因子过度表达,诱发肝细胞凋亡发生〔39〕。核基质结合因子(SAF)B是一种核基质结合因子,定位于核基质中,已被证实在多种细胞学的过程中发挥重要作用,包括RNA转录后加工,细胞增殖、应激反应、细胞衰老和凋亡等。研究表明,SAFB通过它的N-末端结合域与p53抑制p53转录活性,从而抑制其下游调控基因的转录〔40〕。
3.3.4蛋白质代谢相关蛋白 蛋白酶体β亚单位(PSMB)6参与构成26 S蛋白酶体蛋白水解的核心区,26 S是20 S蛋白水解酶家族成员之一。PSMB6对于维持肝组织功能、肝细胞活性具有重要作用〔41〕。Hayashi等〔42〕研究发现,增龄大鼠肝细胞内聚集大量无法水解的结构异常是蛋白质与26 S蛋白酶体含量减少有关。核糖核酸酶抑制因子(RNH)1是一种多功能的体内重要的调节分子,是核糖核酸酶(RNase)的抑制剂,它与RNase紧密结合,导致核糖核酸酶的活性受到抑制。在衰老过程中,人体RNH1活力下降,RNase活力上升,RNA降解加快和蛋白合成速度下降,引起组织萎缩、生理功能下降。结合本研究可推测,运动训练可通过调节26 S蛋白酶体和RNH1来优化肝脏组织的蛋白质代谢过程,维持蛋白质稳态。
3.3.5应激反应蛋白 在炎性应激刺激下,肝脏大量合成并分泌相关的急性期蛋白,如,触珠蛋白(HPT)、主要急性期蛋白(MAP)1。MAPα-1是一种正相急性期蛋白,又称T-kininogen 2,具蛋白酶抑制、巯基蛋白酶抑制剂、血管扩张的功能,在急性反应期对机体起保护作用。HPT主要由肝细胞分泌,与肥胖相关的肝脏组织纤维化的和肝脏胰岛素信号激活有关〔43〕。提示,肝脏组织的分泌行为适应性变化也介导了运动训练对肝脏组织的保护过程。然而值得指出的是,作为机体重要的内分泌组织,衰老大鼠的肝脏组织分泌行为在运动后的适应性变化在肝脏自身及系统性功能维护过程中扮演何种角色有待进一步研究揭示。
综上,中等强度低负荷量训练后增龄大鼠肝脏的蛋白质组表达图谱发生显著性变化;体育运动可能通过调节肝脏的糖脂代谢、蛋白质代谢、脱毒性和抗凋亡等过程来延缓肝脏组织衰老的作用。

