miR-296对人肺腺癌A549细胞恶性生物学行为的影响
刘洋,夏书月,武晶晶
(1.沈阳医学院附属中心医院呼吸与危重症医学科,沈阳 110024;2.中国医科大学生命科学学院医学遗传学教研室,沈阳 110122)
肺癌是全球发病率和死亡率最高的恶性肿瘤,恶性肿瘤致死病因中肺癌占27%,位于恶性肿瘤首位[1]。根据组织病理学特性将肺癌分为小细胞肺癌和非小细胞肺癌(non-small cell lung cancer,NSCLC),其中NSCLC占80%~85%。相对于其他类型的肺癌,NSCLC增殖、迁移较快,约75%患者发现时已处于中晚期,患者5年生存率较低[2]。
微小RNA是长约22 nt的非编码RNA,它能与目标靶基因特异性结合,通过调控靶基因的表达参与调控细胞分化、增殖、迁移以及凋亡等生理过程,在糖尿病、心力衰竭以及肿瘤等多种疾病的病理生理发展过程中发挥重要作用。研究[3-10]表明微小RNA-296(microRNA-296,miR-296)与结直肠癌、肝癌、胶质母细胞瘤、口腔鳞状细胞癌、胰腺癌、卵巢癌、子宫颈癌等肿瘤的发生密切相关,提示miR-296在肿瘤的发生发展中发挥重要的调控作用。然而目前关于miR-296对NSCLC的调控作用尚不清楚。本研究探讨miR-296在NSCLC增殖、凋亡和迁移等恶性生物学行为中的作用及其潜在的分子机制,旨在为NSCLC的治疗及研究提供新的理论依据及思路。
1 材料与方法
1.1 主要试剂及细胞株
人肺腺癌细胞系 A549细胞(中科院上海细胞库),DMEM/F12培养基[以色列Biological Industries(BI)公司],胎牛血清(美国Hyclone公司),miR-296抑制剂、阴性对照、引物[生工生物工程(上海)股份有限公司],jetPRIME 转染试剂(美国 Polyplus Transfection公司),TRIzol(美国Invitrogen公司),反转录试剂盒、universal SYBR qPCR master mix试剂盒、miRNA提取试剂盒、miRNA反转录试剂盒、miRNA universal SYBR qPCR master mix试剂盒、无内毒素质粒小提试剂盒(中国诺唯赞公司),细胞培养瓶、6孔板、24孔板、96孔板,Transwell小室(美国Corning公司),CCK8细胞增殖检测试剂盒(美国 Abbkine公司)、细胞凋亡试剂盒(日本东仁公司),结晶紫染液(北京索莱宝科技有限公司),BCA蛋白浓度检测试剂盒(中国碧云天公司),S100A4抗体(美国 Abbkine公司),Tublin抗体(中国Proteintech公司)。
1.2 细胞培养、分组及转染
含10%胎牛血清的DMEM/F12培养液,在37 ℃、5% CO2的恒温细胞培养箱中培养A549细胞,倒置显微镜下观察细胞生长情况,待细胞密度达80%~90%后,0.5%胰蛋白酶消化,按照1 ∶2传代培养。取对数生长期的细胞,2×105/孔接种于细胞培养板中,待细胞生长融合至60%左右时,按照jetPRIME 转染试剂说明书,分别将miR-296表达载体、抑制剂及相应阴性对照转染细胞。设置空白对照(Control)组、miR-296过表达[miR-296(+)]组、miR-296过表达阴性对照 [miR-296(-)]组、miR-296 抑制剂(inhibitor)组、miR-296抑制剂阴性对照(inhibitor NC)组。
1.3 实时荧光定量PCR
TRIzol-氯仿法提取细胞总RNA,茎环法反转录成cDNA,再以cDNA为模板,在Bio-rad CFX Connect系统中进行实时荧光定量PCR。引物序列:miR-296反转录引物,GTCGTATCCAGTGCAGGGTCCGAGG TATTCGCACTGGATACGACACAGGA;miR-296上游引物,5’-GAGGGCCCCCCCTCAA-3’,下游引物,5’-AGTGCAGGGTCCGAGGTATT-3’;RNU6-1上游引物,5’-CTCGCTTCGGCAGCACA-3’,下游引物,5’-AACGCTTCACGAATTTGCGT-3’。以RNU6-1为内对照,Bio-rad CFX Manager 3.1软件分析并计算Ct值。
1.4 CCK8法测定细胞增殖能力
转染A549细胞24 h后收集细胞,根据分组制成单细胞悬液并在显微镜下计数,按2×103/孔细胞接种于96孔板中,每孔加入100 μL培养液,培养箱中继续培养(12、24、48、72、96 h),每孔加10 μL CCK-8溶液,在培养箱中继续孵育1 h,利用多功能酶标仪测定450 nm波长处的吸光度(optical density,OD)值,并绘制细胞生长曲线。
1.5 平板克隆形成实验
细胞转染24 h后,胰蛋白酶消化制成细胞悬液,以2×103/孔细胞铺于6孔板中,反复吹打并摇匀,使细胞均匀分散,继续培养至每个集落>50个细胞,4%多聚甲醛固定细胞15 min,0.1%结晶紫染色30 min,在显微镜下计数并分析集落形成数。
1.6 凋亡实验
细胞转染72 h后胰酶消化收集细胞,PBS洗涤细胞2次,2 000 r/min离心5 min收集(1~5)×105个细胞,加入500 μL 结合缓冲液悬浮细胞,避光加入5 μL Annexin V-FITC和5 μL PI,混匀,室温避光反应15 min,转至流式检测管进行流式细胞仪检测。
1.7 Transwell实验
细胞转染72 h后胰酶消化并用无血清 DMEM/F12 培养基重悬,计数细胞,将细胞密度调节成3×104/mL,取 100 μL 接种到 Transwell(8 μm 孔径)小室的上室,下室中注入650 μL含10%血清的DMEM/F12培养基,设置3个复孔,继续培养24 h。PBS冲洗小室,用棉签将上室中未迁移的细胞蘸去,用 4%多聚甲醛固定已迁移至膜底部的细胞30 min,结晶紫染色30 min,PBS冲洗小室内外,将小室的滤膜用刀片小心切下放在载玻片上,加盖玻片,中性树脂胶封片。显微镜下计数上、下、左、右和中5个视野的穿膜细胞数,各视野平均穿膜细胞数表示肿瘤细胞的迁移能力。
1.8 Western blotting检测
细胞转染72 h后RIPA常规提取细胞总蛋白,按照BCA蛋白浓度测定试剂盒使用说明测定蛋白浓度。根据蛋白浓度调整各组样品体积,沸水煮10 min使蛋白充分变性,取30 μg蛋白SDS-聚丙烯酰胺凝胶电泳分离蛋白,100 V电压50 min将凝胶中蛋白转印到PVDF膜上,5%脱脂奶粉室温封闭1 h,S100A4抗体(1 ∶1 000稀释)、Tublin抗体(1 ∶2 000稀释)4 ℃孵育过夜,TBST洗膜,相应二抗(1 ∶5 000稀释)室温孵育1 h,TBST洗膜后,利用超敏ECL化学发光试剂盒、Bio-rad凝胶成像分析仪扫描分析蛋白丰度。
1.9 统计学分析
采用SPSS 23.0软件进行统计学分析,所有实验均重复3次,计量资料以表示,组间比较采用t检验,P< 0.05为差异有统计学意义。
2 结果
2.1 miR-296转染A549细胞转染效率的鉴定
结果显示,与miR-296(-)组比较,miR-296(+)组miR-296表达显著上调(P< 0.01);与inhibitor NC组比较,inhibitor组miR-296表达显著下调(P< 0.01),见表1,表明转染成功。
2.2 miR-296对A549细胞增殖能力的影响
结果显示,转染48 h后,与Control组和miR-296(-)组比较,miR-296(+)组A549细胞OD值显著降低;与Control组和inhibitor NC组比较,inhibitor组A549细胞OD值则显著升高,差异均有统计学意义(均P<0.05),说明miR-296对A549细胞的增殖能力起到抑制作用。见图1。
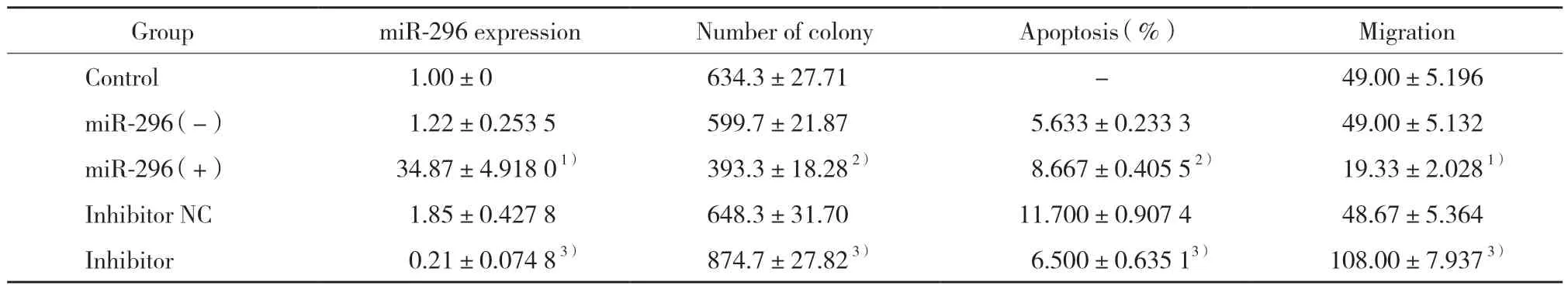
表1 各组A549细胞中miR-296表达、细胞克隆数量、凋亡、迁移能力比较Tab.1 Comparison of miR-296 expression,number of colonies,apoptosis,and migration in A549 cells
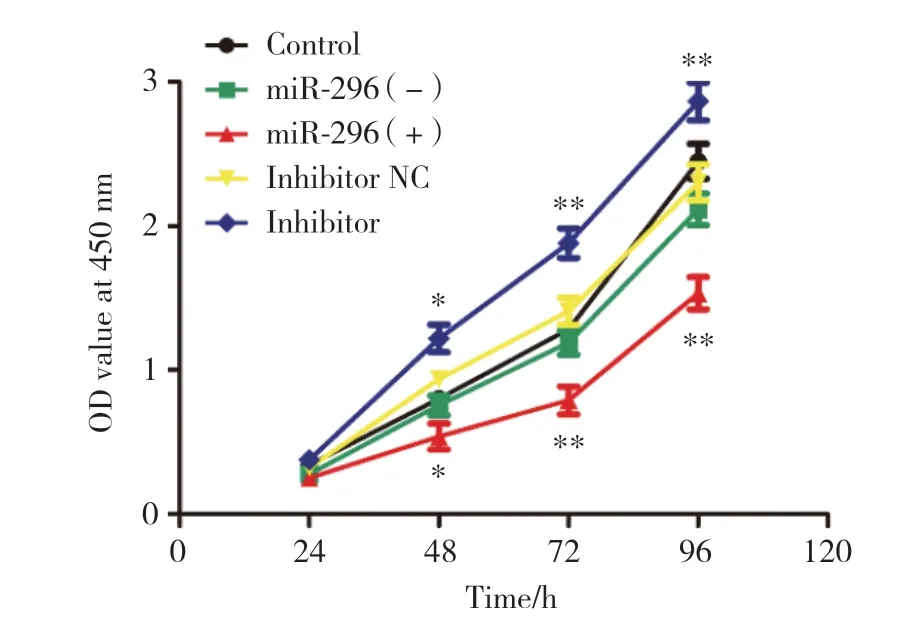
图1 miR-296对A549细胞增殖能力的影响Fig.1 Effect of miR-296 on the proliferation of A549 cells
2.3 miR-296对A549细胞克隆形成的影响
利用平板克隆技术分析miR-296对A549细胞克隆形成能力的影响,结果显示,与miR-296(-)组比较,miR-296(+)组A549细胞形成克隆体积更小、数量更少(P< 0.05),与inhibitor NC组和miR-296(+)组比较,inhibitor组A549细胞形成克隆体积更大、数量更多(P< 0.05,P< 0.01),说明miR-296能抑制A549细胞的克隆形成能力。见表1、图2。
2.4 miR-296对A549细胞凋亡的影响
流式Annexin-FITC/PI双染法分析miR-296对A549细胞凋亡率的影响,结果显示,与miR-296(-)组比较,miR-296(+)组A549细胞的凋亡率显著增加(P< 0.05);与inhibitor NC组比较,inhibitor 组A549细胞的凋亡率显著减少(P< 0.05),说明miR-296促进A549细胞凋亡。见表1、图3。
2.5 miR-296对A549细胞迁移能力的影响
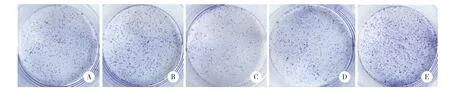
图2 miR-296对A549细胞克隆形成的影响Fig.2 Effect of miR-296 on clone formation potential of A549 cells.
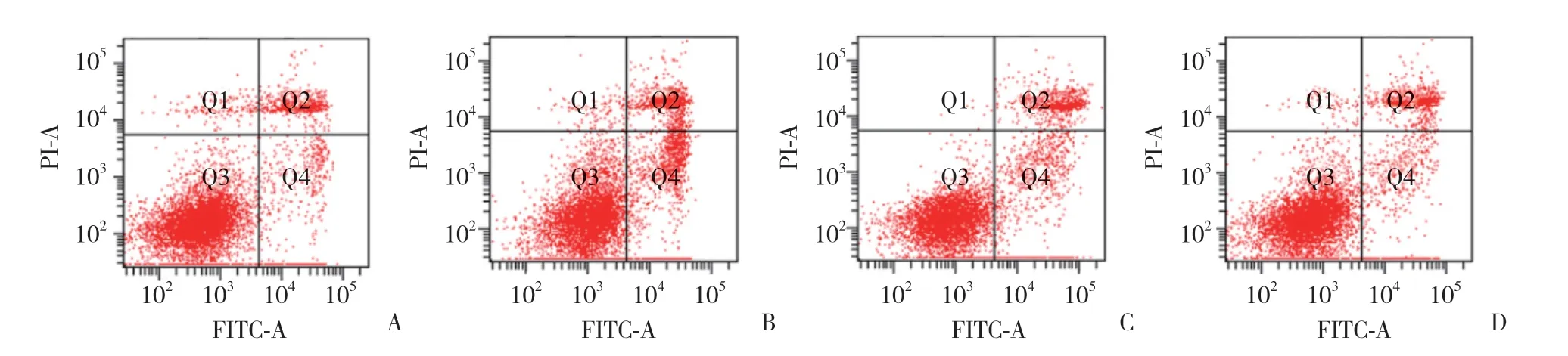
图3 miR-296对A549细胞凋亡的影响Fig.3 Effect of miR-296 on A549 cell apoptosis
Transwell细胞迁移实验分析miR-296对A549细胞迁移能力的影响,结果显示,与miR-296(-)组比较,miR-296(+)组A549细胞迁移能力显著降低(P< 0.01);与inhibitor NC组和miR-296(+)组比较,inhibitor组A549细胞迁移能力显著升高(均P<0.01),说明miR-296对A549细胞的迁移能力起到抑制作用。见表1、图4。

图4 miR-296对A549细胞迁移能力的影响 ×200Fig.4 Effect of miR-296 on the migration ability of A549 cells ×200
2.6 miR-296对A549细胞S100A4蛋白表达的影响
结果显示,与miR-296(-)组比较,miR-296(+)组A549细胞S100A4蛋白表达显著下调(P< 0.05),与inhibitor NC组和miR-296(+)组比较,inhibitor组A549细胞S100A4蛋白表达显著上调(P< 0.05,P<0.01),说明miR-296抑制A549细胞S100A4蛋白表达。见图5。
3 讨论
NSCLC包括鳞状细胞癌、腺癌和大细胞癌。与小细胞肺癌比较,NSCLC增殖、迁移相对较快,多数患者发现时已处于中晚期。因此,明确影响NSCLC增殖、迁移的因素是目前临床急需解决的难题。
近些年随着研究的不断深入,发现越来越多的微小RNA能够参与调控肿瘤细胞分化、增殖、凋亡、侵袭、转移及上皮间质转化(epithelialmesenchymal transition,EMT)等生物学特性,进而影响肿瘤的发生发展[11]。miR-296定位于20q13.32,具有高度的保守性,在许多生命活动中发挥着重要的调控作用。
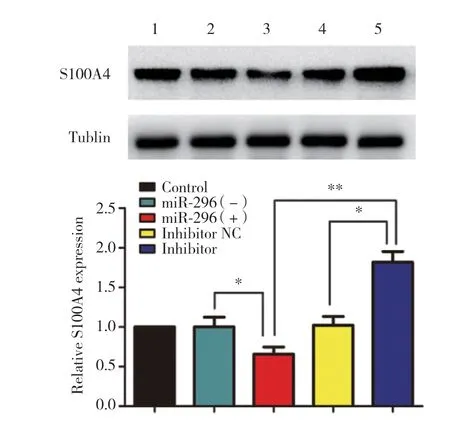
图5 miR-296对A549细胞中S100A4蛋白表达的影响Fig.5 Eeffect of miR-296 on S100A4 levels in A549 cells.
大量证据表明miR-296参与肿瘤的调控作用,而且不同肿瘤中的调控作用亦不同。VAIRA 等[12]研究发现miR-296在许多肿瘤组织中表达缺失,且与结直肠癌、乳腺癌、胃癌、甲状腺癌、肝癌等肿瘤的转移密切相关。VAIRA 等[12]利用人乳腺癌细胞MDA-MB231证明了miR-296发挥着重要的肿瘤抑制作用。有研究[9]报道抑制miR-296能够通过诱导EMT促进卵巢癌细胞侵袭,而恢复miR-296表达后肿瘤增殖生长被抑制[12-13],以上结果均表明miR-296发挥抑制肿瘤的作用。然而也有研究显示miR-296起到促进肿瘤生长的作用,LEE等[6]发现miR-296-5p 通过SOCS2/STAT3下调NF2受体和Caspase-8促进胶质母细胞瘤侵袭。本研究结果显示转染miR-296表达载体后,A549细胞增殖、克隆形成及细胞迁移能力显著降低,细胞凋亡率明显上升(均P< 0.05);抑制miR-296后,A549细胞增殖、克隆形成及迁移能力显著升高,凋亡率降低(均P< 0.05),提示miR-296在A549细胞中发挥肿瘤抑制作用。
S100A4是S100 蛋白家族中的一员,是一种小Ca2+结合蛋白,正常组织中不表达或低表达,而在许多肿瘤(胃癌、乳腺癌、前列腺癌、肺癌等[14-17])中高表达,并且在恶性转化、血管生成、迁移和侵袭中发挥调控作用。有研究[18]表明miR-296通过靶向调控S100A4抑制结直肠癌EMT。本研究结果发现miR-296过表达时S100A4蛋白表达下调,而抑制miR-296表达S100A4蛋白表达上调,提示miR-296可能通过靶向调控S100A4表达影响A549细胞的恶性生物学行为。
综上所述,miR-296抑制人肺腺癌A549细胞的增殖、迁移,促进凋亡,其作用机制可能是通过靶向调控S100A4表达来实现的,本研究为NSCLC的临床治疗提供新的靶点和理论基础。目前,miR-296/S100A4调控人肺腺癌A549细胞恶性生物学行为的具体机制尚不清楚,仍需进一步研究论证。

