胃食管反流对慢性间歇低氧大鼠呼吸系统的影响
李佳桐,刘丹,孔灵菲,王玮
(中国医科大学附属第一医院呼吸与危重症医学科,沈阳 110001)
阻塞性睡眠呼吸暂停低通气综合征(obstructive sleep apnea-hypopnea syndrome,OSAHS)主要引起睡眠片段化和慢性间歇低氧(chronic intermittent hypoxia,CIH)的病理生理学改变,CIH被认为是OSAHS作为源头性疾病影响全身的重要病理生理机制。胃食管反流性疾病(gastroesophageal reflux disease,GERD)主要发病机制为食管下括约肌压力降低和一过性食管下括约肌松弛。SHEPHERD等[1]发现,OSAHS患者较普通人群夜间出现胃食管反流症状的次数更多,而且经持续气道正压治疗后症状显著减轻。反之,也有研究表明GERD与更严重的OSAHS相关。YOU等[2]发现,GERD患者患OSAHS的风险显著高于正常人;DEMETER等[3]的研究也表明,经内镜确诊的GERD患者呼吸暂停低通气指数更高;KIM等[4]进一步证实,GERD患者具有更高的呼吸暂停低通气指数、更长的睡眠呼吸暂停时间以及更低的血氧饱和度。动物研究[5]也证实,GERD大鼠模型会出现睡眠片段化和更频繁的睡眠时相转换。但也有研究[6]认为,OSAHS和GERD只是通过共同危险因素肥胖相关联。OSAHS和GERD之间可能存在关联,但仍缺少确切证据。本研究拟通过反复食管盐酸灌注构建大鼠GERD模型,探究常氧和CIH条件下GERD对呼吸系统的影响。
1 材料与方法
1.1 实验对象
SPF级雄性Wistar大鼠40只,6~7周龄,体质量200~250 g,购自北京维通利华实验动物有限公司,于20~25 ℃的环境中饲养,给予12 h昼夜循环,自由进食生长维持性饲料和水。采用随机数字表法分成常氧组(Norm组)和CIH组,每组20只。各组内均分别给予生理盐水(normal saltine,NS)和盐酸(HCI)灌注,即常氧生理盐水灌注组(Norm+NS组)、常氧盐酸灌注组(Norm+HCl组)、CIH生理盐水灌注组(CIH+NS组)、CIH盐酸灌注组(CIH+HCl组),每组10只。
1.2 实验方法
1.2.1 CIH大鼠模型制备:将CIH组大鼠置于低氧舱内(OxyCycler Model A84 versionl.2,美国BioSherix公司),根据文献[7]的方法,向舱内循环充入氮气和氧气,每一循环过程为180 s,即45 s充入氮气,使舱内最低氧气浓度达到5%,维持60 s,随后45 s 充入氧气,使舱内氧气浓度达到21%,维持30 s。每天持续8 h,持续7周。Norm组大鼠与CIH组喂养条件一致,但仅置于空气环境中。
1.2.2 酸反流大鼠模型制备:Norm+HCl组大鼠腹腔注射10%水合氯醛(0.3 mL/100 g)麻醉后取仰卧位,将5F胃管缓慢下入大鼠食管中下段并固定,通过微量输液泵(Perfusor Compact 5,德国Braun公司)进行盐酸(pH1,含0.05%胃蛋白酶)灌注,灌注速度24 mL/h,每次20 min,1次/d,持续21 d。Norm+NS组大鼠采用同样方法灌注NS。CIH+HCl组大鼠于CIH 4周后在每日低氧结束后30 min采用同样方法灌注盐酸,CIH+NS组大鼠采用同样方法灌注NS。
1.2.3 气道反应性评价:分别于灌注前1天以及灌注第7、14和21天将大鼠置于小动物无创肺功能仪(Iox2,法国Emka公司)体描箱内,检测其增强呼气间歇(enhanced pause,Penh)值。参考KO等[8]的方法,给予大鼠200 μL NS以及梯度浓度的乙酰甲胆碱(methylcholine,MCh),采集Penh值。计算每只大鼠在不同浓度MCh下Penh值(PenhMCh)与雾化NS后Penh基础值(PenhNS)的比值PenhMCh/PenhNS,以Penh初始值和PenhMCh/PenhNS评价气道反应性。
1.2.4 支气管肺泡灌洗:末次灌注24 h后采用10%水合氯醛腹腔注射麻醉大鼠,剪开其胸腔并立即暴露气管,向气管内缓慢注入5 mL PBS进行支气管肺泡灌洗,计数支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)细胞,并同步获取血标本。通过酶联免疫吸附试验检测血清和BALF中趋化因子配体1[chemokine(C-X-C motif)ligand 1,CXCL1]和C反应蛋白(C-reactive protein,CRP)水平。
1.2.5 HE染色:末次灌注24 h后按前述方法麻醉大鼠,全身灌流后固定大鼠气管和肺组织,脱水透明后用HE染液(中国Biosharp公司)染色。于光镜(Eclipse ci,日本NIKON公司)下对比观察各组织炎症改变情况(成像系统:Digital sight DS-FI2,日本NIKON公司)。
1.3 统计学分析
采用SPSS 20.0进行统计分析。数据以表示,检验数据的正态性和方差齐性,方差齐时采用独立样本t检验,方差不齐时采用Mann-WhitneyU检验。P< 0.05为差异有统计学意义。
2 结果
2.1 组织病理学结果
与Norm+NS组相比,Norm+HCl组大鼠气道组织上皮不连续,终末细支气管壁增厚、断裂,肺泡壁轻度增厚,其内出现炎症细胞浸润。与CIH+NS组相比,CIH+HCl组大鼠气道黏膜层部分脱落、固有层裸露,除肺泡内散在炎症细胞浸润外,还出现典型嗜终末细支气管周围炎症细胞聚集现象。见图1。
2.2 各组气道反应性的评价
与Norm+NS组相比,Norm+HCl组Penh值升高(t=-2.319,P=0.049)。与CIH+NS组相比,CIH+HCl组Penh值也升高(t=-2.768,P= 0.024)。见图2。

图1 NS与盐酸灌注21 d后大鼠气管和肺的组织病理学改变 HE ×200Fig.1 Histopathological changes in the tracheas and lungs of the rats in each group on day 21 of perfusion with normal saline or hydrochloric acid HE ×200

图2 灌注第21天各组大鼠Penh值的比较Fig.2 Penh values of the rats on day 21 of perfusion
MCh激发试验结果表明,盐酸灌注14 d后,与CIH+NS组相比,CIH+HCl组PenhMCh/PenhNS增大(t=-3.657,P=0.006)。盐酸灌注21 d后,与Norm+NS组相比,Norm+HCl组PenhMCh/PenhNS才开始增大(t=-2.422,P=0.042)。见图3。
盐酸灌注21 d后,Norm组和CIH组大鼠在给予16、32、64 mg/mL MCh后PenhMCh/PenhNS均增大。分别在3种浓度MCh下比较Norm组与CIH组的Δ(PenhMCh/PenhNS),以该值代表气道对MCh的反应性,该值越大则气道对MCh反应性越高。MCh浓度为32 mg/mL时,与Norm组相比,CIH组Δ(PenhMCh/PenhNS)增大(t=-6.61,P< 0.001)。当MCh浓度为64 mg/mL时,与Norm组相比,CIH组Δ(PenhMCh/PenhNS)也增大(t=-3.13,P=0.014)。盐酸灌注后CIH组大鼠气道对MCh反应性更高。见表1。
2.3 各组间BALF细胞总数和分类计数的比较
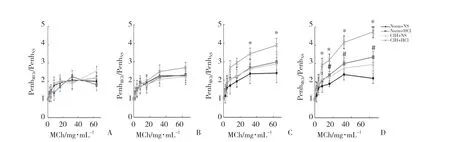
图3 给予梯度浓度MCh后各组大鼠气道反应性的比较Fig.3 Airway responsiveness of the rats in each group after exposure to a gradient concentration of methylcholine

表1 灌注第21天Norm组与CIH组Δ(PenhMCh/PenhNS)的比较Tab.1 Δ(PenhMCh/PenhNS)values of Norm and CIH groups on day 21 of perfusion
与Norm+NS组相比,Norm+HCl组大鼠BALF细胞总数(t=-3.886,P=0.005)、中性粒细胞(t=-2.631,P=0.03)和淋巴细胞(t=-6.097,P< 0.001)增多。与CIH+NS组比,CIH+HCl组大鼠BALF细胞总数(t=-3.466,P=0.008)、中性粒细胞(t=-3.214,P=0.012)和淋巴细胞(t=-9.940,P< 0.001)增多。
与中性粒细胞ΔNorm相比,其ΔCIH升高(t=-2.440,P=0.041)。与淋巴细胞ΔNorm相比,其ΔCIH升高(t=-2.448,P=0.040)。即与Norm组相比,盐酸灌注后CIH组大鼠BALF中性粒细胞和淋巴细胞进一步增多。见图4。
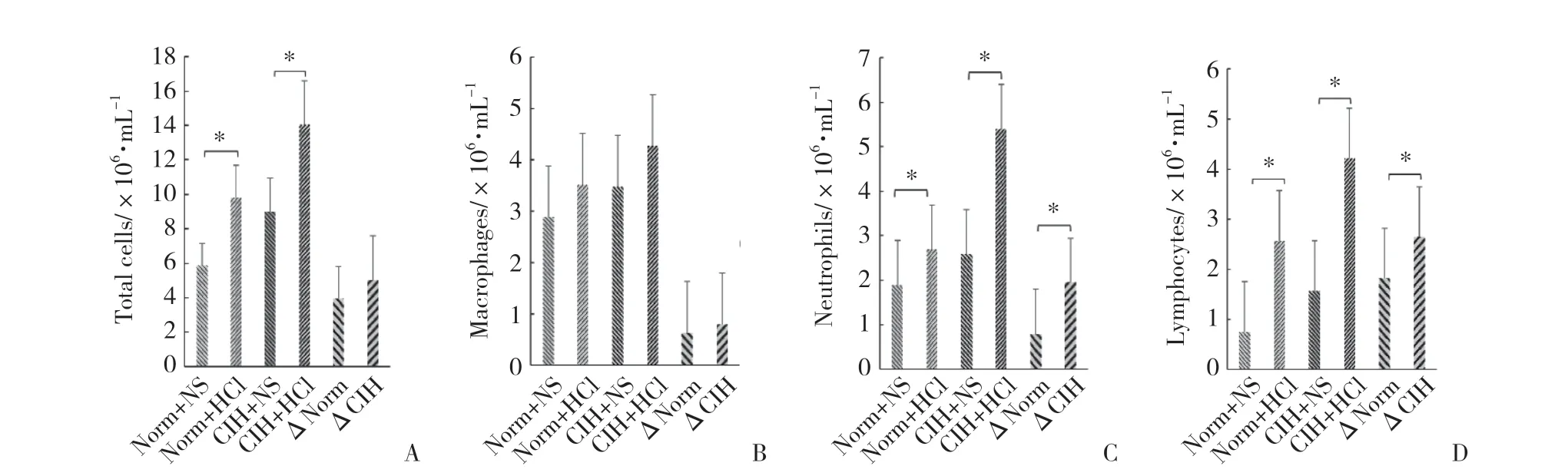
图4 各组BALF细胞总数和分类计数的比较Fig.4 The numbers of inflammatory cell types and cells in total in BALF in each group
2.4 各组CXCL1和CRP水平的比较
与Norm+NS组相比,Norm+HCl组大鼠BALF中CXCL1水平升高(t=-3.680,P=0.010)。与CIH+NS组相比,CIH+HCl组大鼠BALF中CXCL1(Z=-2.309,P=0.029)和CRP(t=-3.129,P=0.014)水平升高,血清CRP水平升高(t=-4.100,P=0.003)。
与BALF中CXCL1的ΔNorm相比,其ΔCIH升高(Z=-2.309,P=0.029)。与BALF中CRP的ΔNorm相比,其ΔCIH升高(t=-3.129,P=0.014)。与血清CRP的ΔNorm相比,其ΔCIH升高(t=-1.056,P=0.322)。即与Norm组相比,盐酸灌注后大鼠BALF中CXCL1和CRP水平进一步升高,血清CRP水平进一步升高。见图5。
3 讨论
GERD通过反流、反射和微吸入影响呼吸系统。动物研究证实,反复食管盐酸灌注会导致气道重塑、多种炎症细胞浸润、气管平滑肌过度反应[9]及胆碱能神经元激活[10],进而导致气道反应性增高。OSAHS的主要病理生理机制为睡眠片段化和CIH,目前研究多从睡眠障碍角度探究GERD对OSAHS的影响,尚未见GERD对CIH相关损伤的研究。本研究发现,反复食管盐酸灌注可导致大鼠呼吸系统结构损伤、气道反应性升高和炎症水平升高。并进一步发现,与常氧条件下相比,盐酸灌注后CIH大鼠对MCh的反应性更高、呼吸系统局部和全身炎症水平更高。本研究首次探究了盐酸灌注对CIH大鼠呼吸系统的动态损伤,在盐酸灌注14 d后开始出现对CIH大鼠气道反应性的影响,而21 d后才出现对常氧大鼠气道反应性的影响。

图5 各组间CXCL1和CRP水平的比较Fig.5 CXCL1 and CRP levels in each group
APPEL等[11]对大鼠进行4~16周左肺每日1次150 μL的盐酸灌注,结果表明,盐酸反复微吸入会导致肺部淋巴细胞和巨噬细胞浸润,出现慢性肺损伤。CHENG等[9]证实对豚鼠进行持续14 d、每次20 min的食管盐酸灌注,使其气管平滑肌过度反应,并使肺阻力增大。CUI[10]对小鼠进行持续21 d、每天2次的食管盐酸灌注,使其气道结构重塑,导致离体气管环在MCh刺激后产生更强的等长收缩,提示其气道反应性升高。本研究对大鼠进行持续21 d、每天20 min的食管盐酸灌注后,其气管黏膜受损,且气道反应性增高。进一步研究发现,盐酸灌注后常氧大鼠BALF中性粒细胞和淋巴细胞增多,且CXCL1水平升高,考虑炎症反应是出现上述现象的关键环节。GERD微吸入相关的呼吸系统炎症中胃蛋白酶能驱动中性粒细胞浸润并导致气管黏膜屏障破坏[12],且白细胞介素-8在该趋化浸润过程中具有特异作用[13]。大鼠研究中普遍用CXCL1替代白细胞介素-8反映中性粒细胞趋化程度[14]。本研究结果提示,CXCL1这种特异性趋化作用仅局部作用于呼吸系统,且常氧条件下并未产生全身水平的炎症反应。
同时,本研究首次探究了反复盐酸灌注对CIH大鼠气道反应性的影响,盐酸灌注第21天Penh值升高。常氧与CIH条件下的升高程度未见差异。但MCh激发试验表明,CIH大鼠能被激发出更高的反应性且出现的时间更早,该现象的具体机制仍不清楚。进一步研究发现,盐酸灌注后CIH大鼠BALF中性粒细胞和淋巴细胞进一步增多,并产生了全身水平的炎症反应,但CXCL1趋化作用仍局限于呼吸系统。这提示对于气道反应性高的患者,特别是气道反应性高的OSAHS患者,要注意是否合并胃食管反流。值得注意的是,应用抑酸剂的GERD患者胃液中胃蛋白酶浓度更高,而CXCL1主要受胃蛋白酶驱动,单独应用抑酸剂可能会增加胃酸中胃蛋白酶浓度,从而加重呼吸系统炎症反应[12]。
本研究存在一定局限性。Norm组与CIH组大鼠来自同一群体,但由于Norm组是在常氧时直接灌注盐酸而CIH组在低氧暴露4周后才开始灌注盐酸,造成Norm组与CIH组大鼠造模结束时鼠龄不同。为了体现Norm组与CIH组的差异,本研究对Norm组与CIH组的组内差值进行了比较。结果发现,与Norm组相比,CIH组大鼠盐酸灌注后气道反应性和炎症水平进一步升高。
综上所述,反复盐酸灌注使大鼠出现气道和肺的结构损伤,导致气道反应性升高,这可能与炎症水平增高有关。在CIH条件下,这种气道反应性更高且出现更早,炎症水平更高,损伤更重。这提示,当OSAHS患者出现胃食管反流时,其气道和肺损伤会更明显。对于OSAHS合并GERD的患者,应积极治疗OSAHS疾病本身,改善CIH,同时控制胃食管反流。

