不同表面处理和设计的人工晶状体生物相容性的实验研究
王丝雨,石栋,陆博,韩琳,马立威,2
(1.中国医科大学附属第四医院眼科,中国医科大学眼科医院,辽宁省晶状体学重点实验室,沈阳 110005;2.沈阳爱尔卓越眼科医院眼科,中南大学爱尔眼科学院,沈阳 110001)
人工晶状体(intraocular lens,IOL)植入眼内后会与眼内生物组织环境相互作用,发生一系列与生物相容性有关的反应。生物相容性指生物材料植入体内后,与体内组织相容而不引起有害变化的能力[1]。IOL的生物相容性包括葡萄膜生物相容性、囊膜生物相容性和囊袋内旋转稳定性[2]。通过不同材料、设计、表面处理等手段提高IOL的生物相容性,对于减少术后并发症和优化手术效果有重要的价值[3]。本研究针对具有不同表面处理方式及袢表面设计的HOYA Vivinex XY1 IOL及AMO Tecnis PCB00 IOL的生物相容性进行体内研究,观察术后前房闪辉、后囊膜混浊、IOL旋转角度及晶状体上皮细胞的增殖移行情况,比较二者植入兔眼后的葡萄膜生物相容性、囊膜生物相容性及囊袋内旋转稳定性。
1 材料与方法
1.1 材料
1.1.1 IOL:HOYA Vivinex XY1 IOL(日本豪雅株式会社),袢表面磨砂化处理,光学部经紫外线/臭氧后表面处理。AMO Tecnis PCB00 IOL(美国眼力健公司),袢表面光滑,光学部经聚乙二醇全表面处理。2种IOL均为疏水性丙烯酸酯材料,一体式双袢型,光学部直径6 mm,总直径13 mm,改良C袢,360°锐利直角边缘设计,屈光度+20.00 D。
1.1.2 实验动物:新西兰白兔(由中国医科大学实验动物中心提供)10只(20眼),雌雄不限,体质量2.0~2.5 kg,8~10周龄,眼部检查无异常。
1.2 方法
1.2.1 实验分组:20只兔眼均行晶状体超声乳化吸除联合IOL植入术,每只兔随机选择左右眼分别植入不同的IOL,植入HOYA Vivinex XY1 IOL的兔眼为A组,植入AMO Tecnis PCB00 IOL的兔眼为B组。本研究采用随机双盲法,即术者及检查者均不知实验动物分组。
1.2.2 术前准备:术前2 d开始用盐酸左氧氟沙星滴眼液点眼(4次/d)。手术当日术前用复方托吡卡胺滴眼液点眼至瞳孔充分散开。
1.2.3 麻醉方法:耳缘静脉注射20%氨基甲酸乙酯溶液(7.5 mL/kg)麻醉,以呼吸规则平稳、角膜反射迟钝、全身肌肉松弛、皮肤夹捏反射消失为全身麻醉到位标准,必要时适当追加麻醉剂量。
1.2.4 手术方法:所有手术由同一经验丰富的眼科医师完成。将全身麻醉成功的新西兰白兔仰卧位固定于兔台上,碘伏常规消毒术眼,铺无菌孔巾,开睑器开睑,制作3.2 mm透明角膜切口,前房内注入黏弹剂,中央连续环形撕囊,撕囊直径约5 mm,水分离,超声乳化吸除晶状体核及皮质,囊袋内注入黏弹剂,植入IOL于囊袋内,吸除残留的黏弹剂,水密切口。利用眼科手术显微镜目镜自带角度刻度盘,调整显微镜使投射到术野的角度刻度盘中心线通过IOL袢根部中点,在此方位上用10/0尼龙缝线于角膜缘外1 mm处进针,针距1 mm带浅层巩膜出针打结,此浅层巩膜缝线进针点即为IOL袢标记点。球结膜下注射地塞米松磷酸钠注射液2 mL,结膜囊内涂妥布霉素地塞米松眼膏,术毕。
1.2.5 术后护理:每天给予术眼妥布霉素地塞米松滴眼液4次,盐酸左氧氟沙星滴眼液4次,复方托吡卡胺滴眼液2次。
1.2.6 前房闪辉评分:术后1、7、14、28 d,兔眼充分散瞳,采用裂隙灯显微镜(×16)直接照明法观察前房闪辉情况并分级评分。将前房闪辉分为5级,即0级(0分)为无前房闪辉;1级(1分)为微弱的前房闪辉;2级(2分)为中度的前房闪辉,可以辨别虹膜和晶状体细节;3级(3分)为显著的前房闪辉,虹膜和晶状体细节难以辨认;4级(4分)为严重的前房闪辉,房水呈凝固状态,伴有大量纤维素性渗出物。所有前房闪辉分级评分由同一位检查者完成。
1.2.7 晶状体后囊膜混浊评分:术后1、7、14、28 d,兔眼充分散瞳,采用裂隙灯显微镜红光后照法观察晶状体后囊膜混浊情况(×16),使用裂隙灯眼前节照相系统拍摄清晰后囊膜图像,将图像导入本课题组自行开发研制的后发性白内障计算机图像定量分析系统(PCO-computer aided analysis system,PCOCAAS)[4]进行后囊膜混浊评分。所有后囊膜图像拍摄及评分由同一位检查者完成。
1.2.8 IOL旋转角度测量:术后1、7、14、28 d,兔眼充分散瞳,采用裂隙灯显微镜红光后照法观察IOL位置(×16)。调整新西兰白兔头位,保持兔眼IOL平面与裂隙灯观察平面平行,暴露浅层巩膜缝线,使用裂隙灯眼前节照相系统拍摄清晰眼前节图像。利用系统自带量角器功能,调整量角器边缘与IOL光学部边缘重合,定位IOL光学部中心点,自中心点分别向IOL袢根部中点及浅层巩膜缝线进针点连线,2连线间角度即IOL旋转角度。所有眼前节图像拍摄及测量由同一位检查者完成。
1.2.9 组织病理学检查:术后28 d用空气栓塞法处死新西兰白兔,立即摘除眼球,经石蜡包埋切片后常规HE染色,于光学显微镜下(×100)观察后囊膜晶状体上皮细胞增殖移行情况。
1.3 统计学分析
采用SPSS 23.0软件进行统计分析。计量资料采表示,采用配对样本t检验比较,P< 0.05为差异有统计学意义。
2 结果
所有兔眼手术顺利,术中及术后未出现晶状体后囊膜破裂及眼内感染等并发症。
2.1 前房闪辉评分
术后7 d,2组前房闪辉最为明显,随时间延长逐渐减弱,至术后28 d前房闪辉基本消失。术后1 d、7 d,A组平均前房闪辉评分大于B组,差异有统计学意义(P< 0.05);术后14 d、28 d,A组与B组平均前房闪辉评分差异无统计学意义(P> 0.05),见表1。
2.2 后囊膜混浊评分
A组于术后14 d开始出现后囊膜混浊,见图1、图2。B组于术后7 d开始出现后囊膜混浊,见图3。随着时间延长,2组后囊膜混浊程度逐渐加重。术后7 d、14 d、28 d A组平均后囊膜混浊评分小于B组,差异有统计学意义(P< 0.05),见表2。
表1 术后各时间点平均前房闪辉评分()Tab.1 The mean anterior chamber flare score at each time piont after surgery()

表1 术后各时间点平均前房闪辉评分()Tab.1 The mean anterior chamber flare score at each time piont after surgery()
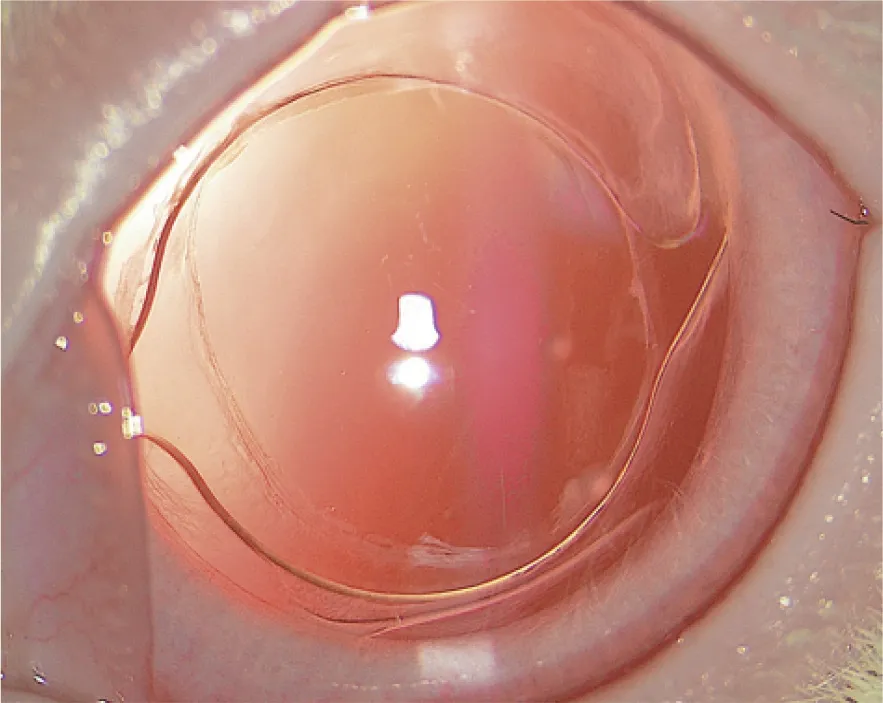
图1 A组术后7 d裂隙灯检查未见后囊膜混浊 ×16Fig.1 No posterior capsular opacity observed by slit lamp inspection in group A at 7 days after surgery ×16
2.3 IOL旋转角度
A组术后1 d、7 d、14 d、28 d IOL平均旋转角度无明显变化。B组术后1 d、7 d、14 d随时间延长IOL平均旋转角度增加,术后14 d、28 d IOL平均旋转角度趋于稳定,见图4。术后1 d、7 d、14 d、28 d A组IOL平均旋转角度小于B组,差异有统计学意义(P< 0.05),见表3。
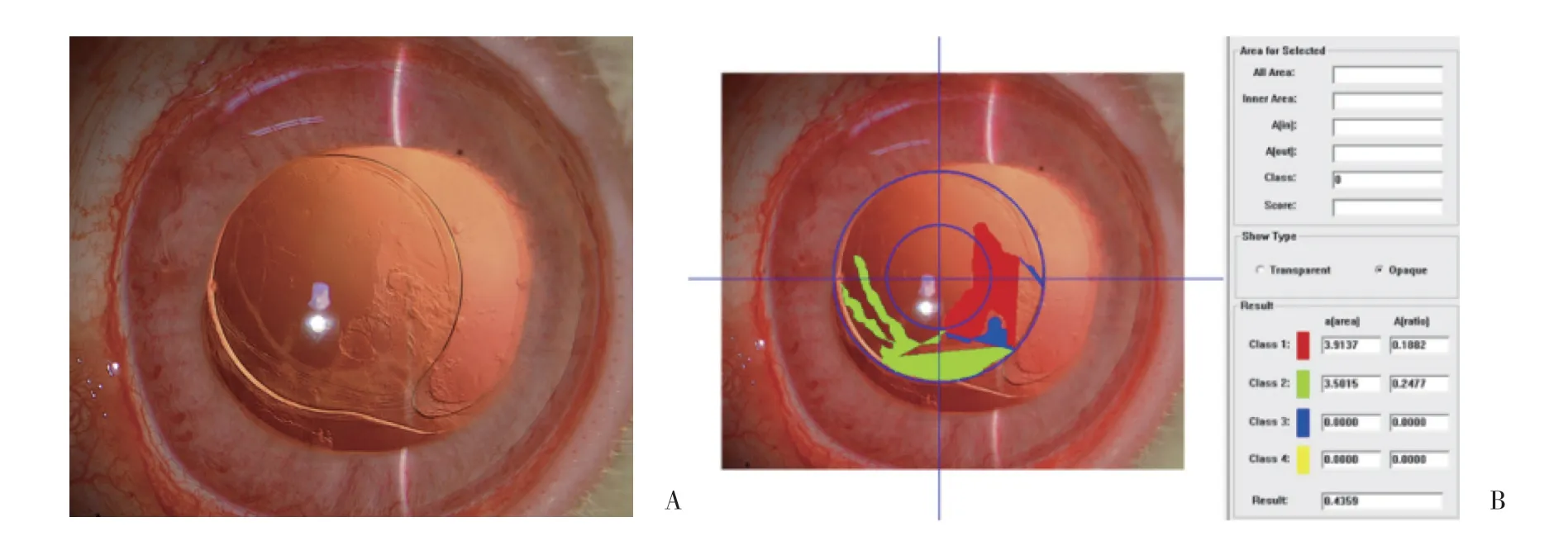
图2 A组术后28 d裂隙灯检查晶状体后囊膜图像(A)及对应PCO-CAAS图像定量分析系统后囊膜混浊评分(B)×16Fig.2 Posterior capsular image(A)observed by slit lamp inspection and corresponding posterior capsular opacity score measured by PCO-CAAS(B)in group A at 28 days after surgery ×16

图3 B组术后28 d裂隙灯检查晶状体后囊膜图像(A)及对应PCO-CAAS图像定量分析系统后囊膜混浊评分(B)×16Fig.3 Posterior capsular image(A)observed by slit lamp inspection and corresponding posterior capsular opacity score measured by PCO-CAAS(B)in group B at 28 days after surgery ×16
表2 术后各时间点平均后囊膜混浊评分()Tab.2 The mean posterior capsular opacity score at each time piont after surgery()

表2 术后各时间点平均后囊膜混浊评分()Tab.2 The mean posterior capsular opacity score at each time piont after surgery()
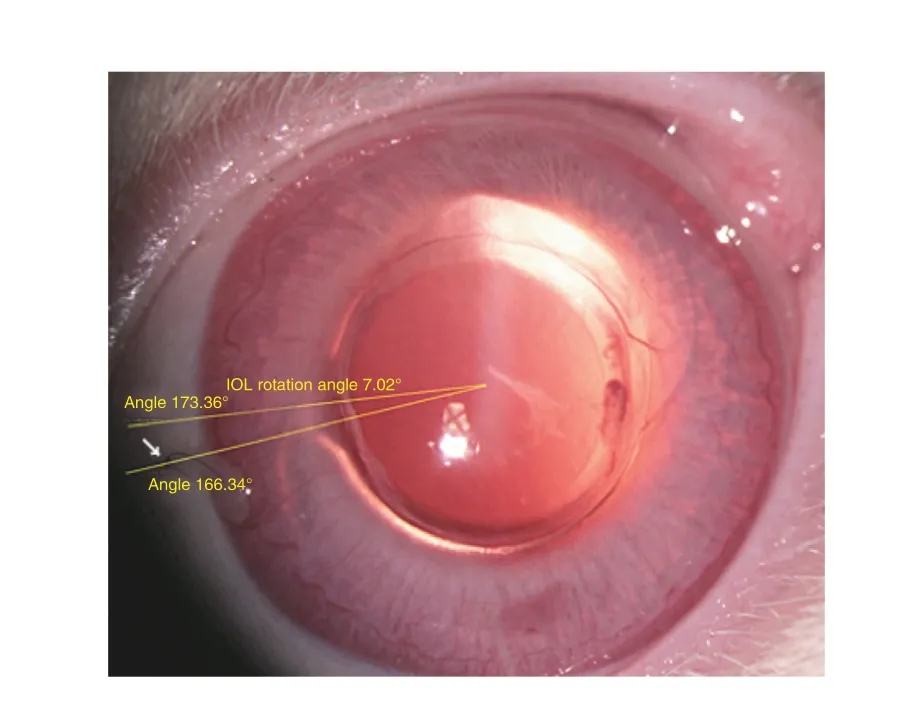
图4 B组术后14 d裂隙灯检查浅层巩膜缝线进针点(白色箭头所指)及IOL旋转角度 ×16Fig.4 Superficial sclera suture into the needle point(white arrow point)observed by slit lamp inspection and IOL rotation angle in group B at 28 days after surgery ×16
2.4 组织病理学检查
术后28 d兔眼石蜡切片HE染色结果如图5所示,A组晶状体后囊膜表面仅见散在分布的单个或簇状晶状体上皮细胞,细胞外基质沉积不明显;B组后囊膜表面可见排列密集的单层或双层晶状体上皮细胞,细胞外基质沉积明显,后囊膜明显增厚。
3 讨论
IOL作为眼内植入生物材料,其生物相容性与术后视觉质量密切相关。IOL与眼内组织的相互作用发生在IOL表面,因此,IOL表面的理化特性直接影响其生物相容性。表面处理技术是在保持IOL本身光学、力学特征不变的基础上,通过物理或化学方法改变IOL表面理化特性,以调节材料与眼内环境间的作用,达到提高生物相容性的目的[5-6]。此外,IOL设计方面的改进也对提高生物相容性起着至关重要的作用[7-8]。
表3 术后各时间点IOL平均旋转角度( ,°)Tab.3 The mean IOL rotation angle at each time piont after surgery(,°)

表3 术后各时间点IOL平均旋转角度( ,°)Tab.3 The mean IOL rotation angle at each time piont after surgery(,°)
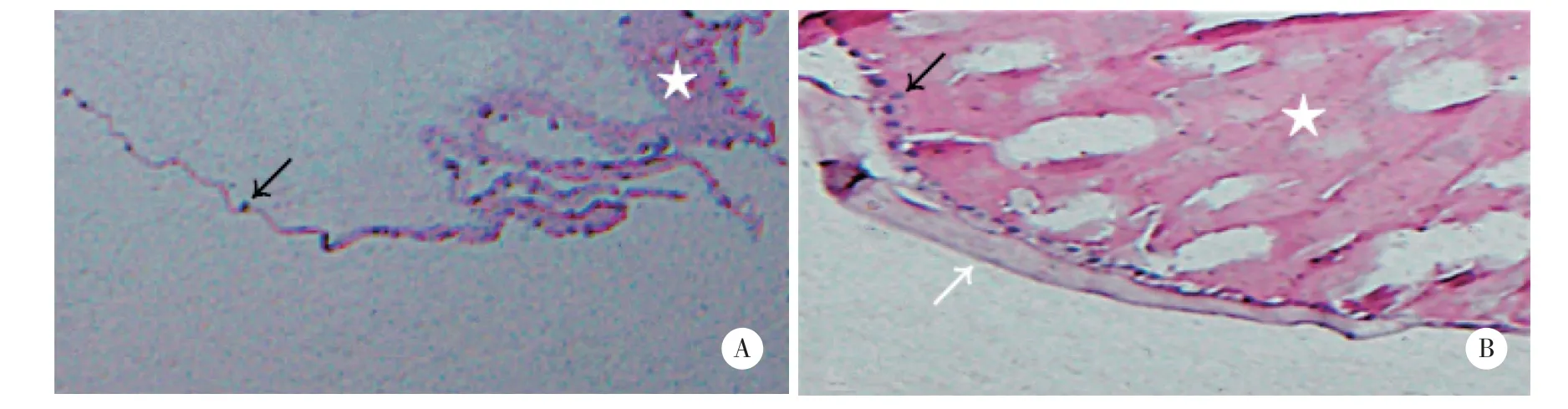
图5 HE染色检查结果 ×100Fig.5 The hematocellin-eosin staining results ×100
葡萄膜生物相容性是指IOL与虹膜、睫状体和前部脉络膜相互作用的异物反应,常用前房闪辉严重程度作为评价指标[1]。本研究中,A组为疏水性丙烯酸酯IOL,前表面未经处理,因其疏水而在术后早期更易黏附蛋白、炎症细胞及代谢产物[9-10];B组在疏水性材料的基础上,表面附加了具有亲水特性的聚乙二醇[11],能够降低IOL表面黏附性,排斥细胞、蛋白质等大分子物质的吸附,因此,植入后前房闪辉程度较低,炎症反应较轻,葡萄膜生物相容性较好。2组均在术后7 d前房闪辉最为明显,至术后28 d基本消失,表明随着血-房水屏障功能的修复与重建,因手术及异物引起的前房炎症反应也逐渐消退[12]。然而对于术前已有血-房水屏障受损的患者(如患者葡萄膜炎、假性剥脱综合征、糖尿病等),更倾向于选择植入具有良好葡萄膜生物相容性的IOL。
囊膜生物相容性是指残留于晶状体囊膜的晶状体上皮细胞对IOL的创面愈合反应,常用后囊膜混浊程度作为评价指标[1]。本研究中,A组IOL后表面经紫外线/臭氧处理,增加了其黏附性[13],与后囊膜贴合紧密,可使已居于中间的晶状体上皮细胞因缺少营养和机械性压迫而死亡,亦阻碍了晶状体上皮细胞从赤道部向后囊膜中央区迁移,故后囊膜混浊出现时间晚、程度轻,囊膜生物相容性较好。B组后囊膜混浊出现时间早,程度重,与LEE等[14]的研究结果一致。XU等[15]发现固定于IOL表面的亲水性聚乙二醇对晶状体上皮细胞的黏附作用小,可有效预防后发性白内障的发生,与本研究结果相反。LIN等[16]的体外细胞黏附实验结果显示,聚乙二醇处理的IOL不易黏附细胞、蛋白质等,考虑是由于聚乙二醇分子长链有一定的排斥体积,能够将蛋白质、细胞等生物大分子物质推出其排斥体积之外,远离材料表面。因此,聚乙二醇在排斥晶状体上皮细胞黏附的同时,也排斥蛋白质的黏附,导致IOL后表面与以胶原蛋白为主要组成成分的晶状体后囊膜之间留有间隙,易于形成晶状体上皮细胞迁移通道,使晶状体上皮细胞得以沿后囊膜表面增殖并迁移,发展为后囊膜混浊。本研究中,术后28 d常规HE染色也从组织病理学角度证实了这一结果。后囊膜混浊的发生是多因素综合作用的病理生理过程,生物组织与材料相互影响时程较长,影响因素较多,由晶状体上皮细胞合成的胶原蛋白、房水中的炎性细胞因子及虹膜睫状体中的色素上皮细胞等共同参与,现有技术手段还不能完全阻止其发生、发展,还需要进一步长期的研究,以寻找安全有效的方法预防后囊膜混浊。
IOL在晶状体囊袋内发生旋转对矫正白内障患者角膜散光的复合曲面IOL影响较大,眼科医师常用IOL旋转角度作为其在囊袋内旋转稳定性的观察指标[17]。本研究结果表明,A组IOL囊袋内旋转稳定性更优越,磨砂化处理后的IOL袢表面粗糙,与囊膜接触摩擦力增大,咬合紧密,有更大的力量抵抗IOL在囊袋内的旋转。B组IOL旋转主要发生在术后早期后囊膜尚无明显混浊机化时,其光滑的袢表面对IOL旋转抵抗力较弱,加之疏水性IOL后表面经过聚乙二醇表面处理后,在一定程度上抵消了IOL材料本身对囊膜的黏附力,使得旋转角度增加;术后14 d、28 d时后囊膜混浊程度逐渐加重,增殖机化的纤维膜填充了囊膜与IOL的间隙,IOL活动空间被压制,因此反而增加了IOL在囊袋内的旋转稳定性。关于兔眼IOL旋转角度如何定位和测量的方法目前少见报道,本研究采用浅层巩膜缝线进针点作为术中IOL袢标记点,直至术后28 d所有兔眼浅层巩膜缝线均未见脱落。
IOL的生物相容性与患者术后视觉质量密切相关。随着制造工艺的进步,IOL不断推陈出新,分析和评价其生物相容性有助于为手术医师选择IOL提供参考依据。综合考虑不同患者的眼部状况,个性化植入适合的IOL,以获得更好的视觉质量,达到理想的手术预期。

