细粒棘球绦虫水通道蛋白9的多肽特征及免疫定位研究
谭青青,李 锴,张 静,2,高 剑,吴宏烨,范俊杰,陆 合,2,叶 彬,2
囊型包虫病(cystic echinococcosis, CE)是人体与某些食草动物(如牛、羊)感染细粒棘球绦虫(Echinococcusgranulosus, Eg)的幼虫—棘球蚴(hydatid)所引起的一种人兽共患寄生虫病[1]。该病呈世界性分布,严重危害人体健康及畜牧业发展[2-3]。原头蚴在不同宿主体内具有双向发育的特征,在终宿主体内发育为成虫,在中间宿主体内逐渐长成不育的棘球蚴[4-5]。棘球蚴主要由囊壁和囊液组成:囊壁分为外层无细胞的角皮层和内层含大量生发细胞的生发层;囊内充满无色透明或呈淡黄色的棘球蚴液[6-7]。水分子进入棘球蚴囊内可通过简单扩散或渗透的方式,但是检测生发细胞胞膜的通透系数发现简单扩散的水分子通过细胞膜的通透系数远小于渗透水的通透系数[8],提示棘球蚴囊壁生发层细胞膜上可能存在某种通道蛋白可以通透水,从而影响棘球蚴囊液的生成,但对此结果并没有进行深入探索研究。
水通道蛋白(Aquaporins, AQPs),又被称为亲水孔蛋白,是主要内在蛋白(major intrinsic protein, MIP)超家族成员[9]。哺乳动物、植物、真菌、病毒、细菌、原生动物、蠕虫中均发现了水通道蛋白的存在[10-11],在不同组织细胞的细胞膜中水通道蛋白除了转运水、甘油或尿素等中性小分子溶质[12-14],还能促使CO2、氨和一些金属盐类如锑酸盐、亚砷酸盐等的渗透[15]。有研究报告表明,AQPs在寄生虫体内发挥重要作用,可参与虫体内营养物质的运输、代谢产物的排出以及渗透压的调节等生理过程,还可参与抗寄生虫药物转运[16]。
水通道蛋白9(AQP9)是水通道蛋白家族的重要成员之一,属于水-甘油通道蛋白[17]。最初在脂肪组织中发现,后来实验证明AQP9能够显著加快细胞膜内水及一些中性溶质(甘油、尿素等)的转运[18]。目前,对AQP9研究主要集中在脑部疾病、肝脏疾病、妊娠及相关疾病、眼部疾病等,在它们的生理病理过程中起着重要作用[19-24]。前期实验中发现在细粒棘球绦虫原头蚴及棘球蚴囊壁中存在AQP9,并且转录表达量较细粒棘球蚴体内其它几个水通道蛋白高[25]。在原头蚴囊化为次生棘球蚴过程中,会伴随有棘球蚴囊液的生成,由此推测细粒棘球绦虫水通道蛋白9 (EgAQP9) 在原头蚴囊化时产生棘球蚴液过程中可能发挥重要作用。但是在本课题组前期研究中,EgAQP9在非洲爪蟾卵母细胞中异源表达失败,提取爪蟾卵母细胞膜也并没有检测到EgAQP9蛋白的表达[26]。由于不同宿主之间的密码子偏好性存在一定差异,失败的原因可能是非洲爪蟾卵母细胞并不是EgAQP9蛋白异源表达的最佳选择。通过密码子偏好性分析发现酵母表达系统可能优于爪蟾卵母细胞表达系统,但更重要的是分析表明细粒棘球蚴AQPs密码子使用偏好性普遍较弱[27],EgAQP9在酵母体内也不一定会成功表达。因此,本研究通过将人工合成多肽与载体蛋白偶联作为免疫原免疫新西兰兔以制备多克隆抗体,并加以验证,初步了解AQP9在原头蚴和棘球蚴细胞及组织内的具体表达位置,为后续研究EgAQP9的生物学功能和棘球蚴囊液生成机制提供分子定位工具。
1 材料与方法
1.1 材 料
1.1.1组织来源和实验动物 感染细粒棘球蚴的羊肝来自新疆某屠宰场;4 周龄的雌性BALB/C小鼠与8 周龄的雄性新西兰兔(SPF级)由重庆医科大学动物实验中心提供。
1.1.2主要试剂 马来酰亚胺活化的钥孔血蓝蛋白(KLH)偶联试剂盒(Sigm,美国),蛋白质Marker(Solarbio,北京),PVDF膜(Bio-Rad,美国),辣根过氧化物酶(HRP)标记的羊抗兔IgG抗体(Proteintech,美国),Cy3羊抗兔IgG二抗(Earthox,美国),荧光染料DAPI(碧云天,上海), SP免疫组化试剂盒(中杉金桥,北京)。
1.2 方 法
1.2.1多肽抗原的设计、合成及鉴定 根据NCBI数据库中搜索到的EgAQP9特异氨基酸序列,使用Immune Epitope Database (IEDB)软件和BCPREDS软件对EgAQP9 B细胞线性抗原表位进行预测,分析蛋白跨膜区应用在线TMHMM Server v.2.0软件。选取其中一段具有高度抗原性的非跨膜区保守序列,交由武汉戴安生物技术有限公司合成,通过HPLC和ESI-MS检测合成多肽的纯度及分子量。
1.2.2偶联多肽及制备免疫原 将纯化后的多肽分出一部分偶联KLH以制备免疫原,将其溶解于无菌的PBS中,然后分别与弗氏完全和不完全佐剂以等体积比例混合,进行充分乳化后作为免疫原,剩下一部分裸肽不做任何处理,用于检测抗体特异性。
1.2.3制备与纯化多肽抗体 选择充分乳化的弗氏完全佐剂作为免疫原,每只兔注射0.5 mg多肽,采用颈背部皮下多点注射的方法免疫健康新西兰兔。第28 d、42 d、49 d需要对新西兰兔加强免疫,以相同的剂量和方法为新西兰兔注射充分乳化的弗氏不完全佐剂。第3次加强免疫后的第7 d经兔耳采血、分离获得血清。提前准备好以裸肽作为包被原包被的96孔板,采用酶联免疫吸附试验(ELISA)检测上述获得的血清抗体效价,采血第2 d进行第4 次加强免疫,注射7 d后再次采血分离血清,若检测血清抗体效价符合要求,采用颈动脉放血的方式取全血,分离的血清于-20 ℃冰箱保存备用。新西兰兔初次免疫前采集的血清作为阴性对照。抗体纯化委托给武汉戴安生物技术有限公司,纯化结果通过SDS-PAGE鉴定。
1.2.4测定多肽抗体效价 将合成的一部分适量裸肽稀释成浓度为2 μg/mL的溶液,包被96孔聚丙烯反应板,加入的裸肽溶液量为100 μL/孔, 4 ℃条件下过夜,结束后用PBS配制的洗涤液充分洗板;每孔加入200 μL 5%的BSA-PBS,在37 ℃ 封闭2 h,结束后用PBS配制的洗涤液充分洗板;PBS缓冲液稀释的抗血清作为一抗,初始稀释比例为1∶1 000,采用倍比稀释方式,直至稀释到1∶256 000, 阴性对照为1∶1 000稀释的免疫前兔血清,每孔加入100 μL,37 ℃孵育2 h,结束后用PBS配制的洗涤液充分洗板;每孔加入100 μL浓度为1∶10 000的二抗,37 ℃孵育1 h,结束后用PBS配制的洗涤液充分洗板。反应板洗净后并在吸水纸上扣干,加入显色剂TMB显色15 min,每孔加入终止剂 50 μL 终止显色,混匀后酶标仪上读取450 nm处波长的OD值。
1.2.5Western blot检测EgAQP9 取适量细粒棘球蚴加入RIPA裂解液中裂解细粒棘球蚴,冰上超声震碎15 min,冷冻高速离心机离心后取一定量上清进行 Western blot 实验。纯化后的兔抗血清和免疫前兔血清分别作为一抗过夜孵育,结束后用PBST漂洗膜3次,再加二抗孵育2 h,结束后用PBST漂洗膜3次,洗膜完成后应用ECL显色,在凝胶成像分析系统上读取Western blot 结果并保存图像。
1.2.6免疫荧光实验分析EgAQP9的亚细胞定位 向生长良好的棘球蚴生发细胞中加入胰蛋白酶消化后终止,PBS缓冲液充分洗涤,把分散的棘球蚴生发细胞加入24孔板中,放爬片,待细胞贴壁后,用PBS清洗4 次,每次5 min;室温固定细胞(4%多聚甲醛)30 min,PBS清洗3 次,每次3 min; 室温下细胞透化(0.25% 的Triton X-100)10 min, PBS清洗3次,每次3 min;用免疫前兔血清在室温条件下封闭30 min;甩走封闭液,暂不清洗,分别直接加入1∶1 000稀释的兔多克隆抗体或兔免疫前血清作为一抗,室温孵育1 h;接着加入用1∶1 000稀释的二抗,室温条件下避光孵育1.5 h;最后加入1∶1 000稀释的荧光染料DAPI对玻片核染10 min,PBS清洗1次,封片完成后在荧光显微镜下观察荧光。
1.2.7免疫组化实验检测EgAQP9的组织定位 石蜡切片分别浸入二甲苯I、II缸中,每次10 min;稍微沥干后,浸入由高到低浓度的乙醇中进行梯度酒精水化,去离子水冲洗切片1 min后,浸入PBS缓冲液中。将pH6.0的枸橼酸钠缓冲液(0.01 mol/L)加热至95 ℃,小心放入组织切片加热10 min进行抗原修复,冷却至室温后取出切片,PBS缓冲液冲洗切片3 次,每次3 min。加入内源性过氧化物酶阻断剂阻断内源性过氧化物酶活性,室温孵育10 min,PBS缓冲液冲洗切片3 次,每次3 min。加入适量的正常山羊血清,封闭10~15 min,倒去血清,暂不冲洗;依次加入适量的一抗、二抗、辣根酶标记链霉卵白素工作液和新鲜配制的DAB显色液在一定条件下孵育,前3 次孵育结束后用PBS缓冲液充分清洗,最后一次孵育结束后自来水冲洗终止显色反应,苏木素染色液复染20 s,自来水冲洗后用1%的盐酸酒精分化,自来水冲洗返蓝。脱水、透明后在通风橱中风干切片,中性树胶封片晾干后阅片。
2 结 果
2.1B细胞线性抗原表位预测结果 将EgAQP9的氨基酸序列输入在线IEDB软件中,阈值点选为 -0.302时,显示有13个B细胞线性抗原表位,其中抗原表位评分最高的一段氨基酸序列位于第284~313位氨基酸。BCPREDS软件中通过使用AAP predictions方法获得的7个B细胞线性抗原表位,评分最高的一段氨基酸序列位于第283~302位氨基酸;使用BCPreds predictions方法获得的5个B细胞线性抗原表位,评分较高的一段氨基酸序列同样是位于第283~302位氨基酸。结合这两种软件对EgAQP9的抗原表位评分结果,分析显示EgAQP9中形成多肽抗原评分较高的一段氨基酸序列是位于第283~302位的氨基酸(图1)。
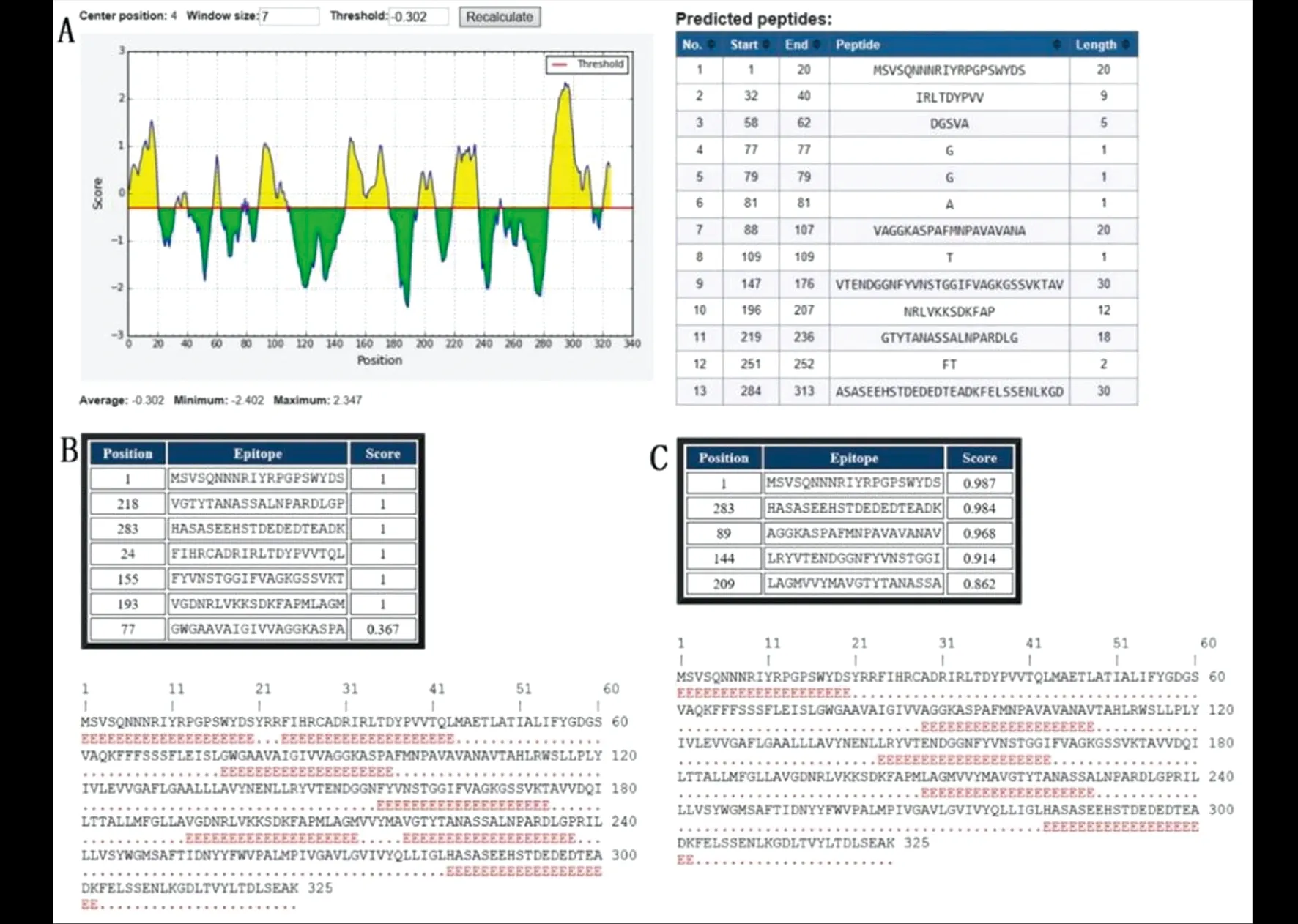
A:IEDB软件;B:AAP predictions(BCPREDS软件);C:BCPreds predictions(BCPREDS软件)图1 EgAQP9的B细胞线性抗原表位预测结果Fig.1 Line B cell prediction of EgAQP9
2.2多肽抗原的特征 EgAQP9跨膜区域结构通过在线TMHMM Server v.2.0软件预测分析显示有6 个跨膜区(图2)。根据EgAQP9的抗原表位及跨膜区预测结果,多肽氨基酸序列设计为:ASEEHSTDEDEDTEA,交由武汉戴安生物技术有限公司合成。
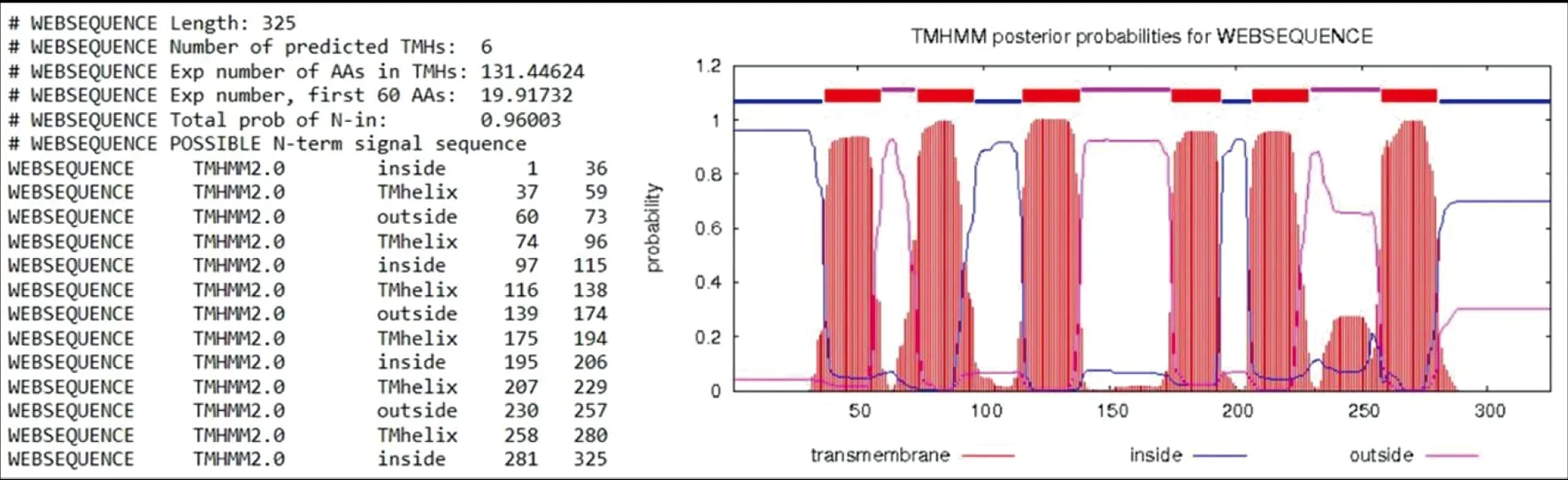
图2 TMHMM 软件分析EgAQP9的跨膜区结构Fig.2 Transmembrane structure of EgAQP9 on the basis of TMHMM software
HPLC检测合成多肽的纯度(图3),总共出现3 个成分峰,位于中间成分峰的浓度(96.64%)显著高于余下两个成分峰的总浓度(3.36%)。经测定该多肽的纯度为96.64%,达到了免疫纯度要求(表1)。得到的主要成分峰经电喷雾质谱技术分析,合成肽的质荷比(m/z)[M+2H]2+离子峰所计算得到的实际分子量与理论分子量(1 766.69)相吻合(图4)。
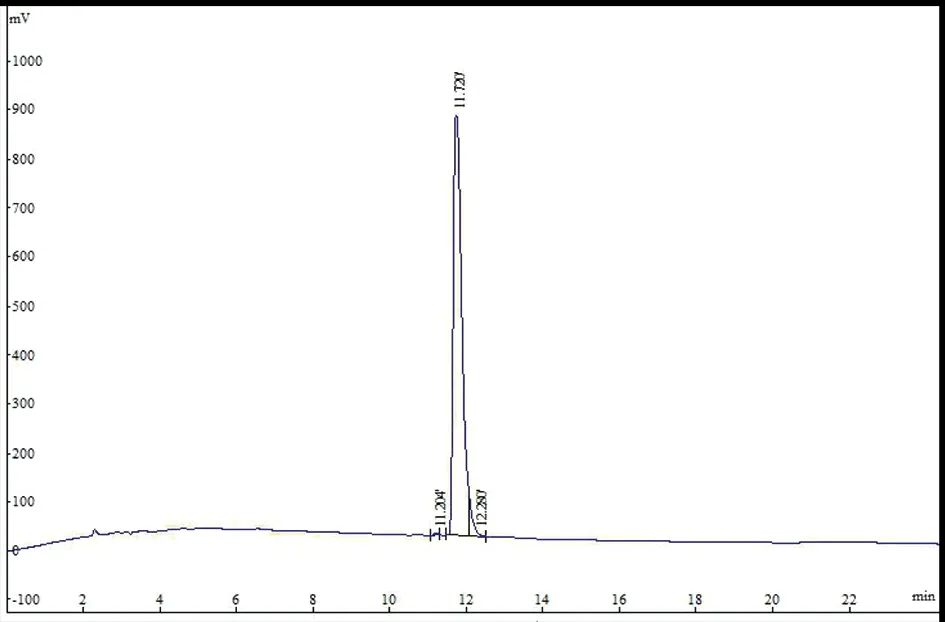
图3 HPLC检测多肽结果Fig.3 HPLC results for the peptide
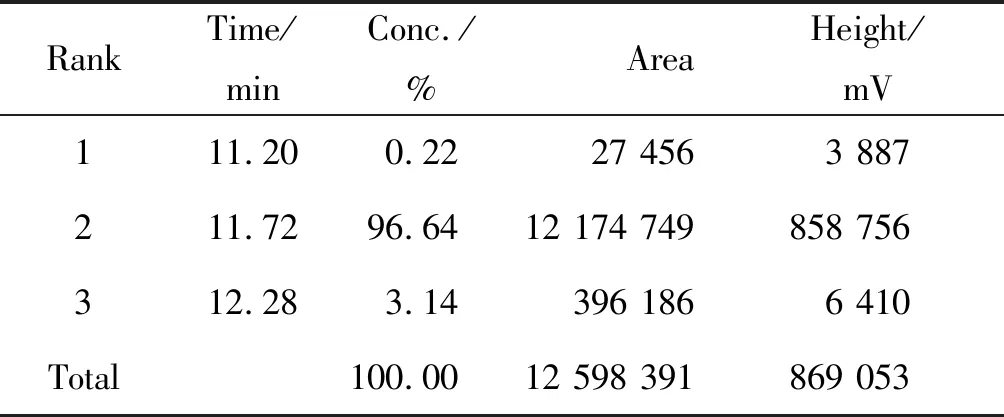
表1 HPLC 测定多肽纯度Tab.1 Determination of peptide purity with HPLC

图4 ESI-MS分析多肽结果Fig.4 ESI-MS results for the peptide
2.3多肽抗体的纯化 SDS-PAGE检测纯化的EgAQP9多肽抗体结果显示位于25 kDa与55 kDa处的特异性条带分别与抗体IgG轻链和IgG重链的分子量一致(图5),表明纯化的EgAQP9多肽抗体符合要求,效果较好,可用于后续实验。
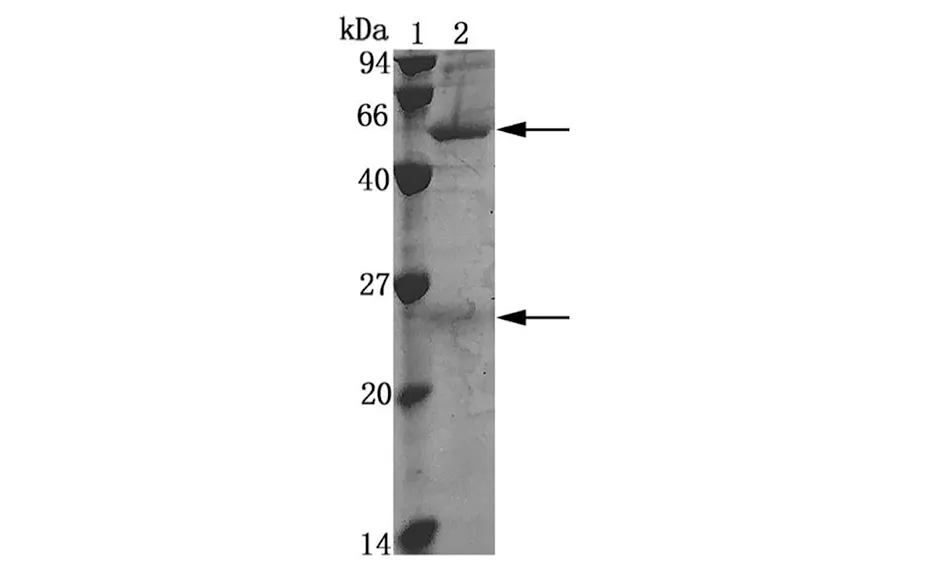
1:蛋白marker; 2:纯化后的多肽抗体图5 纯化后的EgAQP9多肽抗体结果Fig.5 Results of the purified EgAQP9 polypeptide antibody
2.4多肽抗体效价检测及其对 EgAQP9的识别 间接ELISA检测纯化后抗体效价高达1∶256 000(图6),阳性判断的依据是抗血清A450值/阴性血清A450值>2.1。将纯化合格的多肽抗体用于Western blot检测细粒棘球绦虫体内的EgAQP9,在约36 kDa处显示1条明显的条带,与EgAQP9理论分子量大小吻合(图7)。
2.5免疫荧光实验观察 EgAQP9的亚细胞定位 以兔多克隆抗体或兔免疫前血清为一抗,Cy3羊抗兔IgG为二抗,应用免疫荧光技术对细粒棘球蚴生发细胞中的AQP9进行细胞定位。通过荧光显微镜观察,可见生发细胞的细胞质及细胞膜中有明显红色荧光(图8),表明EgAQP9主要分布于生发细胞的细胞质及细胞膜中。
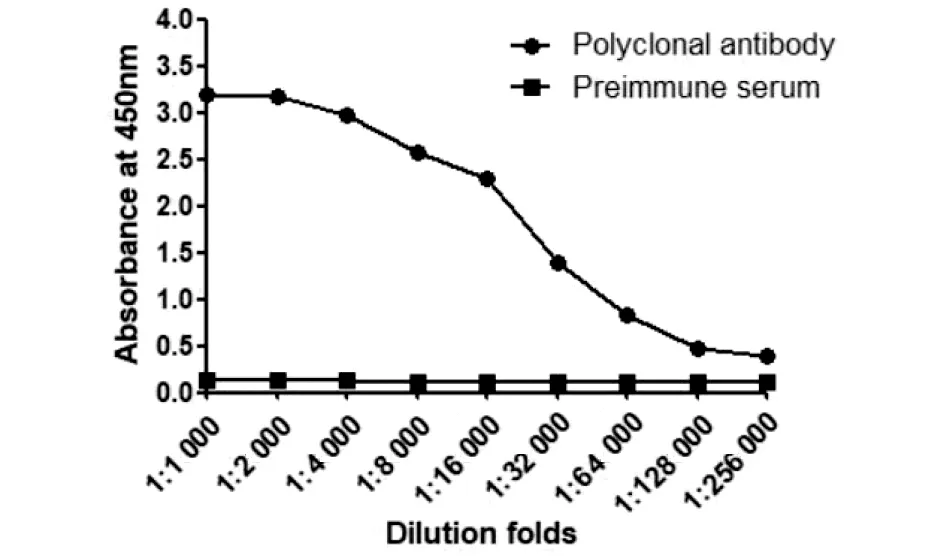
因误差线太小而未在图中显示出来图6 ELISA检测EgAQP9多肽抗体效价 Fig.6 Antibody titer of EgAQP9 polypeptide by ELISA
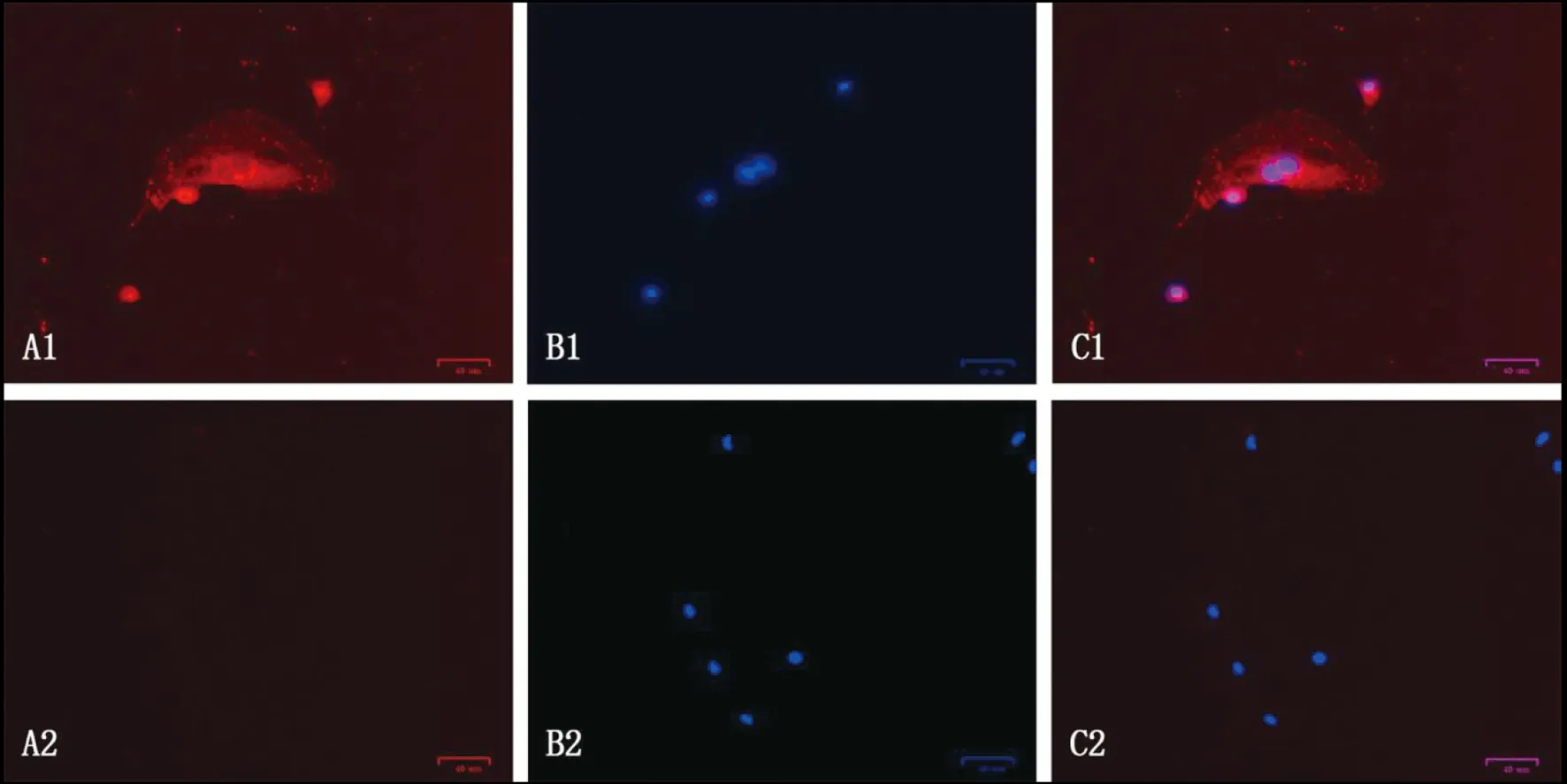
1:EgAQP9多肽抗体孵育的细胞;2:与兔免疫前血清一起孵育的细胞;A:抗体的免疫荧光染色;B:DAPI染色的细胞核;C:A与B的叠加图8 EgAQP9在棘球蚴生发细胞中的亚细胞定位Fig.8 Subcellular localization of EgAQP9 in germinal cells of hydatid cysts
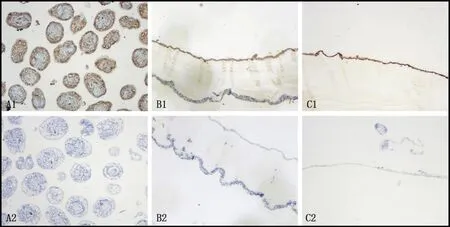
1:EgAQP9多肽抗体;2:免疫前血清;A: 细粒棘球绦虫原头蚴;B:鼠源继发棘球蚴囊泡;C:羊源细粒棘球蚴囊泡图9 EgAQP9分别在原头蚴、鼠源继发棘球蚴囊泡及羊源棘球蚴囊泡中的组织定位(100×) Fig.9 Histological localization of EgAQP9 in Echinococcus granulosus hydatid cyst tissues (100×)
2.6免疫组织化学实验观察EgAQP9的组织定位 EgAQP9在原头蚴、鼠源继发棘球蚴囊泡及羊源棘球蚴囊泡中组织定位的检测采用免疫组织化学方法,将制备好的组织切片放在光学显微镜下观察并采集图片,在原头蚴的虫体表面可见AQP9;在鼠源及羊源继发棘球蚴囊泡的生发层均可见AQP9(图9)。
3 讨 论
AQPs广泛存在于各种生物体内,尤其是与水代谢密切相关的组织器官中,介导细胞膜之间跨膜物质的转运[28]。目前,在哺乳动物体内已发现13 种AQPs,其中AQP3、7、9、10属于水-甘油通道蛋白,因为它们不仅能转运水,还能通透甘油、尿素等小分子溶质,因此在维持机体液体转运和代谢平衡中起重要作用[29-30]。经研究表明,AQP9表达水平的改变与妊娠、肝脏疾病、眼部疾病及脑损伤等都密切相关,在病理情况下,都会有相应的表达增强[19-24]。
目前,寄生虫体内生物膜上的AQPs已有定位研究[31-33],但在细粒棘球绦虫体内的定位研究却处于空白状态。前期实验中,本课题组在原头蚴及继发棘球蚴囊壁中成功克隆出AQP9,并且qPCR结果显示在原头蚴中转录表达量最高[25],在原头蚴囊化形成次生棘球蚴过程中,囊内的液体也在不断增加。因此有理由推测EgAQP9可能在原头蚴囊化形成棘球蚴囊泡时,对囊液的生成发挥关键作用。
本试验所研究的 EgAQP9基因是细粒棘球绦虫体内的一个水-甘油通道蛋白,目前对其定位与生物学功能研究暂无报道。为研究EgAQP9的功能,抗体制备必不可少。本研究通过相关在线软件预测并加以分析了 EgAQP9的B细胞线性抗原表位与结构特征,选择具有高抗原性、构象稳定的B细胞线性表位且三维结构保守的非跨膜片段。在本研究之前,通过B细胞线性抗原表位预测制备的多抗已成功用于弓形虫、蓝氏贾第鞭毛虫等基因的定位研究,钟亮尹等[34]应用人工合成的弓形虫CDPK5基因多肽免疫新西兰兔,成功制备多肽抗体,定位研究发现该蛋白位于细胞质中;张佳凤等[33]成功制备了抗弓形虫AQPs的特异性多肽抗体,Western blot结果显示制备的多肽能识别弓形虫体内的AQPs,免疫荧光定位研究显示AQPs定位于弓形虫胞质中;冯宪敏等[35]合成了蓝氏贾第鞭毛虫磷酸烯醇式丙酮酸双激酶(PPDK)多肽抗体,免疫荧光定位显示位于虫体滋养体细胞胞浆内。
制备多克隆抗体免疫原有两种常用方法:一种是通过基因工程方法来获取目的蛋白,将其纯化并检测效价,符合要求后作为抗原来免疫动物,但是过程繁琐;另一种是把容易获得的天然蛋白当作抗原来免疫动物,但是其提取纯化的步骤相当复杂[36]。本研究采用人工合成多肽制备多抗,同上述两种方法相比有以下优点:节约成本,操作简单,应用范围广,还可避免杂菌污染,最关键的是可获得特异性较强的抗原且所用时间较短,为后续抗体的成功制备提供了一定保障。然而人工合成多肽时,通常选择的B细胞抗原表位多肽分子量较小,致使其免疫原性较弱,导致机体有时难以引起抗原抗体免疫反应,利用载体蛋白偶联多肽,可以显著增强机体内的抗原抗体反应[37]。HPLC分析结果显示3个成分峰中的主要成分峰的含量为96.64%,表明合成的多肽纯度较高。通过质谱技术分析合成的EgAQP9多肽,结果显示主成分峰所计算得到的实际分子量与理论分子量(1 766.69)基本一致,说明多肽序列的准确性从分子量角度得到了验证,可以用作目的免疫原,用于后续实验中多肽抗体的制备。注射免疫新西兰兔,测得兔血清中多肽抗体效价高达1∶256 000,表明制备的多肽抗体敏感性较好。Western blot可检测到细粒棘球绦虫体内的AQP9,特异性条带出现在大约36 kDa处,通过在线软件预测的EgAQP9理论分子量为35.17 kDa,两者基本相符。免疫荧光试验证实EgAQP9主要分布在原头蚴及棘球蚴的细胞质和细胞膜中,细胞核中未见,此结果与生物信息学在线软件预测结果一致[38]。免疫组织化学方法证实在原头蚴中该蛋白主要分布于虫体表面,在鼠源继发棘球蚴囊泡及羊源棘球蚴囊泡中该蛋白主要分布于囊泡生发层,为下一步研究细粒棘球绦虫原头蚴成囊过程中EgAQP9与囊液生成关系提供了依据。
总之,本研究成功制备了兔抗EgAQP9多克隆抗体,利用该抗体进行了棘球蚴体内AQP9定位观察,结果显示该抗体能够与其抗原特异性结合。研究结果提示该抗体还可应用于针对该分子的免疫印迹、免疫荧光及免疫组化实验,为深入研究EgAQP9的生物学功能奠定了基础。
利益冲突:无

