1株重组H6N2禽流感病毒全基因组特征分析
曹 蓝,夏 丹,刘艳慧,曾 庆,陈艺韵,陆剑云,李魁彪,张周斌,狄 飚
禽流感病毒属于正粘病毒科流感病毒属A型流感病毒,根据病毒表面抗原血凝素(HA)和神经氨酸酶(NA)的不同,分为不同亚型:H1~H16;N1~N9[1],2011—2016年我国家禽禽流感病毒监测显示,近年我国H6亚型禽流感病毒的流行呈上升趋势[2],同时该亚型也是我国南方地区家禽常见的禽流感病毒亚型之一[3]。研究显示,我国早期H6亚型禽流感病毒主要为H6N1和H6N2[4],近期主要流行亚型为H6N2和H6N6[5]。前期监测发现,近年来广州地区H6亚型禽流感病毒虽为禽源本地化病毒,但HA基因已出现较大变异,同源性在81.0%~99.1%之间[6],其中大部分毒株分布在ST2853-like分支,仅有1株病毒分布在ST339-like分支。因此,本研究选取ST339-like分支的A/EN/Guangzhou/13565/2018(H6N2)病毒进行全基因组序列分析,对全面掌握广州地区H6亚型禽流感病毒的流行和变异情况有着重要的公共卫生意义。
1 材料与方法
1.1毒株来源 A/EN/Guanghzou/13565/2018(H6N2)毒株于2018年分离自广州活禽市场外环境,通过鸡胚接种进行病毒的分离和纯化,通过荧光定量RT-PCR方法对禽流感病毒各亚型进行核酸检测,鉴定为H6N2亚型禽流感病毒,将鸡胚尿囊液分装于-80 ℃冰箱长期保存。
1.2基因测序 参考NCBI数据库中H6N2亚型禽流感病毒HA、NA、PB2、PB1、PA、NP、M、NS全基因组序列,应用Oligo 6软件设计各基因片段全长扩增引物(表1),引物由广州天一辉远生物公司合成。通过反转录和RT-PCR扩增,经毛细管电泳对基因片段大小进行鉴定后,将阳性扩增产物送至广州天一辉远生物公司,利用ABI 3730测序仪对毒株基因组进行一代(毛细管)测序。
1.3遗传进化分析 应用DNA Star7.1软件拼接各基因序列。应用NCBI数据库进行各基因BLAST比对,分析基因(氨基酸)最大相似性毒株。采用MEGA 4.0软件,以基因ORF为基本单元,参照参考文献[7]选取禽流感代表株作为参比序列,绘制HA、NA、PB2、PB1、PA、NP、M、NS各基因片段基因系统进化树。绘制方法为Neighbor-joining法(参数设置为1000 replications)及Maximum composite likelihood model比对核苷酸序列。

表1 H6N2禽流感病毒各基因片段扩增引物Tab.1 Amplification primers for gene fragments of the avian influenza A (H6N2) virus
1.4分子特征分析 应用BioEdit软件对HA、NA、PB2、PB1、PA、NP、M1、M2、NS1蛋白重要氨基酸位点进行突变分析。
2 结 果
2.1同源性比较 经BLAST比对,A/EN/Guangzhou/13565/2018(H6N2)毒株各基因片段核苷酸最大相似度毒株均为国内H6N2禽流感病毒,最大相似性在96.85%~98.22%之间。氨基酸最大相似性毒株大部分为华南地区的H6N2、H6N6毒株,其中PB2蛋白与A/duck/Guangdong/W12/2011(H3N2)同源性最高,各蛋白氨基酸最大相似性在96.30%~99.30%之间,见表2。
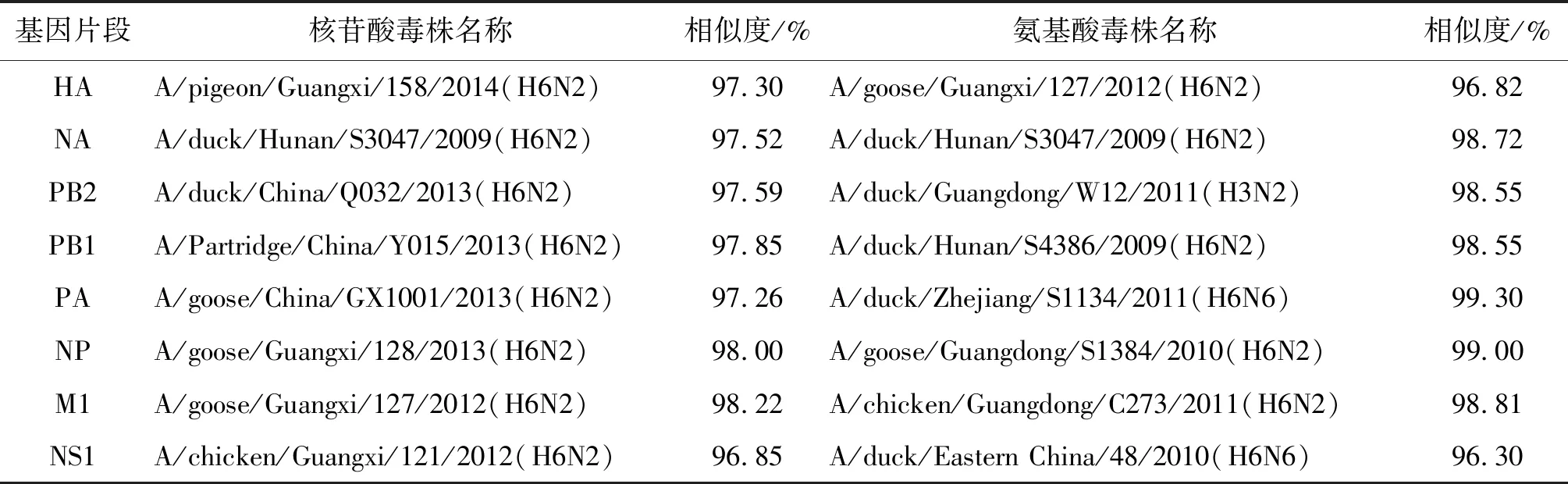
表2 A/EN/Guangzhou/13565/2018(H6N2)各基因核苷酸和氨基酸最大相似性毒株列表Tab.2 List of strains with the greatest nucleotide and amino acid similarity for each gene of A/EN/Guangzhou/13565/2018 (H6N2)
2.2遗传进化特征 H6N2禽流感病毒各基因片段均属于欧亚谱系(Eurasian Lineage),HA基因与A/duck/Shantou/339/2000(H6N2)亲缘关系较近,归属于ST339-like分支;NA基因与A/duck/Guangdong/S1328/2010(H6N2)亲缘关系较近,在HxN2不同亚型基因中归属于H6N2分支;PB2基因与A/duck/Guangxi/2281/2007(H6N6)亲缘关系较近,归属于ST339-like分支;PB1基因与A/duck/Shantou/2962/2007(H6N6)亲缘关系较近,归属于ST339-like分支;PA基因与A/duck/Shantou/7429/2006(H6N6)亲缘关系较近,归属于ST339-like分支;NP基因与A/duck/Shantou/2962/2007(H6N6)亲缘关系较近,归属于HN573-like分支;M基因与A/duck/Shantou/339/2000(H6N2)亲缘关系较近,归属于ST339-like分支;NS1基因与A/duck/Guangxi/3574/2006(H6N2)亲缘关系较近,归属于ST339-like分支,见图1~8。
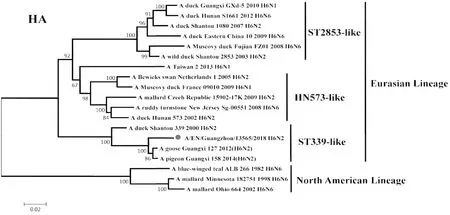
图1 A/EN/Guangzhou/13565/2018(H6N2)HA基因遗传进化树Fig.1 Genetic evolution analysis of the HA gene of A/EN/Guangzhou/13565/2018 (H6N2)
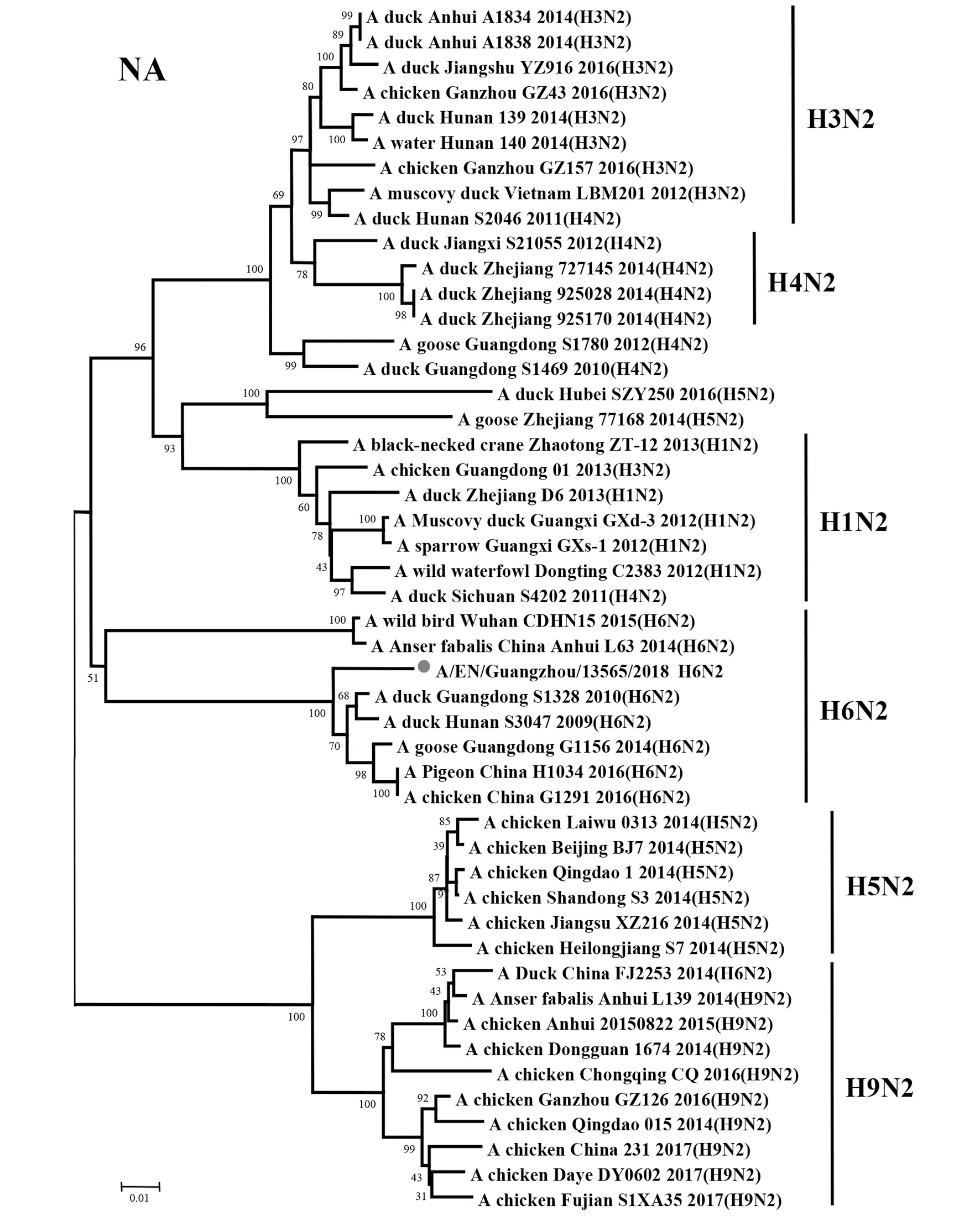
图2 A/EN/Guangzhou/13565/2018(H6N2)NA基因遗传进化树Fig.2 Genetic evolution analysis of the NA gene of A/EN/Guangzhou/13565/2018 (H6N2)
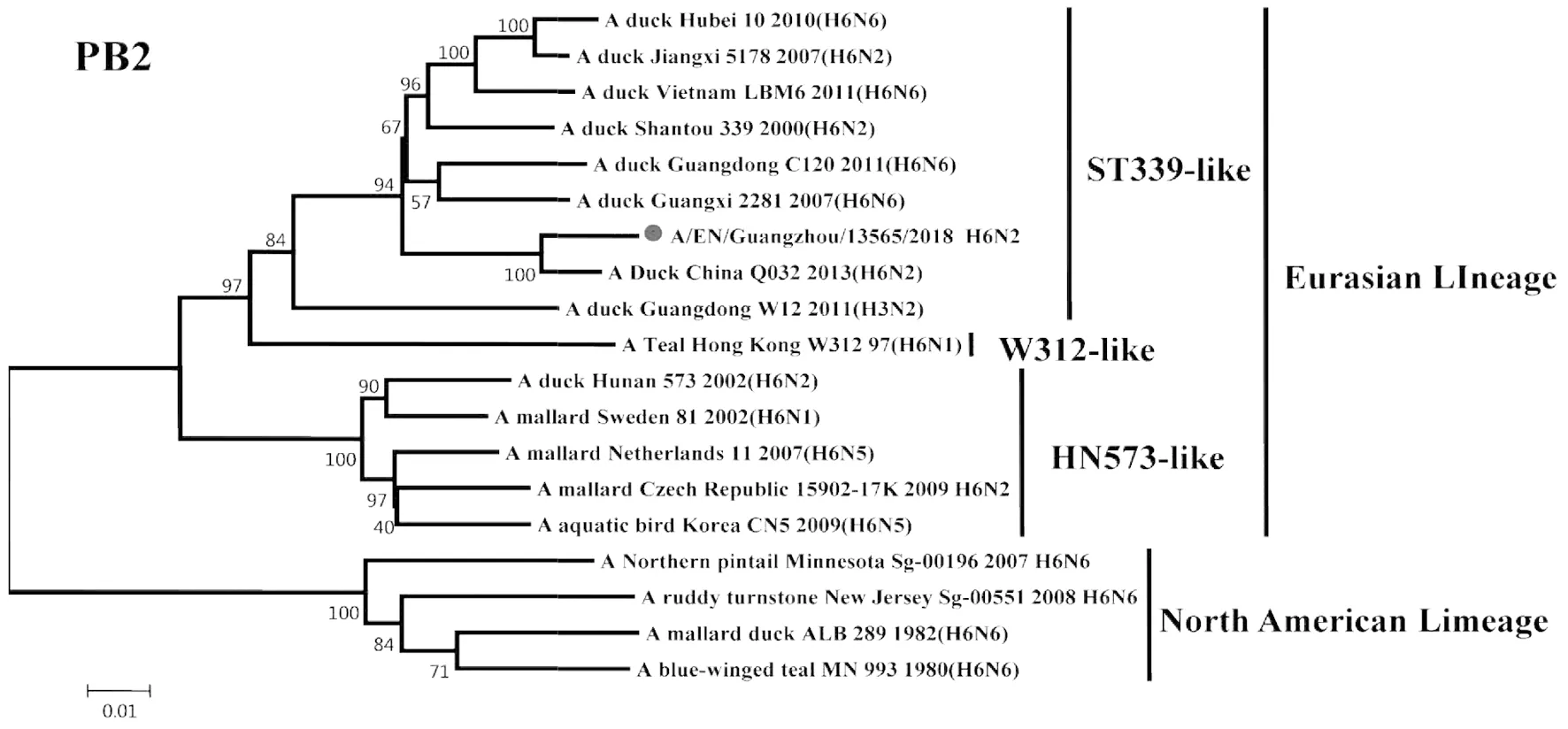
图3 A/EN/Guangzhou/13565/2018(H6N2)PB2基因遗传进化树Fig.3 Genetic evolution analysis of the PB2 gene of A/EN/Guangzhou/13565/2018 (H6N2)

图4 A/EN/Guangzhou/13565/2018(H6N2)PB1基因遗传进化树Fig.4 Genetic evolution analysis of the PB1 gene of A/EN/Guangzhou/13565/2018 (H6N2)
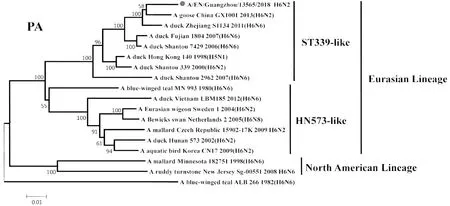
图5 A/EN/Guangzhou/13565/2018(H6N2)PA基因遗传进化树Fig.5 Genetic evolution analysis of the PA gene of A/EN/Guangzhou/13565/2018 (H6N2)
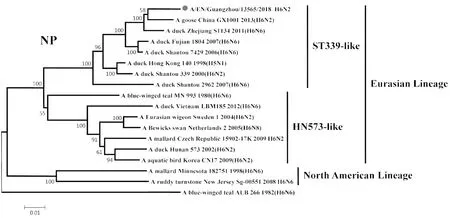
图6 A/EN/Guangzhou/13565/2018(H6N2)NP基因遗传进化树Fig.6 Genetic evolution analysis of the NP gene of A/EN/Guangzhou/13565/2018 (H6N2)
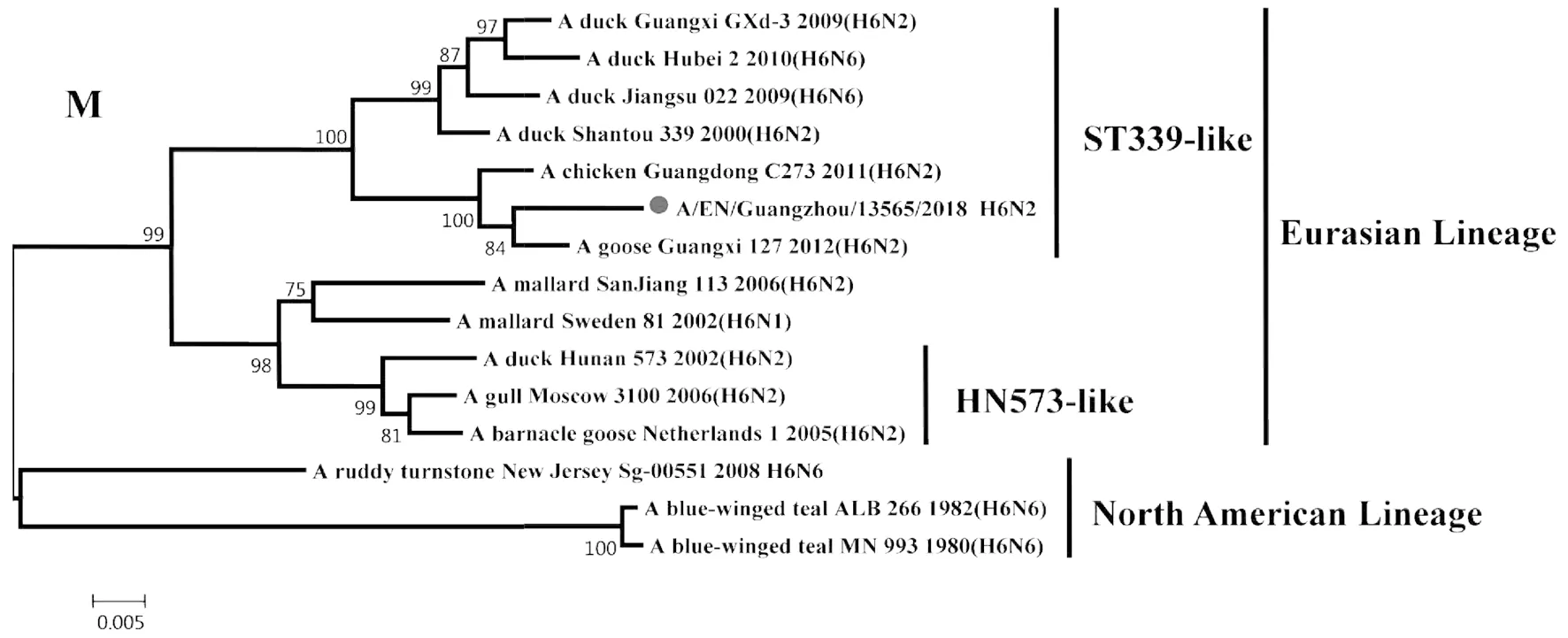
图7 A/EN/Guangzhou/13565/2018(H6N2)M基因遗传进化树Fig.7 Genetic evolution analysis of the M gene of A/EN/Guangzhou/13565/2018 (H6N2)
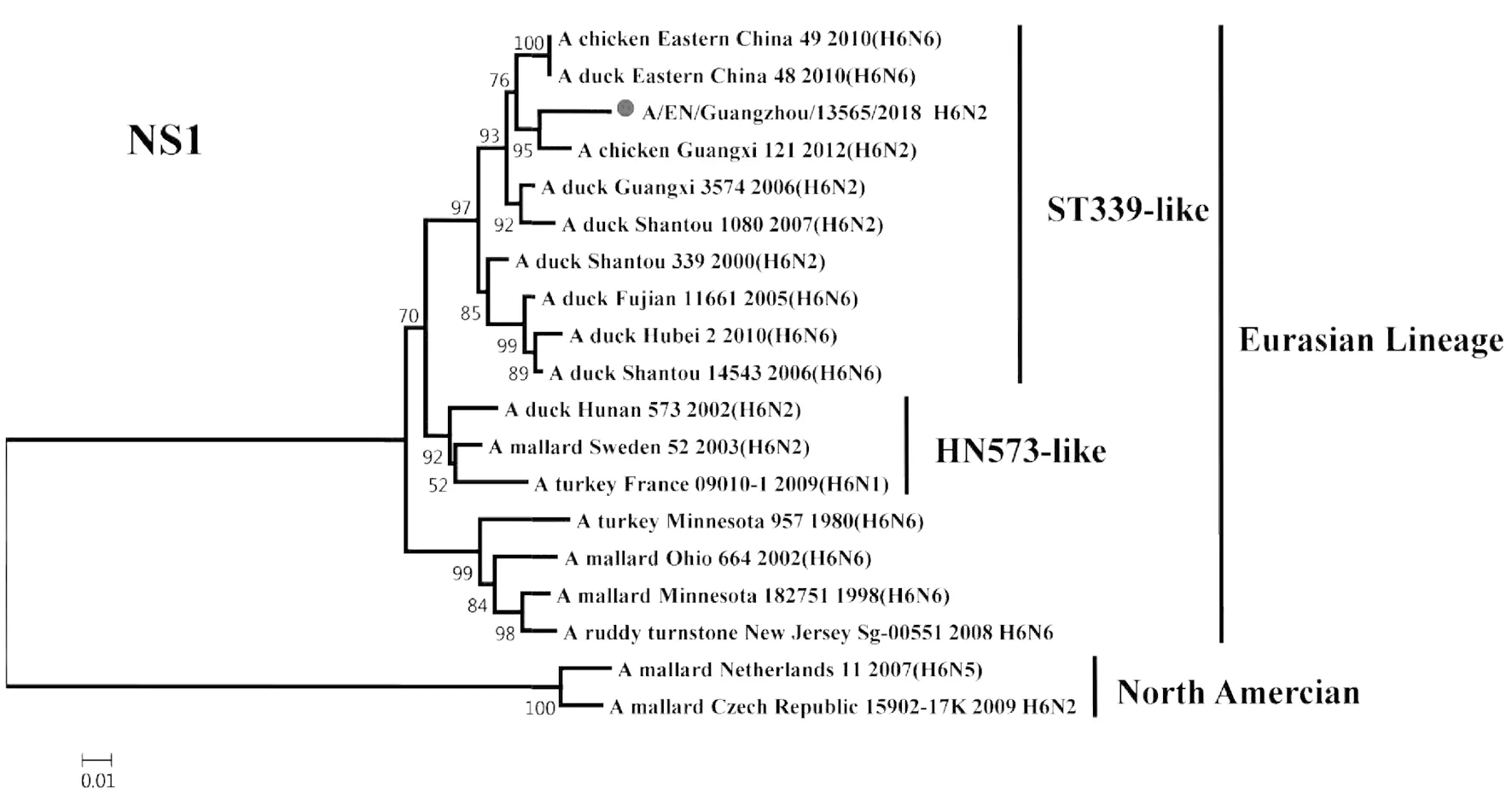
图8 A/EN/Guangzhou/13565/2018(H6N2)NS1基因遗传进化树Fig.8 Genetic evolution analysis of the NS1 gene of A/EN/Guangzhou/13565/2018 (H6N2)
2.3分子特征 在HA蛋白226和228位受体结合位点上,表现为226Q和228G,显示该病毒优先结合禽源受体,在HA1和HA2连接处的裂解位点序列为RQIETR/GLF,只有一个碱性氨基酸,符合低致病性禽流感病毒基因序列。NA蛋白274和292位耐药位点上,表现为274H和292R,提示该病毒对神经氨酸酶抑制剂敏感。NA基因共编码469个氨基酸,颈部未发生与毒力变化相关的氨基酸缺失。在PB2蛋白89位,该病毒发生与增加小鼠致病性相关的L89V突变,在增加对哺乳动物传播能力的627和701位,未发生突变。在哺乳动物细胞中复制相关的PB1蛋白368和473位,该病毒只发生L473V突变。在增加小鼠体内复制的PB1-F2蛋白中,该病毒表现为34个氨基酸的截短突变。在种属特异性相关的PA蛋白100、356和409位,该病毒只发生S409N突变。在增加对小鼠致病性相关的M1蛋白30和215位,该病毒发生N30D和T215A突变。在M2蛋白耐药位点上,该病毒未发生S31N耐药突变,提示对金刚烷胺类药物敏感。在增加对小鼠致病性相关的NS1蛋白42和205位点,该病毒发生P42S和N205S突变。
3 讨 论
自1965年首次从美国火鸡体内分离到H6亚型禽流感病毒以来[8],该亚型病毒陆续在野禽和家禽体内分离到[9]。2013—2015年广西活禽市场H6亚型禽流感病毒阳性率为5.93%,且呈逐年上升趋势[10]。2016—2017年厦门市活禽市场低致病性禽流感病毒阳性率高达40.4%,主要为H9和H6亚型[11]。2002—2010年华东地区的监测数据显示H3和H6亚型是主要流行的低致病性禽流感病毒亚型[12-14]。由于H6亚型禽流感病毒多为低致病性,对其研究也相对较少。2000年2月,低致病性H6N2亚型禽流感在美国加利福尼亚暴发,从散养的家禽和商品鸡均可分离出禽流感病毒[15-16]。近年研究发现,H6亚型禽流感病毒可以感染人发生跨种间传播,如2013年台湾报道了首例人感染H6N1禽流感病毒病例[17]。血清学研究也显示,早在2007年广西健康人群中检测到了H6亚型禽流感病毒抗体[18]。上述研究均提示H6亚型禽流感病毒具有突破种间屏障直接感染哺乳动物甚至感染人的潜能,这对公共卫生构成严重威胁。本研究对2018年分离于广州禽类市场外环境中的1 株H6N2禽流感病毒进行全基因组测序,并进行了分子遗传特征分析,这对持续监测H6亚型禽流感病毒的变异和预警有着重要意义。
表面基因分子特征分析显示,该H6N2禽流感病毒优先结合禽源受体,裂解位点氨基酸序列也提示符合低致病性禽流感病毒分子特征,说明该病毒尚未发生较大变异,发生跨宿主传播的风险较低。NA蛋白和M2蛋白耐药位点显示,该病毒对神经氨酸酶抑制剂和金刚烷胺类药物敏感,与大部分禽源流感病毒的耐药特点一致。NA蛋白未发生颈部氨基酸缺失,提示该病毒自然宿主可能源自于水禽,与H6亚型禽流感病毒易于感染鸭鹅等水禽[19]、不易感染鸡的生物学特点相符。进一步对内部基因分子特征分析显示,该病毒在PB2-89位、PB1-473位、PB1-F2蛋白、PA-409位、M1-30/215位、NS1-42/205位均发生对哺乳动物致病性增强的氨基酸变异,提示该毒株存在发生跨宿主传播的潜在风险。
研究显示,H6亚型禽流感病毒可以为人感染H5亚型禽流感病毒提供基因骨架,进而增加禽流感病毒跨物种传播风险[18],如1997年出现的人感染H5N1禽流感[20]、2014年和2015年先后在我国四川和广东出现的人感染H5N6禽流感[21]。本研究中遗传进化分析提示,该病毒NA基因来源于国内的H6N2禽流感病毒,未发现与H1N2、H3N2、H4N2、H5N2、H9N2等其他HxN2禽流感病毒重组的现象。全基因遗传进化特征显示,NP基因来源于HN573-like分支,其余基因均来源于ST339-like分支,表明该H6N2禽流感病毒为多分支进化来源的重组病毒,提示广州市禽类市场外环境H6N2亚型禽流感病毒存在基因重组,但重组发生的时间和环节需要进一步的研究。
本研究率先对广州地区禽类市场外环境H6N2亚型禽流感病毒进行全基因组遗传特征分析,发现病毒存在基因重组现象,该病毒虽为禽源低致病性病毒,但存在发生跨宿主传播的潜在风险,应持续加强对H6N2亚型禽流感病毒的流行和变异监测。
利益冲突:无

