外泌体在寄生虫及媒介病毒中的研究进展
王海洋,李梦茹,程 鹏,公茂庆
上世纪80年代,有研究者在体外培养的绵羊红细胞的上清液中发现了一种直径在40~100 nm之间的小囊泡。随后,这种小囊泡被命名为外泌体(exosomes)。研究之初,外泌体被普遍认为是细胞代谢的一种“废弃物”,因而并没有受到广泛关注。现如今,随着生物医学技术的发展,人们对外泌体的认识也愈加深入。外泌体的典型直径为30~100 nm,电镜下呈杯状形态,在蔗糖密度梯度下悬浮密度为1.10~1.21 g/mL[1-2],其膜结构中含有外泌体的标志物四聚体蛋白家族CD9和CD81[3],以及丰富的鞘磷脂和胆固醇,这些都是在黄病毒感染中必不可少的物质[4]。普遍认为,外泌体主要存在于大多数体液中,如血浆、羊水、尿液、母乳和唾液等,具有广泛的病理生理功能[5-6]。
外泌体的相关研究主要集中在以下3个方面:①作为细胞间信号转导的枢纽,调节机体的免疫应答,促进细胞增殖;②作为疾病早期诊断的标志物分子,外泌体内部含众多细胞特异性结构,能够准确反映分泌细胞的类型及功能,因此可以通过检测特异性标志物来检测某些疾病的发生发展状况;③作为一种靶向给药途径,因外泌体表面有许多特异性膜蛋白,可以识别受体并与之发生特异性结合,因此,将外泌体作为一个定向给药系统能够大大增加药物作用的精确性,并且能够减少药物的用量,降低药物的毒副作用[7]。
需要特别指出的是,细胞外囊泡(extracellular vesicles,EVs)与外泌体有众多相似的特征且两者之间至今没有一个明确的界限加以区分,有学者将外泌体和EVs的概念混用,也有学者认为外泌体属于EVs范畴,将EVs根据直径大小和生成、分泌方式的不同分为外泌体和微囊泡(microvesicles,MVs)[8]。
1 医学原虫外泌体
医学原虫以及原虫感染性疾病至今仍是全球亟需解决的医疗卫生问题,外泌体的发现和研究为防治原虫疾病带来了新的转机。已有研究表明,疟原虫(Plasmodium)、利什曼原虫(Leishmania)和锥虫(Trypanosome)等多种医学原虫都能够释放外泌体,并且已有学者从原虫的分泌物中成功分离并纯化外泌体,这对于外泌体在医学原虫领域的研究打下了坚实的基础。
1.1虫源性外泌体 从最近几年的报道中不难看出,虫源性外泌体的研究主要集中在医学原虫中。根据产生的机制和大小的不同,虫源性外泌体主要被分为4种类型:①外泌体;②微型囊泡;③凋亡小体;④瘤小体。具体组分和物质性质见表1。接下来分别对研究较为集中的几种医学原虫外泌体及其在原虫感染性疾病中的作用进行分论。

表1 虫源性外泌体研究进展Tab.1 Research progress of parasites-derived exosomes
1.1.1利什曼原虫外泌体 利什曼病是一种由利什曼原虫通过白蛉(sandfly)传播的寄生虫病,根据临床特征可分为皮肤利什曼病、粘膜利什曼病和内脏利什曼病3种类型。研究发现利什曼原虫外泌体通过刺激人类宿主产生白细胞介素-10(IL-10)和抑制肿瘤坏死因子α(TNF-α)的释放来调节人类单核细胞所释放的细胞因子(主要为IL-4)对干扰素-γ(IFN-γ)的作用[9],从而起到杀伤胞内病原体的作用。此外,杜氏利什曼原虫(Leishmaniadonovani)外泌体会抑制脊椎动物淋巴结和脾脏产生CD4+T细胞,并加重宿主的感染[9]。另外已有研究证实,在已发现的329种利什曼原虫蛋白质中,有超过52%是由外泌体介导的方式释放的,且大都可以看作是利什曼原虫感染的主要毒性因子[10-11]。与其他原虫类似,利什曼原虫外泌体可以通过调节巨噬细胞的信号传导功能发挥促炎作用,并在感染部位招募中性粒细胞,加剧感染[12]。此外,利什曼原虫表面分布着一种锌依赖的金属蛋白酶GP63,约占其总蛋白组的1%,通过糖磷脂酰肌醇(GPI)锚定在利什曼原虫表面得以表达,或通过外泌体介导的方式分泌到细胞外环境[13-14]。有报道称,GP63基因因编码一些常见的毒力因子而高度保守。早期关于GP63毒力作用的研究表明,GP63能够将补体蛋白C3b裂解为失活的iC3b片段,从而帮助寄生虫逃避补体介导的裂解作用。研究发现外泌体在利什曼原虫GP63进入巨噬细胞发挥毒力作用时具有重要的作用,即利什曼原虫外泌体先与巨噬细胞质膜融合,再介导GP63的入膜反应[15]。因此,如能对外泌体介导的原虫入膜反应加以阻抗干预措施,或许能够间接的抑制GP63发挥毒性,继而降低利什曼病的严重程度[15]。在Hassani等[16]关于利什曼原虫外泌体释放实验中,最初的结果表明当原虫进入脊椎动物宿主时,环境温度发生改变会促使原虫表面囊泡和外泌体的分泌急剧增加。Atayde等[17]通过小鼠实验表明,外泌体和其它多种囊泡甚至决定着利什曼病的严重程度和转归。
1.1.2疟原虫外泌体 疟疾是一种由疟原虫引起的寄生虫病,临床表现为间歇性发热、呕吐、乏力和红细胞损伤引起的头痛[18]。研究表明,外泌体的释放量与疟疾的严重程度有关[19]。从受伯氏疟原虫(Plasmodiumberghei)感染的宿主血清中提取的外泌体含有寄生虫抗原,以剂量特异性的方式刺激巨噬细胞表面CD40表达和TNF释放,并通过巨噬细胞诱发免疫反应[20]。另外,研究人员还从BALB/c小鼠的外周血中分离出约氏疟原虫(Plasmodiumyoelii)所释放的外泌体,通过蛋白质组学研究,发现这些外泌体含有寄生虫蛋白(具有免疫原性和免疫反应性),能够刺激小鼠产生IgG抗体,诱导网状红细胞增多症和激活宿主免疫反应[21]。还有报道称,约氏疟原虫外泌体能在受感染小鼠体内抑制肺癌细胞的生长,且外泌体中miRNA的高携带量会导致血管内皮生长因子受体(VEGFR2)表达降低,从而抑制血管生成和肿瘤的生长[22]。
1.1.3阴道毛滴虫外泌体 有关阴道毛滴虫(Tri-chomonasvaginalis)外泌体的研究发现,外泌体能够通过抑制宿主分泌IL-8从而有效抑制嗜中性粒细胞的增殖和迁移,继而影响嗜中性粒细胞通过凝集素途径或旁路途经激活补体而发挥杀虫作用。因此可以认为,虫源外泌体抑制IL-8的分泌,有利于其在宿主体内存活和生长[23]。
综上所述,对于受感染的宿主来说,虫源性外泌体是一把“双刃剑”,给原虫在寄生时提供了有利的寄生环境,为之后的感染提供了较有力的保障;同时又能激活宿主免疫反应,实现对宿主的保护性免疫。
1.2宿主源性外泌体 过去关于原虫-外泌体的研究中,已有大量报道指出,医学原虫在寄生和感染宿主细胞的同时,不仅虫体本身可以释放大量外泌体,还可以刺激宿主细胞分泌外泌体,前者主要参与调控虫体的寄生环境和宿主免疫应答,后者主要参与调节机体的免疫系统。更具体地说,虫源性外泌体及宿主细胞释放的外泌体都参与了寄生虫病的发病机制[24]。一方面,虫源性外泌体包含保守的寄生虫特异性信息,包括蛋白质、RNA、非编码RNA(ncRNA)和核酸,这些信息被转移到宿主细胞,然后可以调节宿主免疫系统,参与寄生虫的免疫逃逸,最终促进感染[25]。另一方面,宿主细胞在受到寄生虫感染时进入应激状态,同时释放外泌体,激活NK细胞、巨噬细胞、单核细胞、T细胞、B细胞等免疫细胞,发挥抗感染作用[26]。
Bhatnagar[27]等研究发现,受到刚地弓形虫(Toxoplasmagondii)感染的巨噬细胞会大量释放外泌体,同时,这些外泌体会促进未成熟巨噬细胞释放Toll样受体(TLR)和TNF-α等细胞因子,这些细胞因子会积极地参与机体的抗虫免疫反应。另外,妊娠期母鼠在受到弓形虫感染时,从受感染的树突状细胞中提取的外泌体可以保护小鼠的胎儿不受垂直传播导致的感染[28]。可见,宿主细胞在受到原虫入侵时,能够以分泌外泌体的方式对感染源做出回应以保护机体免受侵扰。
在疟原虫感染的小鼠模型中,Combes[29]等发现敲除ABCA1基因可直接导致宿主源性外泌体分泌量下降,从而保护受感染小鼠免受脑型疟疾。Lorena[21]等研究了小鼠体内受约氏疟原虫(Plasmodiumyoelii)感染的网状细胞所释放的外泌体免疫效应,他们观察到,外泌体介导的免疫效应可以很好地保护小鼠免受约氏疟原虫等多种原虫的感染。另有一项研究[30]揭示了外泌体在恶性疟原虫(Plasmodiumfalciparum)生物学中的作用,表明受感染的红细胞可以通过分泌外泌体直接与寄生的疟原虫进行信息交换,这一效应似乎对疟原虫向媒介蚊虫的传播发挥了重要的作用,但其具体机制不详。
以上宿主源性外泌体的研究证明了其在医学原虫感染中的重要性。一些宿主源性外泌体的研究进展见表2。
2 医学蠕虫外泌体
在蠕虫感染过程中,分泌细胞的起源是决定外泌体功能和组分的关键因素,在功能方面,外泌体是机体-虫体免疫调节的关键一环:包括抗原呈递、调节宿主免疫应答、表达某些活化分子、免疫监视以及介导细胞间通讯[35-36]。在组分方面,蠕虫外泌体主要含有miRNA、蛋白质及脂类等。

表2 宿主源性外泌体研究进展Tab.2 Research progress of parasitifer-derived exosomes
2.1马来布鲁线虫外泌体 马来布鲁线虫(Brugiamalayi)以蚊虫为中间宿主,是一种常见的医学蠕虫,主要寄生于人类淋巴系统,侵入人体后会引发淋巴丝虫病[37]。Zamanian[38]等用RNA干扰(RNA interference,RNAi)技术沉默了马来布鲁线虫外泌体释放基因BM-CPL-1,发现该虫在失去外泌体释放功能后,不仅对蚊虫的感染率下降了近40%,而且建立和维持寄生虫血症的功能也受到了限制。另有报道,马来布鲁线虫在宿主体内释放的外泌体还有激活宿主巨噬细胞的功能,以调节机体固有免疫应答[24]。由此可见,通过调节宿主体内的虫源性外泌体的分泌,对某些蠕虫感染性疾病的治疗来说可作为一个潜在的有利靶点。
2.2血吸虫外泌体 血吸虫病是由裂体属吸虫如日本血吸虫(Schistosomajaponicum)、曼氏血吸虫(Schistosomamansoni)等感染引起的热带寄生虫病,其在世界范围内对公共卫生所造成的影响仅次于疟疾。最近,有学者首次从日本血吸虫中分离、提纯了外泌体样囊泡,并对其做了分析。结果表明,这些囊泡能够促进巨噬细胞极化,并产生TNF-α、CD16/32等促炎因子[39]。此外,Zhu[40]等通过蛋白质组学分析了血吸虫外泌体中的403个蛋白质成分,发现这些蛋白组分除了具有催化活性、翻译调节活性以及抗体结合活性外,还可以将miRNA传递到宿主细胞中,从而介导寄生作用。在自身免疫性疾病中,树突状细胞释放的外泌体可以调节免疫反应的过度活化;且最新的研究表明,向小鼠模型腹腔注射树突状细胞源性外泌体可以抑制小鼠炎症性肠胃病的进展,主要作用机制是抑制促炎细胞因子,如IL-17a和IFN-γ,并促进TGF-β抗炎细胞因子的生成。鉴于其抗炎作用的存在,多位学者认为外泌体可能具有免疫抑制药物的应用价值[41-42]。
2.3丝虫外泌体 淋巴丝虫病是一种由寄生的班氏丝虫(Filariaphilippinensis)、马来丝虫(Brugiamalayi)引起的由蚊虫传播的热带病,在全球73个国家传播和流行。研究指出,班氏丝虫感染宿主后,会向宿主分泌大量外泌体,其内主要包含生物活性蛋白、mRNA、miRNA和其它非编码小RNA[43]。现已证明,外泌体携带的部分小RNA能够调控宿主的基因表达,并抑制宿主的免疫反应,以促进虫体的寄生和生长[44-45]。而那些具有生物活性的蛋白质,其中约80%都能在哺乳动物的外泌体中发现。那些已经被鉴定的蛋白质,有20%参与了生物活性分子的结合,16%参与了各种离子的运输,21%参与了各种水解酶和转移酶的代谢过程。以上生物活性物质发挥作用的前提是携带它们的外泌体能对其进行精准的运输和调控[46],比如当机体发生丝虫感染时,会以外泌体介导的方式释放BM-CPL-1(一种类似于半胱氨酸蛋白酶的蛋白质分子),虽然这种蛋白质分子的具体功能尚不清楚,但是已有学者证实它的存在能够良好地维持寄生虫血症[47]。
3 医学节肢动物外泌体
医学节肢动物的治理是目前防治媒介疾病最有效的方法之一。随着人们对外泌体有了更深入的了解,医学节肢动物外泌体及其在媒介病毒和媒介疾病中的研究成果也相继问世。其中,以蜱虫和蚊虫等节肢动物外泌体的研究成果最具代表性,学者们希望节肢动物外泌体能给媒介疾病的防治提供新的思路和参考价值。
3.1蜱虫外泌体 蜱虫是多种脊椎动物体表的暂时性寄生虫,同样也是一些人兽共患病的重要传播媒介和贮存宿主[48]。研究发现,来自蜱神经元细胞的外泌体可能介导蜱虫传播的黄病毒RNA和蛋白质,并在中枢神经系统中从一个神经元细胞向另一个神经元细胞传递。另外,蜱传兰加特病毒(tick-borne langat virus,LGTV)是一种与蜱传脑炎病毒(tick-borne encephalitis virus,TBEV)密切相关的模式病原体,其能够充分利用节肢动物外泌体将病毒RNA和蛋白传递到宿主皮肤角化细胞和血细胞[49]。有学者发现,在蜱N2a细胞和神经元细胞中可观察到LGTV E蛋白去糖基化现象[50],而这种病毒E蛋白的去糖基化过程需要病毒粒子和外泌体的参与。值得指出的是,在蜱虫细胞中维持糖基化的LGTV E-蛋白的主要作用可能是为了促进宿主细胞分泌外泌体和感染病毒,从而使节肢动物在寄生到脊椎动物宿主时能立即传播病毒以触发感染[50]。也有学者证实,在蚊虫细胞中,西尼罗河病毒(West Nile virus,WNV)E蛋白大量糖基化是将病原体传递给脊椎动物宿主所必需的过程[51]。部分寄生虫与医学节肢动物外泌体研究进展见表3。
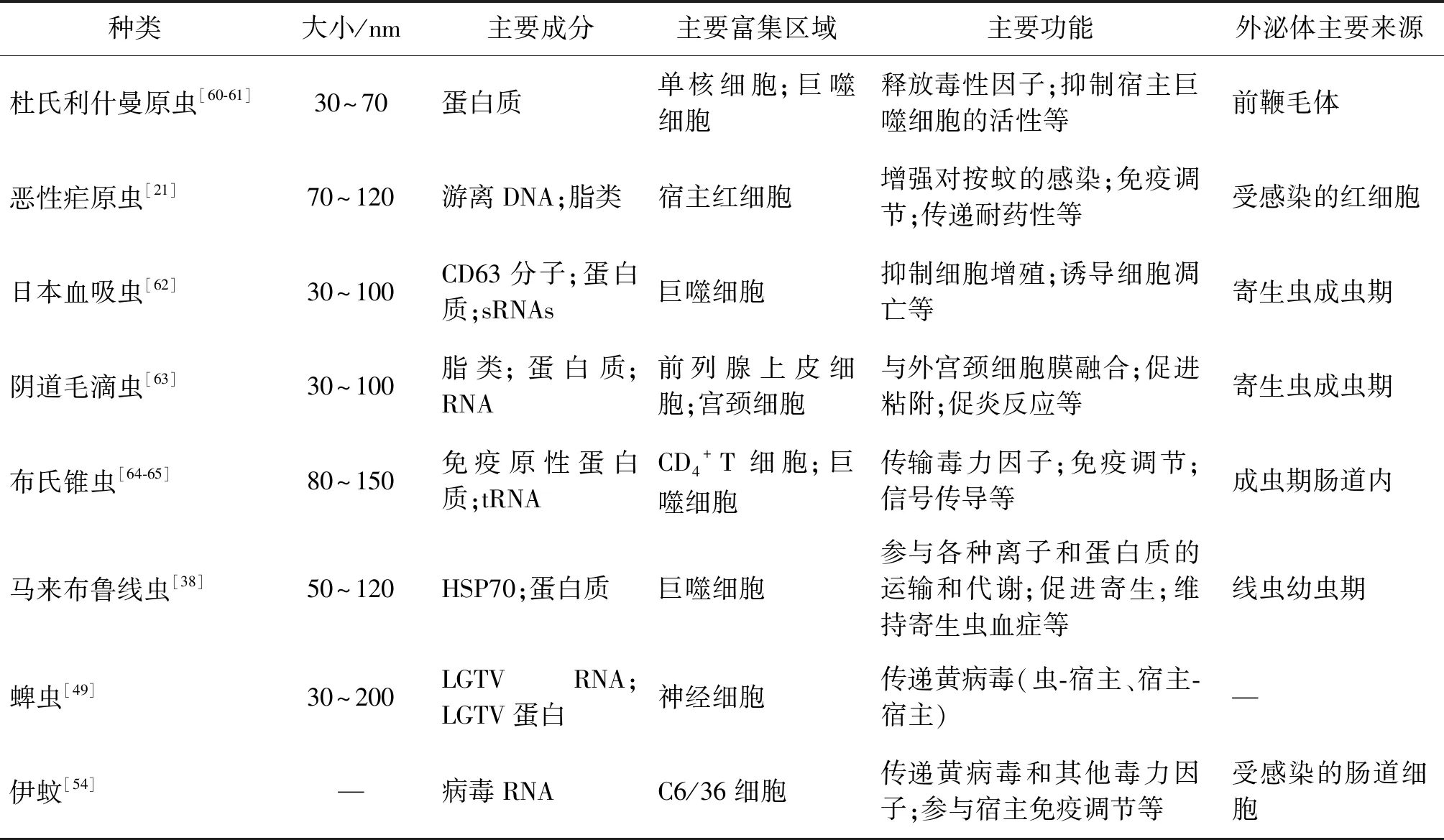
表3 部分寄生虫与医学节肢动物外泌体研究进展Tab.3 Research progress of exosomes on a part of parasites and vector insects
3.2蚊虫外泌体 伊蚊(Aedes)是登革病毒(Dengue virus,DENV)的主要传播媒介,DENV属于黄病毒科黄病毒属,含4种血清型(Ⅰ、Ⅱ、Ⅲ、Ⅳ型)[52]。外泌体不仅参与伊蚊的各项生理机能,同样参与着登革热疾病的感染过程[53],登革热是一种广泛流行于热带和亚热带的人兽共患疾病。Vora等[54]曾报道感染DENVⅡ型或Ⅲ型的伊蚊细胞能够分泌携带病毒RNA和蛋白质的外泌体,且这些外泌体能够继而感染伊蚊C6/36细胞和哺乳动物细胞。Vora使用低剂量GW4869(外泌体释放抑制剂)处理受DENVⅡ型感染的蚊虫细胞并作为阴性对照,发现DENVⅡ感染是由外泌体的释放所介导的。与此同时,GW4869处理也影响了病毒包膜蛋白与伊蚊细胞四聚体蛋白域内的糖蛋白(Tsp29Fb)的相互作用,表明该节肢动物Tsp29Fb在外泌体释放途径中发挥一定的作用。经过反复验证,Vora做出了这样的结论:通过抑制节肢动物Tsp29Fb或通过GW4869抑制外泌体的释放可能是一种阻断DENVⅡ传播的有效方法,也可能成为一种防治蚊媒病毒的潜在措施。Braicu[55]等另有报道,外泌体这条通路不仅参与了DENV的传播和感染,还能帮助DENV Ⅱ型继续寻找下一个靶细胞。值得注意的是,Zhou[49]等用网格蛋白(clathrin)抑制剂(Pitstop-2)处理后发现,外泌体介导的虫媒病毒传播依赖于网格蛋白介导的内吞作用。
在此基础上,Reyes-Ruiz[56]等人利用负染色电子显微镜和动态光散射技术(dynamic light scattering,DLS)对Vora等的发现加以补充,受DENV感染的伊蚊细胞所分泌的外泌体,其平均直径远比未受感染的伊蚊细胞的外泌体大的多,且含有病毒样微粒。可以看出,外泌体在DENV的传播中发挥着对宿主不利的消极作用。但是,最近的一项调查却得出了与上述相悖的结论,Martins从感染DENV的哺乳动物体内分离出来的外泌体参与着宿主的免疫防御,调节着生物活性分子的分泌以达到抵抗感染的目的[57]。因此,定性外泌体在受DENV感染的细胞中的功能和作用机制,以及其在登革热感染病程中发挥的作用都需要在未来的研究中进一步阐明。
另外有研究发现,大多数由医学节肢动物传播的黄病毒可在脊椎动物大脑微血管内皮细胞中复制,这些内皮细胞起到保护血脑屏障的作用,受感染的内皮细胞更易在外泌体的介导下受到黄病毒的侵犯并引起中枢神经系统的损伤[58-59]。有学者推测最初来源于内皮细胞的少量外泌体在进入血脑屏障后,可能会继而介导黄病毒向中枢神经系统传播。受到感染的神经细胞会迅速分泌大量携带感染源性物质的外泌体以加速血脑屏障的破坏,从而允许更高的外周病毒载量以及免疫细胞的活化和转运。不仅如此,外泌体在介导虫媒病毒传播的同时,也在维持病毒RNA活性以及持久的感染而发挥着一定作用[50]。
4 总结与展望
人类与寄生虫感染的斗争史同样也是一部见证着人类医学发展的医学史。如今,寄生虫病仍多发于卫生条件较为落后的国家和地区,因缺乏有效的疫苗以及高效特异的治疗方法而使寄生虫感染的“重灾区”蒙受着巨大的财政损失。然而,外泌体的研究或能为寄生虫病的突破打开新大门。研究发现,外泌体样囊泡的膜结构可以作为疫苗等药物在宿主体内转运。另有报道描述,寄生虫外泌体的质膜结构较哺乳动物的更加稳定,因此通过探索其结构、生成方式和分泌方式,有望开发出更可靠的疫苗传递系统。此外,外泌体中含有的某些重要的蛋白成分,因其具有较强的免疫原性而被认为可以作为候选抗原以用于相关疫苗的开发[66]。值得强调的是,外泌体在宿主对寄生虫病的免疫调控中也参与了重要的一环,如参与抗原物质提呈、刺激或抑制细胞因子分泌等。一方面,在多种效应机制的刺激下,寄生虫向宿主体内释放包裹有大量虫源信息的外泌体,从而参与宿主免疫系统的调节,抑制炎症反应,改善其寄生环境[67];另一方面,宿主也会释放外泌体对虫源感染做出积极回应。因此,可否在明确感染和发病机制的前提下,开发出外泌体介导的免疫疗法?这一问题值得进一步深思和探讨。经过数十载的探索,外泌体在肿瘤等疾病的早期诊断和靶向治疗中已有了深入的研究,在寄生虫以及媒介病毒领域中也有了长足的发展。未来,需要规范外泌体分离和提纯方式、建立各研究领域外泌体数据库,以便在今后的研究中更加高效便捷地辨识和提取。相信随着研究的不断深入,利用外泌体早期预防、诊断和治疗寄生虫疾病和媒介疾病将成为现实。
利益冲突:无

