宫颈脱落细胞中人乳头瘤病毒52型感染及整合状态分析
马 迪,张 放,苗智颖,王 静,徐 媛,杨佳宁,李淑英,郑春阳
宫颈癌是全球女性第4大常见恶性肿瘤,全世界每年新增宫颈癌病例约57万,死亡病例每年近31万[1],我国宫颈癌患者数量占全球总数的 1/3。宫颈癌严重威胁了女性的健康和生命安全[2-4]。人乳头瘤病毒(Human papillomavirus,HPV)感染是女性宫颈病变的重要病因[5]。HPV E6/E7基因整合状态与宫颈癌变的程度密切相关,即HPV E6/E7基因整合率越高,宫颈癌变程度越高[6-7]。为进一步了解就诊女性人乳头瘤病毒感染状况,本文对华北理工大学附属医院妇科就诊女性的宫颈脱落细胞标本中HPV52感染及整合状况进行了分析,探讨HPV在宫颈病变中的作用机制,为宫颈病变患者的早期诊断和治疗提供理论依据。
1 材料与方法
1.1标本收集 收集2016年1月至2018年3月华北理工大学附属医院妇科就诊女性的宫颈脱落细胞标本928例,就诊女性年龄范围在27~71岁,平均(43.5±5.0)岁,所有被检者检测前均未注射过HPV疫苗。标本收集过程如下:①以扩阴器暴露宫颈,用无菌生理盐水清洗取样部位;②用无菌棉签在被检者宫颈内按照顺时针方向旋转3 圈收集宫颈脱落细胞;③取出棉签,用无菌生理盐水洗脱棉签中宫颈脱落细胞;④将所收集标本分成2 份:1 份迅速冻存于-80 ℃,留作DNA提取并进行HPV感染及整合状况的检测,另1 份用于病理组织学诊断。实验中所用HPV52(含有HPV52基因组)质粒、β-actin质粒及293细胞DNA本实验室保存。
1.2病理细胞学诊断 将所收集宫颈脱落细胞进行洗涤后制片、染色,用光学显微镜镜检观察,记录结果,参照TBS(the 2001 Bethesda system)分级系统,对所收集标本进行病理细胞学诊断。
1.3引物设计及合成 根据GenBank提供的基因序列X74481.1(http://www.ncbi.nlm.nih.gov/nuccore/X74481)。HPV整合时,E2中心区域“绞链区”因其不稳定性而成为HPV整合入宿主细胞最常见的HPV缺失或断裂部位,而E6和E7 ORF及长控区(long control region,LCR)保持完整[8]。依据上述原理在设计HPV52 E6引物时,选择HPV52 E6区域的1个位点及HPV52 E2区域的3个不同部位(即HPV52 E2起始区2 735-2 910、“绞链区”3 261-3 395、接近终点区3 604-3 848)设计引物,这样设计的引物可真实地反映HPV52的缺失或断裂部位,从而可真实地反映整合状态,设计HPV52 E6与E2引物,同时设计人看家基因β-actin引物,并合成HPV L1区通用引物MY09/11[9],详见表1。所有引物委托上海生工合成。

表1 实验中所需各种引物Tab.1 Primers used in the experiment
1.4DNA的提取与标本质量检测 用试剂盒QIAamp DNA Mini Kit提取标本DNA,按说明书操作。所提标本DNA于-20℃保存备用。用人看家基因β-actin作内参PCR扩增,检测所收集928例标本DNA质量能否满足进一步实验要求:用所提293细胞DNA作为阳性对照的模板,以无菌双蒸水作为阴性对照的模板进行PCR扩增。PCR应用2×Power Taq PCR Master Mix,应用表1中β-actin引物,以所提标本DNA 0.3 μL作为反应的模板,最后添加无菌双蒸水至总体积为20 μL。PCR循环参数:95 ℃预变性5 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,共33个循环;延伸72 ℃ 5 min;4 ℃保温。所得PCR产物用1%琼脂糖进行凝胶电泳,然后凝胶成像仪照相记录结果。
1.5标本HPV总感染率和HPV52型检测 以HPV L1区MY09/11引物[9]检测收集标本中HPV感染率(以HPV52质粒DNA为阳性对照的模板,以无菌双蒸水为阴性对照的模板);以HPV52 E6型特异性引物检测HPV52型(以HPV52质粒DNA为阳性对照的模板,以无菌双蒸水为阴性对照的模板),PCR应用2×Power Taq PCR Master Mix,以所提标本DNA 0.3 μL作为反应的模板,最后添加无菌双蒸水至总体积为0.5 μL。PCR循环参数:95 ℃预变性5 min; 95 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,共33个循环;延伸72 ℃ 5 min;4 ℃保温。所得PCR产物用1%琼脂糖进行凝胶电泳,然后凝胶成像仪照相记录结果。
1.6实时荧光定量PCR 分别将HPV52及β-actin质粒进行10倍稀释成6个梯度,以此6个梯度的质粒作为标准品,用表1(HPV52 E2、E6及β-actin)引物进行实时荧光定量PCR,每份标本用每套引物平行分析3次,以3次结果的平均值为最终结果。PCR总体积(25 μL):1×Buffer(AmpliTaq Gold ,MgCl2free),2 pmol/L引物,2.5 mmol/L MgCl2,0.2 mmol/L dNTPs, 0.25 μL Rx(稳定剂),1.25 μL 20×EvaGreen,5 U AmpliTaq Gold DNA聚合酶,将6个稀释梯度标准品和每例样品DNA分别加入每个PCR反应管中,加入模板DNA的量分别为0.5 μL,加无菌双蒸水补足至25 μL。病毒载量=(E6 copy/β-actin copy) × 2,所得结果为每个细胞中HPV52拷贝数;通过E2/E6拷贝数比值,确定HPV52整合状态。
1.7统计学分析 将所得数据建立Excel数据库,用SPSS 17.0统计软件进行分析,组间比较采用χ2检验,P<0.05为差异具有统计学意义;相关性分析采用Spearman相关分析法,P<0.05为二者有相关性。
2 结 果
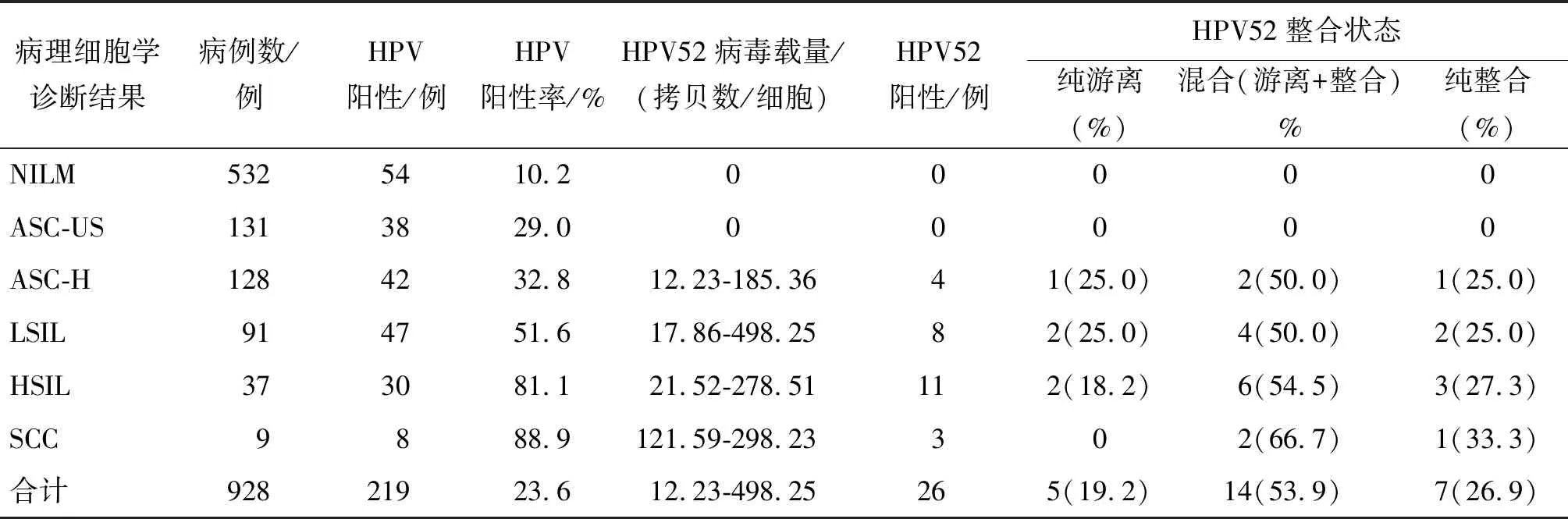
2.1病理细胞学诊断结果 参照2001年Bethesda分级系统,将所收集标本进行病理细胞学诊断后结果为:鳞状细胞癌(squamous cell carcinoma,SCC)标本9例;高度鳞状上皮内病变(high-grade squmous intraepithelial lesion,HSIL),包括CINⅡ及Ⅲ标本37例;低度鳞状上皮内病变(low-grade squmous intraepithelial lesion,LSIL),包括CINⅠ标本91例;不能排除高级别鳞状上皮内病变的非典型鳞状上皮细胞(Atypical squamous cells-cannot exclude high-grade squamous intraepithelial lesion,ASC-H)标本128例;不能明确意义的非典型鳞状上皮细胞(atypical squamous cells of undetermined significance,ASC-US)标本131例;未见上皮内细胞病变(negative for intraepithelial lesion or malignant lesions,NILM)标本532例,详见表2。
2.2所收集标本质量检测结果 以所收集的928例标本DNA为模板,用β-actin引物进行PCR扩增,检测所提标本DNA质量,凝胶成像仪观察PCR产物,结果显示:阳性对照293细胞DNA模板PCR扩增后产物大小为289 bp,所提928例标本DNA中,每份标本 PCR扩增产物大小均为289 bp,表明所有标本DNA扩增产物大小与阳性对照结果相一致,以其中9例标本扩增结果为代表(图1),证实所收集928例标本质量符合实验需求。

M:100 bp ladder;Neg:阴性对照;293:阳性对照;1-9:标本代表图1 用β-actin引物PCR扩增检测标本质量Fig.1 Sample quality detected by PCR with β-actin primers
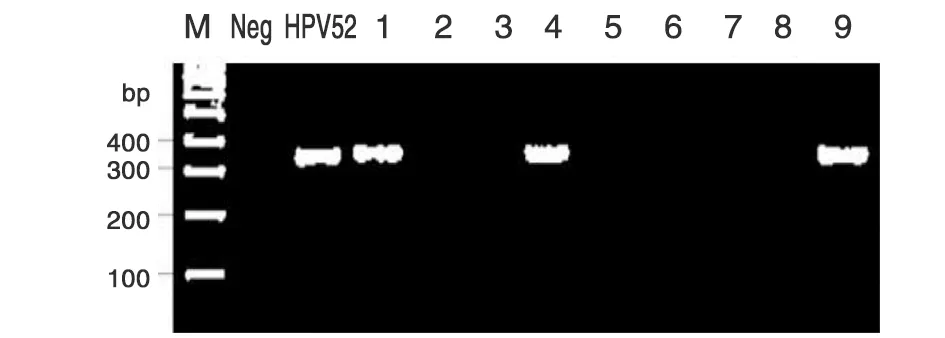
2.3标本HPV检测 所收集标本,经PCR扩增,在含0.01% 核酸染料的1.0%琼脂糖凝胶电泳后,凝胶成像仪照相检测,结果显示:以MY09/11为引物扩增,阳性对照HPV52质粒DNA模板扩增产物大小为450 bp,与阳性对照相比较,928例标本中有219例HPV阳性,以其中9例标本扩增结果为代表(图2)。标本DNA经HPV52 E6引物(表1)扩增后,阳性对照扩增产物大小为369 bp,219例阳性标本中检测到26例HPV52阳性,以其中9例标本扩增结果为代表(图3)。
2.4HPV52阳性标本病毒载量的检测 依据6个梯度10倍稀释β-actin、E2、E6标准DNA,在实时荧光定量PCR仪扩增后,系统自动获得E2、E6、β-actin的标准曲线,每例标本E2、E6、β-actin拷贝数自动读出。HPV52阳性标本病毒载量可依据公式(E6 copy/β-actin copy)×2计算得出(表2)。Spearman相关分析显示:患者宫颈病变程度与HPV52病毒载量之间无相关性(rs=0.184,P=0.568)。
依据E2与E6比值,确定HPV52整合状态。通过计算得知26例HPV52阳性标本中,纯游离型标本5例,其E2与E6比值等于1;14例为游离与整合的混合型,其0 M:100 bp ladder;Neg:阴性对照;HPV52:阳性对照;1-9:标本代表图2 以MY09/11引物PCR扩增检测HPV感染情况Fig.2 HPV infection detected by PCR with MY09/11 primers M:100 bp ladder; Neg:阴性对照;HPV52:阳性对照;1-9:标本代表图3 用HPV52 E6引物PCR扩增检测HPV52感染情况Fig.3 HPV52 infection detected by PCR with HPV52 E6 primers 表2 病理细胞学诊断、HPV52病毒载量及整合状态的相关信息Tab.2 Information on pathologic cytological diagnosis, HPV52 viral load and integration 高危型HPV52感染是引起宫颈癌、肛门癌和口咽癌的重要因素[10-11]。Klopfer等研究结果显示:病毒载量和病毒整合状态与临床病理细胞学类型存在显著相关性,并将病毒载量推荐为癌前病变的生物学标志物[12-13]。Mincheva等定量分析了宫颈癌细胞系CaSki、 SiHa和HeLa中病毒载量,结果显示: CaSki和SiHa细胞系的每个细胞中HPV16病毒载量分别为520和1~2个拷贝;HeLa细胞系中HPV18的病毒载量为每个细胞中10~50拷贝[14]。因此,没有一致的证据表明病毒载量是HPV相关疾病及疾病进展的标记。本项研究结果显示,宫颈病变程度与病毒载量之间无相关性,今后将扩大标本量进一步研究相关内容。 病毒基因整合可能是由HPV E6/E7基因下游的E1与E2区域的开放阅读框断裂或缺失引起的;而整合的病毒基因与宿主基因相互作用[15-17],导致病变的发生。本研究从928例宫颈脱落细胞样本中检测到26例HPV52阳性,阳性率为2.8%,其中5例为纯游离型,即E2与E6 比值等于1;14例为整合与游离的混合型,即E2/E6比值在0与1之间;7例为纯整合型,即E2/E6比值等于零。HPV 52基因整合入宿主基因组是宫颈病变的关键,可以通过检测HPV 52高危型的病毒载量值进行宫颈病变的早期筛查,以便及早发现宫颈病变的高危患者。今后将进一步扩大标本量进行验证。 利益冲突:无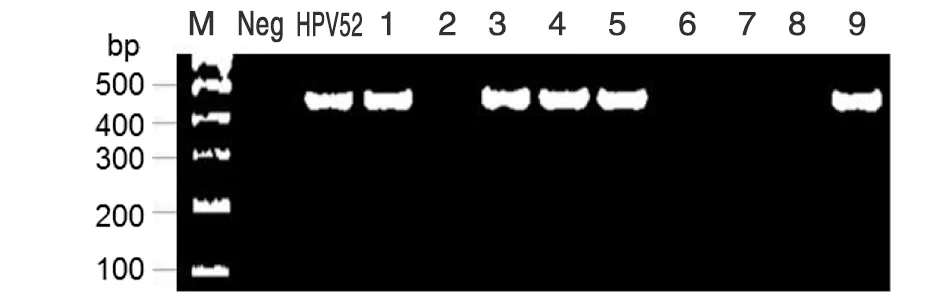
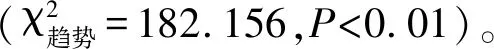
3 讨 论

