汉滩病毒感染诱导血管内皮细胞多糖包被损伤及其机制初步研究
杜 虹,王晓艳,李 璟,姜 泓,申焕君,王平忠
汉滩病毒(hantaan virus,HTNV)是布尼亚病毒科汉坦病毒属中的一种主要血清型,可引起以发热、休克、出血和肾脏损害为主要临床特征的肾综合征出血热(hemorrhagic fever with renal syndrome,HFRS)[1]。HTNV主要感染血管内皮细胞,可引起血管渗漏和通透性增加[2],但其机制尚不清楚。
多糖包被(glycocalyx,GCX)是内皮细胞屏障结构的重要组成部分,在维持血管内皮完整性方面发挥重要作用[3]。研究发现,在感染或致炎因素作用下,细胞中某些酶(统称为“脱落酶”)的表达或活性增加,它们可分解GCX,致GCX损伤,并释放其组成成分[4]。保护或修复损伤的GCX对防止血管渗漏具有重要作用,可能成为潜在的治疗靶点。然而,HTNV感染是否诱导血管内皮细胞GCX损伤,其机制如何,目前尚不清楚。为此,本研究以HTNV感染的人脐静脉血管内皮细胞(human umbilical vascular endothelial cells,HUVECs)为模型,以GCX为切入点,应用ELISA、间接免疫荧光(indirect immunofluorescence assay,IFA)、Western blot、实时定量PCR等技术,探讨HTNV感染诱导血管内皮细胞GCX的损伤及其初步机制,为HFRS发病机制和治疗靶点的研究提供新的资料。
1 材料与方法
1.1 材料 VERO E6、HUVECs和HTNV 76-118株(HTNV 76-118,以下简称HTNV)均由本实验室保存。VERO E6使用含10%胎牛血清的DMEM培养基,HUVECs使用内皮细胞专用培养基(ScienCell,1001),培养条件为37 ℃ 5%CO2。硫酸乙酰肝素(heparan sulfate,HS)、硫酸软骨素(chondroitin sulfate,CS)、透明质酸(haluronic acid,HA)、可溶性CD138和磷脂酰肌醇聚糖的ELISA试剂盒均购自上海西唐生物科技有限公司。一抗抗体均购自abcam公司。
1.2 ELISA检测 应用HTNV感染HUVECs,收取不同感染时间点(0 h、6 h、12 h、24 h、48 h、72 h)细胞上清进行ELISA检测。每一时间点,HS、CS、HA、可溶性CD138和磷脂酰肌醇聚糖均测定2次,取均值。以血管内皮生长因子(vascular endothelial growth factor,VEGF)、脂多糖(lipopolysaccharides,LPS)和TNF-α刺激作为阳性对照,NC作为阴性对照。具体方法参照说明书。
1.3 实时定量PCR检测 收取HTNV感染不同时间点(0 h、1 h、6 h、12 h、18 h、24 h、48 h、72 h)的细胞沉淀,利用Trizol试剂提取总RNA。将每管中加入200 μl氯仿;离心后取上清液,加入等量的异丙醇过夜沉淀;离心后用75%的无水乙醇清洗沉淀;将沉淀晾干,每管中加入20 μl DEPC水溶解RNA;最后进行RNA浓度测量。使用反转录试剂盒和2×SYBR染料进行实时定量PCR,检测细胞中相关基因的mRNA表达水平。引物序列由上海生工公司进行合成,GAPDH作为内参。
1.4 Western blot检测 利用蛋白裂解液收取HTNV感染不同时间点(0 h、1 h、6 h、12 h、18 h、24 h、48 h、72 h)的HUVECs,首先使用BCA试剂盒进行蛋白定量;其次用5×Loading Buffer在100 ℃条件下加热10 min制样;最后进行Western blot检测,每孔上样20 μg,利用GAPDH作内参。
1.5 免疫荧光检测 HTNV感染HUVECs 48 h后,用4%多聚甲醛固定15 min;0.3% TritonX-100处理5 min;5% BSA室温封闭2 h;一抗4 ℃过夜孵育;羊抗兔FITC二抗室温孵育1 h;DAPI染色5 min;加入抗荧光猝灭剂封片,在显微镜下观察拍照。
1.6 TEER检测 HTNV感染被弹性蛋白酶抑制剂(1 μM)预处理的HUVECs,于不同时间点(0 h、6 h、12 h、18 h、24 h、48 h和72 h)应用跨内皮电阻(transendothelial electrical resistance,TEER)检测HUVECs的跨膜电阻。
1.7 统计学处理 应用Graphpad统计学软件对数据进行处理和分析。蛋白用半定量描述,核酸用定量描述,2组间定量资料比较用Mann-Whitney U检验。P<0.05为差异有统计学意义。
2 结 果
2.1 细胞上清液中HS、CS、HA、可溶性CD138和磷脂酰肌醇聚糖的表达水平 利用ELISA检测细胞上清液中HS、CS、HA、可溶性CD138和磷脂酰肌醇聚糖的表达,结果如图1所示。HTNV感染后,细胞培养液中HA表达先上升后下降,HS和CS表达逐渐上升;可溶性CD138中LPS组和TNF-α组在24 h达到最高峰,HTNV、VEGF在24 h达到最高峰并维持至48 h;磷脂酰肌醇聚糖的表达与可溶性CD138相似。
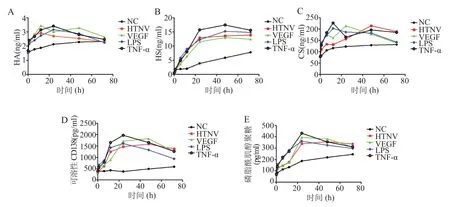
图1 不同时间点HUVECs上清液中GCX表达变化Figure 1 Change of expression of glycocalyx in supernatant of HUVECs at different time points
2.2 HTNV感染HUVECs后CD44、CD138和磷脂酰肌醇聚糖的表达 利用实时定量PCR和Western blot检测HTNV感染不同时间点CD138、磷脂酰肌醇聚糖和CD44的表达,结果如图2所示。随着HTNV感染的持续,CD138 mRNA表达水平先上升后下降,在48 h达到最高峰,上调3.68倍(U=6.350,P=0.000);CD138蛋白表达水平逐渐升高,并持续至72 h。磷脂酰肌醇聚糖mRNA表达水平逐渐上升,在72 h上调2.47倍(U=9.404,P=0.011);磷脂酰肌醇聚糖蛋白表达水平在12 h出现上调,并持续升高至72 h。CD44 mRNA表达水平在12 h达到最高值,随后逐渐下降,但差异并无统计学意义(U=2.389,P=0.134);CD44蛋白表达水平在24 h达到最高峰。
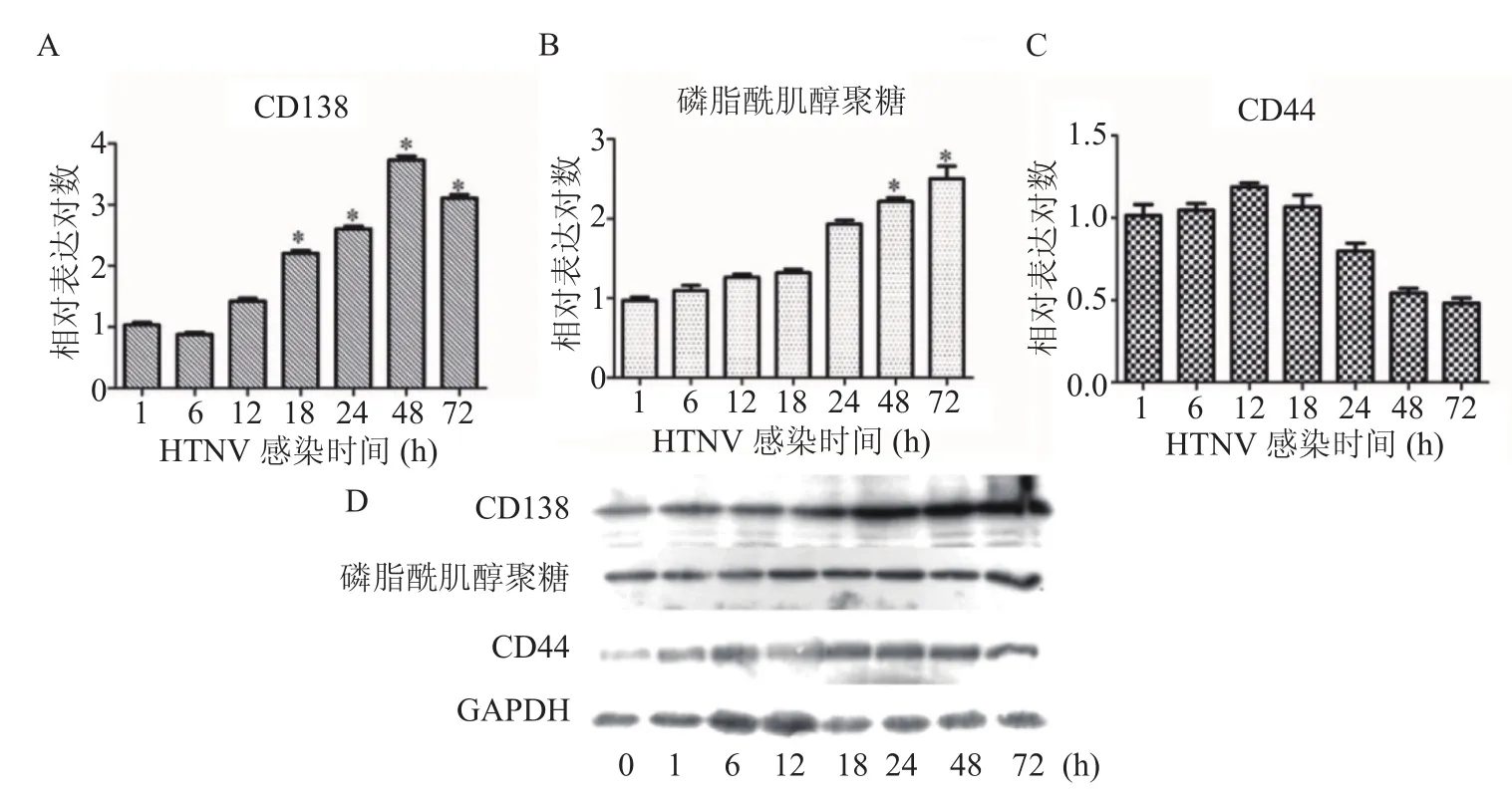
图2 不同时间点HUVEC细胞中GCX表达变化*.与1 h比较,P<0.05Figure 2 Change of expression of glycocalyx in HUVECs at different time points
2.3 HTNV感染HUVECs后麦胚凝集素(wheat germ agglutinin,WGA)的分布 利用间接免疫荧光法观察HTNV感染HUVECs 48 h后,WGA的细胞分布。WGA能与N-乙酰糖胺结合,可识别糖蛋白和糖肽中,特别是细胞膜中复杂的碳水化合物结构。由于HS、HA和CS均属糖蛋白,因此用FITC标记的WGA染色细胞,其结果反映了细胞膜上总的糖蛋白分布。结果如图3所示,与未处理组相比,HTNV感染后细胞上绿色荧光减少。
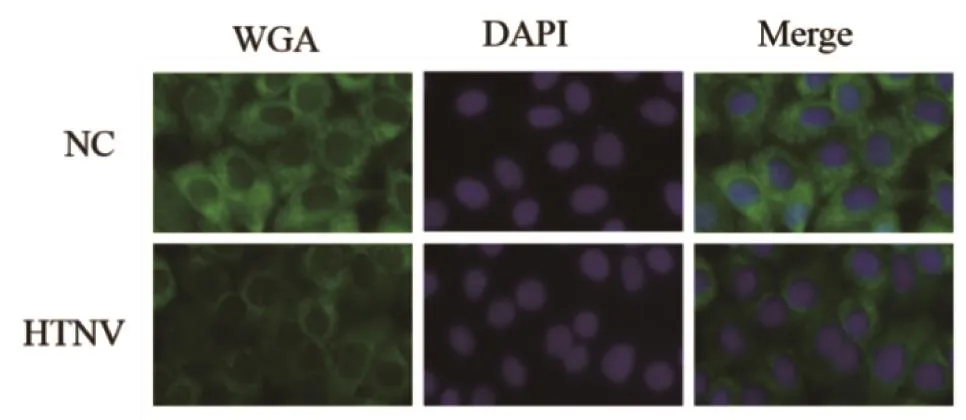
图3 HTNV感染HUVECs后WGA分布NC.正常对照;Merge.WGA与DAPI染色合并处理Figure 3 WGA distribution in HUVECs after HTNV infection
2.4 HTNV感染HUVECs后乙酰肝素酶、透明质酸酶和中性粒细胞弹性蛋白酶的表达 利用实时定量PCR和Western blot检测HTNV感染不同时间点乙酰肝素酶、透明质酸酶和中性粒细胞弹性蛋白酶的表达,结果如图4所示。随着感染时间的持续,乙酰肝素酶mRNA表达水平在48 h上调2.23倍(U=9.782,P=0.002);蛋白表达水平先上升后下降,在24 h达到最高峰。中性粒细胞弹性蛋白酶mRNA表达水平逐渐上升,在24 h上调2.76倍(U=18.870,P=0.000);蛋白表达水平同样在24 h显著性上调。透明质酸酶mRNA表达水平逐渐上升,但差异无统计学意义(U=2.076,P=0.106)。

图4 HTNV感染HUVECs后分解酶的变化*.与1 h比较,P<0.05Figure 4 Changes of decomposition enzymes in HUVECs after HTNV infection
2.5 弹性蛋白酶抑制剂处理HUVECs Western blot结果显示,随着弹性蛋白酶抑制剂浓度的升高,中性粒细胞弹性蛋白酶的蛋白表达水平逐渐下降(图5A)。选取抑制剂最佳处理浓度(1 μM)预处理HUVECs,联合HTNV感染,结果发现在HTNV感染24 h和48 h时,CD44的蛋白表达水平均低于HTNV组(图5B)。TEER检测结果显示,HTNV处理HUVECs后TEER值逐渐下降;在给予弹性蛋白酶抑制剂(1 μM)预处理后,TEER值上升(图5C)。
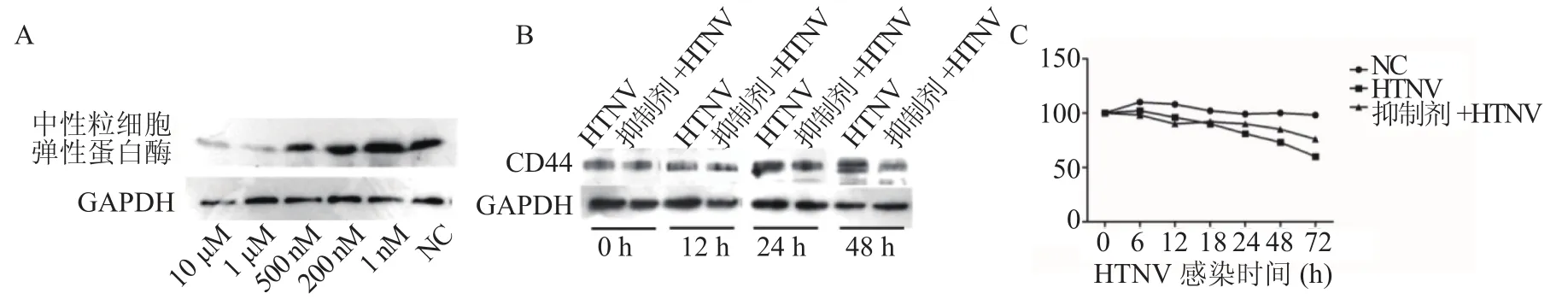
图5 弹性蛋白酶抑制剂处理HUVECs后CD44和通透性的变化Figure 5 Changes of CD44 and permeability in HUVECs after elastase inhibitor treatment
3 讨 论
GCX主要由蛋白聚糖(proteoglycans,PGs)及其与氨基葡聚糖(glycosaminoglycans,GAG)共价键结合的复合体构成。PGs的核心蛋白主要是多配体蛋白聚糖(syndecans,其中syndecan-1即为CD138)和磷脂酰肌醇聚糖。GAG的主要成分包括HS、CS和HA[5]。HA可与细胞表面受体CD44结合,保持亲水特性,起到稳定GCX结构的作用。有研究认为,GCX在微血管生理,尤其是在调节血管内皮通透性、血管紧张度及凝血方面起到重要作用[6]。目前,针对病毒感染诱导GCX损伤的相关研究较少,包括艾滋病患者接受抗病毒治疗过程中出现肾脏血管内皮GCX破坏继而引发肾功能不全[7]、登革热患者血清中HA和HS水平变化与疾病严重程度相关[8]、登革病毒(dengue virus,DENV)NS1蛋白通过MIF1引起GCX降解的基础研究等。但是至今尚未查阅到关于HTNV诱导血管内皮细胞GCX损伤的基础研究报道。
本研究观察到,HTNV感染HUVECs后,随着时间的延长,细胞上清液中HA、HS、CS、可溶性CD138和磷脂酰肌醇聚糖的水平均有升高,表明HTNV感染或LPS、VEGF、TNF-α处理HUVECs后均可出现GCX破坏。这与Glasner等[9]的研究结果相似,DENV非结核蛋白NS1通过破坏内皮细胞GCX,诱导人肺血管内皮细胞(DENV主要感染的靶细胞)的高透通性。本课题组前期研究显示,不同分型及分期HFRS患者外周血可溶性CD138水平出现明显变化,可溶性CD138可作为重症HFRS早期预警及预后评估的标志物[10]。Steppan等[11]研究发现,循环中syndecan-1(可溶性CD138)水平与脓毒症患者预后密切相关,与对照组相比,脓毒症及手术组患者血清syndecan-1表达显著升高;脓毒症患者syndecan-1较手术组表达更高;脓毒症和手术组syndecan-1与IL-6之间存在很强的相关性。也有研究显示,脓毒性休克患者外周血HS碎片表达水平明显升高[12]。这提示HTNV感染引起的GCX脱落,可作为内皮损伤的靶向标志物。
本研究还观察到,GCX骨架中的两个主要成分(CD138和磷脂酰肌醇聚糖)及HA的主要膜受体CD44 mRNA和蛋白表达在HTNV感染HUVECs 后均出现升高,其中,CD44的表达上调同细胞上清中HA的表达趋势一致。究其原因可能与HTNV感染引起GCX主要骨架成分CD138和磷脂酰肌醇聚糖表达上调,随后伴随骨架断裂破坏,导致游离的可溶性CD138和磷脂酰肌醇聚糖水平升高有关。此外,由CD138和磷脂酰肌醇聚糖侧链结合的GAG组分(HS、CS等)可能同步出现脱落,使HS、CS的水平也升高。
目前认为,诸多因素如感染、低氧、炎症因子、高血容量、外伤及心脏大血管手术等均可造成内皮GCX的损伤,除机械或外力因素损伤外,其他损伤机制尚不清楚[13]。寻找切割GCX组分的特异性脱落酶是探索GCX损伤机制的一个关注点。有研究发现,乙酰肝素酶可从细胞膜表面蛋白如磷脂酰肌醇聚糖切割HS侧链,释放HS。透明质酸酶可水解HA中的β-N-乙酰氨基已糖糖苷键,释放HA[14]。本研究显示,HTNV感染HUVECs后,乙酰肝素酶、透明质酸酶、中性粒细胞弹性蛋白酶在蛋白及mRNA表达水平均有升高,其与细胞上清液中HS、HA和可溶性CD138水平变化基本一致,提示HTNV感染HUVECs后,可能通过上调或活化上述3种酶,致GCX组分酶解、脱落,从而引起HS、CS、HA、CD138等成分水平升高。一些出血热病毒,如DENV、埃博拉病毒可能也伴随内皮细胞GCX的损伤[9,15-17]。亦有研究认为,汉坦病毒和DENV感染可引起基质金属蛋白酶的活化,后者可能参与syndecans的脱落[18]。通过本研究结果,我们认为:包括HTNV在内的多种出血热病毒感染可能通过活化或上调多种脱落酶,降解GCX,致细胞屏障破坏,这为深入探讨HTNV感染致血管内皮细胞GCX损伤及通透性改变提供了重要资料,抑制切割GCX组分的特异性酶可能作为临床治疗严重血管渗漏的一个重要潜在靶点。
为进一步验证脱落酶可能参与HTNV感染致HUVECs中GCX损伤,本研究选取了中性粒细胞弹性蛋白酶为代表,应用弹性蛋白酶抑制剂预处理HUVECs,然后用HTNV感染,观察细胞通透性变化及弹性蛋白酶作用下CD44蛋白的表达有无变化。结果显示,经弹性蛋白酶抑制剂预处理的HUVECs,其TEER值上升,CD44蛋白表达也低于HTNV组,提示弹性蛋白酶抑制剂可能降低血管通透性。其原因可能是通过抑制中性粒细胞弹性蛋白酶的表达或活性,减少其对CD44的分解,增加HA与CD44的胞膜结合,进而减少HA的脱落,保护了GCX结构的完整性。
本研究仍存在一定的局限性。首先,受实验条件限制,在细胞层面,研究中纳入的样本数较少,缺少必要的样本重复,在一定程度上降低了统计学效力;此外,本研究仍为初步研究,不排除研究结果受多种混杂与偏倚因素的影响。后续将进一步扩大样本量,增加重复实验,对上述结果行进一步验证。
综上所述,HTNV感染可能引起血管内皮细胞GCX损伤,通过上调或活化某些脱落酶,酶解GCX,致屏障结构破坏,通透性升高,这为阐明HTNV感染致血管内皮细胞损伤的分子机制提供了更多理论依据。

