脑型疟小鼠小胶质细胞的活化特征分析
沈 燕,李英辉,王 军,梁 姣,黄豫晓,朱卿昊,吴兴安,赵 亚
脑型疟是非洲等恶性疟流行区儿童以及我国输入性疟疾病例死亡的常见原因[1-2],其发病机制与免疫细胞在脑部聚集引起中枢神经系统(central nervous system,CNS)炎症性病理损伤密切相关[3-4]。研究发现,小胶质细胞是一类组织定居巨噬细胞,其活化方式直接决定其神经保护/损伤作用[5-7]。目前研究认为,小胶质细胞是单核细胞在胚胎发育早期迁入脑内分化而成的巨噬细胞,因其形态或表面标志物缺乏特异性,所以难以将其与外周巨噬细胞有效区分[8-10]。本研究拟根据小胶质细胞CNS定居的特点,结合实验型脑型疟(experimental cerebral malaria,ECM)小鼠病程动态变化规律,利用血脑屏障(blood brain barrier,BBB)作用从空间上将小胶质细胞和外周巨噬细胞区分,通过ECM小鼠炎性相关分子表达量改变筛选活化标志物;通过比较感染后不同时间点脑内小胶质细胞的表达谱,寻找脑型疟小胶质细胞活化的分子标志,为研究小胶质细胞在脑型疟颅内炎症反应中的作用提供新的思路和方法。
1 材料与方法
1.1 材料 伯氏疟原虫ANKA株(Plasmodium berghei ANKA strain,PbA)为本实验室保存虫种。C57BL/6小鼠购于空军军医大学实验动物中心。伊文思兰(Evans blue,EB)试剂和Giemsa染液购于碧云天生物技术公司。甲酰胺试剂购于默克公司。RPMI1640培养基购于Hyclone公司。RNA提取试剂RNAiso Plus、反转录试剂盒PrimeScript RT Master Mix kit和实时荧光定量PCR(real time quantitative PCR,RT-qPCR)荧光试剂购于TaKaRa公司。Percoll试剂购于GE公司。流式抗体FITC标记的CD11b和PE标记的CD45购于达科为生物技术公司。荧光染色抗体CD45、BrdU、IBA-1分别购于Abcam公司、CST公司和赛维尔生物科技公司。Cy2标记的绵羊抗小鼠IgG、罗丹明红标记的山羊抗兔IgG购于Jackson公司。荧光抗淬灭剂购于Invitrigen公司。
1.2 ECM小鼠模型 ECM模型为经典的PbA感染C57BL/6小鼠。原虫感染率经由鼠尾取血、薄血膜涂片、Giemsa染色后计数确定。根据红细胞计数和原虫感染率计算受感染的红细胞(infected RBCs,iRBCs)数量。不同感染时间点分别选取3只4~6周龄C57BL/6雄性小鼠,体质量16~18 g,每只小鼠经腹腔注射5×106个iRBCs。
1.3 mRNA提取和RT-qPCR检测 小鼠麻醉后固定,生理盐水经心脏灌注,取脑组织,机械剥离嗅球、大脑、小脑、脑干和延髓各区。各脑区组织的RNA提取和反转录分别使用RNAiso Plus法和PrimeScript RT Master Mix kit法。扩增引物由上海生工技术服务有限公司合成,其序列如表1所示,其中β-actin为内参。RT-qPCR检测使用2步法扩增,结果分析采用delta-delta CT法。

表1 基因引物序列Table 1 Genetic primer sequences
1.4 BBB通透性检测 采用EB渗出法检测BBB完整性,小鼠经腹腔注射100 μl 1% EB/PBS缓冲液,12 h后,小鼠经麻醉、心脏灌注后取脑组织,称重;每克脑组织加入1 ml甲酰胺溶液,37 ℃水浴孵育过夜。取孵育液上清200 μl,使用酶标仪(伯乐公司)于620 nm处测量吸光度,根据标准曲线计算EB浓度,以每克脑组织含EB量(μg)表示。
1.5 小胶质细胞提取 根据Garcia等[11]报道的方法提取脑组织小胶质细胞,小鼠经麻醉、心脏灌注后取全脑组织;将脑组织置于冰上,研磨后加入2 ml RPMI1640培养基,用5 ml注射器反复抽吸使脑组织呈匀浆状,加入5 ml RPMI1640培养基和3 ml Percoll溶液轻柔混匀;将30% Percoll/细胞悬液沿管壁小心加入含有2 ml 70% Percoll/Hank's平衡盐缓冲液(Hank's balanced salt solution,HBSS)的15 ml EP管内,保持液面分层;低温550×g离心30 min;用巴氏吸管收集液层分界处细胞,用8 ml HBSS洗涤。4 ℃ 900×g离心7 min,弃上清;用含1% BSA的FACS缓冲液重悬细胞,4 ℃保存待用;每个脑组织可获得细胞总数约为(1~5)×104个。
1.6 细胞染色及流式细胞检测 将流式抗体FITC标记的CD11b和/或PE标记的CD45加入细胞悬液,4 ℃避光孵育20 min,PBS洗涤后用40 μl FACS缓冲液重悬,采用流式细胞仪(BD公司)进行检测分析,其中裸细胞组和单染色对照组调整补偿,每个样本检测不少于104个细胞。
1.7 脑组织切片间接免疫荧光和HE染色 小鼠经麻醉灌注后取脑组织,4%多聚甲醛固定过夜;经脱水、透明、包埋后切片。荧光染色切片依次经过二甲苯、梯度酒精再水化、抗原修复、封闭;一抗4 ℃孵育过夜;洗涤后,二抗孵育1 h,抗淬灭剂封片。HE染色切片依次经过二甲苯、梯度酒精再水化、HE染色、脱水封片。显微镜下采集图像。
1.8 统计学处理 采用GraphPad Prism软件处理和分析数据。2组间比较用成组t检验(各组计量数据均呈正态分布,组间方差齐),P<0.05为差异有统计学意义。
2 结 果
2.1 ECM小鼠脑内炎症水平 不同脑区的脑组织mRNA转录水平检测表明,与未感染小鼠相比,PbA感染小鼠后第5 d,TNF-α在大脑内的mRNA转录水平上调7.65倍(t=6.034,P=0.009);同时,IL-6在嗅球内的mRNA转录水平上调4.54倍(t=3.361,P=0.044)。Fizz1在小脑内的mRNA转录水平分别于感染后第3 d和第5 d下调85.12%(t=12.175,P=0.001)和93.44%(t=72.322,P=0.000),在脑干和延髓分别下调54.39%(t=3.908,P=0.030)和83.99%(t=14.326,P=0.000)(图1)。

图1 ECM小鼠脑内炎症因子mRNA水平A~C 纵坐标数字均为以2为底的对数;A.不同感染时间点,各脑区TNF-α的mRNA转录水平;B.不同感染时间点,各脑区IL-6的mRNA转录水平;C.不同感染时间点,各脑区Fizz1的mRNA转录水平;*.P<0.05;**.P<0.01;***.P<0.001Figure 1 mRNA levels of inflammatory cytokines in the brain of ECM mice
2.2 ECM小鼠脑内小胶质细胞水平 流式细胞技术对脑内提取小胶质细胞的检测结果表明,与未感染小鼠相比,PbA感染小鼠后第5 d,CD11b+细胞的占比和数量分别上调8.02倍(t=3.818,P=0.012)和9.07倍(t=3.851,P=0.012);感染后第6 d,分别上调4.36倍(t=5.412,P=0.003)和4.51倍(t=6.161,P=0.002);感染后第7 d,分别上调3.41倍(t=2.867,P=0.035)和6.87倍(t=2.734,P=0.034)(图2A、2B)。通过间接免疫荧光染色对小鼠脑组织切片检测发现,PbA感染后第5 d的大脑内可见IBA-1+细胞(图2C)。
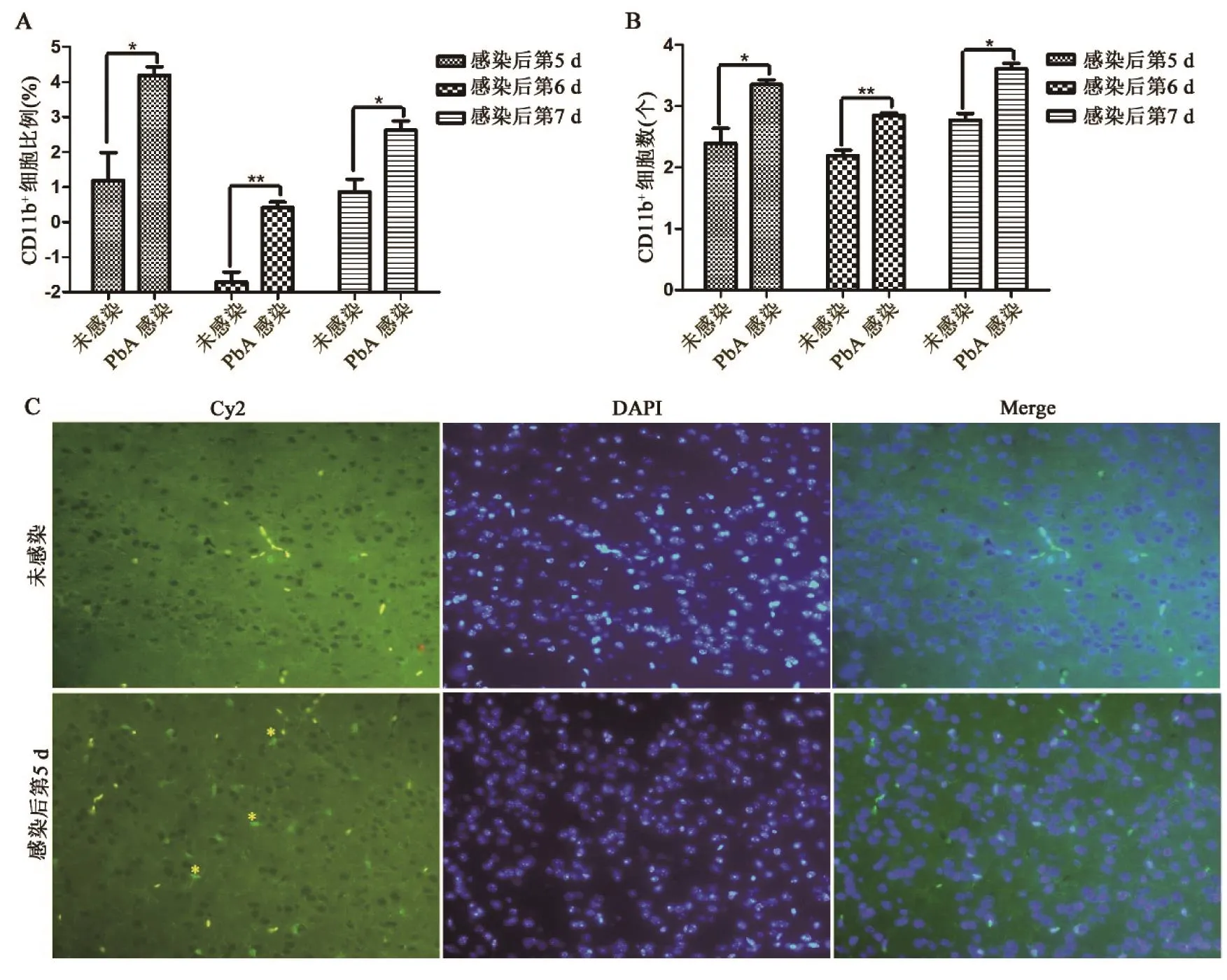
图2 ECM小鼠脑内小胶质细胞检测A.不同感染时间点,小胶质细胞中CD11b+细胞比例,纵坐标数字为以2为底的对数;B.不同感染时间点,小胶质细胞中CD11b+细胞数量,纵坐标数字为以10为底的对数;C.PbA感染后第5 d,间接免疫荧光法检测脑内表达IBA-1的细胞(星号);Cy2.绿色荧光染料;DAPI.蓝色细胞核染料;Merge.Cy2 染料和DAPI 染料的融合;*.P<0.05;**.P<0.01Figure 2 Detection of microglia in brain of ECM mice
2.3 ECM小鼠 BBB开放时间 利用EB渗出法对BBB通透性的检测发现,与未感染小鼠相比,PbA感染小鼠后第6 d和第7 d,每克脑组织溶出的EB量分别上调4.30倍(t=94.727,P=0.021)和4.54倍(t=109.507,P=0.018)(图3A)。PbA感染小鼠后第7 d,可见EB在脑内大量浸出,全脑呈现蓝色,而未感染小鼠全脑未见EB浸出,也未呈蓝色(图3B)。通过HE染色对小鼠脑组织切片检测发现,PbA感染后第7 d,脑内可见散在出血点以及浸润的RBC(图3C)。

图3 ECM小鼠BBB开放时间A.不同感染时间点,脑内EB浸出量;B.PbA感染后第7 d,脑组织EB渗出图;C.PbA感染后第7 d,脑组织切片HE染色图;*.P<0.05Figure 3 BBB opening time in ECM mice
2.4 脑内巨噬细胞相关因子水平 脑组织mRNA转录水平检测结果表明,与未感染小鼠相比,PbA感染小鼠后第5 d,CD45的mRNA转录水平在大脑(t=4.672,P=0.019)、小脑(t=10.485,P=0.002)、脑干和延髓(t=4.232,P=0.024)均上调(图4A);同时,CCR2的mRNA转录水平在大脑(t=17.519,P=0.000)、小脑(t=3.780,P=0.032)上调(图4B),CCL2(CCR2的配体)的mRNA转录水平在小脑(t=11.239,P=0.002)、脑干和延髓(t=5.164,P=0.014)、嗅球(t=4.519,P=0.020)均上调(图4C)。但小胶质细胞标志物 TMEM119[12]、P2Y12[13]、Siglec-H[14]的 mRNA转录水平变化差异均无统计学意义(结果未展示)。流式细胞技术对小胶质细胞的检测结果发现,与未感染小鼠相比,CD45+细胞占比分别在感染后第5 d(t=4.042,P=0.009)、第6 d(t=7.147,P=0.000)和第 7 d(t=2.504,P=0.046)上调(图4D),同时CD45+细胞数量分别在感染后第5 d(t=4.016,P=0.010)、第6 d(t=6.900,P=0.000)、第7 d(t=2.780,P=0.032)增多(图4E)。通过间接免疫荧光染色对小鼠脑组织切片检测发现,PbA感染后第7 d,脑内可见IBA-1与CD45共表达细胞(图4F)。
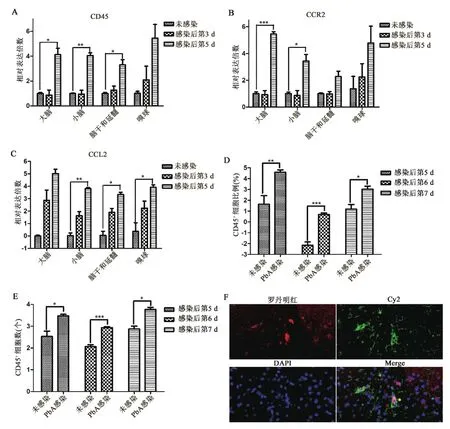
图4 ECM小鼠脑内巨噬细胞相关因子的检测A.不同感染时间点,各脑区CD45的mRNA转录水平;B.不同感染时间点,各脑区CCR2的mRNA转录水平;C.不同感染时间点,各脑区CCL2的mRNA转录水平,纵坐标数字为以2为底的对数;D.不同感染时间点,CD45+细胞比例,纵坐标数字为以2为底的对数;E.不同感染时间点,CD45+细胞数量,纵坐标数字为以10为底的对数;F.PbA感染后第7 d,间接免疫荧光法检测脑内IBA-1和CD45共表达的细胞(星号);Cy2.绿色荧光染料标记IBA-1;罗丹明红.红色荧光染料标记CD45;DAPI.蓝色细胞核染料;Merge.Cy2、罗丹明红和DAPI 染料的融合;*.P<0.05;**.P<0.01;***.P<0.001Figure 4 Detection of macrophage related factors in brain of ECM mice
2.5 CD45表达量与小胶质细胞活化的相关性 对流式细胞技术检测结果的进一步分析发现,CD11b+细胞根据CD45表达量的不同可分为两群:CD11b+CD45high和CD11b+CD45int,与未感染小鼠相比,CD11b+CD45int亚群细胞数在感染后第 5 d(t=5.822,P=0.002) 和 第 7 d(t=3.492,P=0.013)增多;CD11b+CD45high亚群细胞数目分别在感染后第5 d(t=2.689,P=0.043)和第6 d(t=4.683,P=0.005)增多(图5A)。不同的是,CD11b+CD45high的细胞占比在感染后第5 d(t=3.330,P=0.021) 下 调 而 第 7 d(t=2.674,P=0.037)上调,CD11b+CD45int的细胞占比在感染后第5 d(t=3.850,P=0.012)上调而第7 d(t=2.696,P=0.036)下调(图5B)。免疫荧光染色对小鼠脑组织切片检测发现,可观察到CD45和BrdU双阳性细胞,并且可见iRBCs(图5C)。
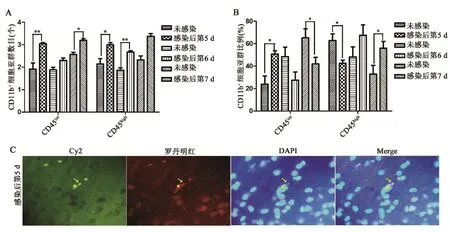
图5 CD45表达量与小胶质细胞活化的相关性A.不同感染时间点,小胶质细胞中CD11b+CD45high和CD11b+CD45int的细胞数量,纵坐标数字为以10为底的对数;B.不同感染时间点,CD11b+CD45high和CD11b+CD45int的细胞比例;C.PbA感染后第5 d,间接免疫荧光法检测脑内CD45和BrdU双阳性细胞(星号);Cy2.绿色荧光染料标记BrdU;罗丹明红.红色荧光染料标记CD45;DAPI.蓝色细胞核染料;Merge.Cy2、罗丹明红和DAPI 染料的融合;iRBC(箭头所指);*.P<0.05;**.P<0.01Figure 5 Correlation between CD45 expression level and activation of microglia cells
3 讨 论
小胶质细胞是在脑组织定居的一类巨噬细胞,在多发硬化症等神经系统疾病中,参与炎症发生、脱髓鞘、神经细胞损伤等病理过程[15],但其在脑型疟神经病理损伤中的作用至今尚未阐明。多数研究利用IBA-1作为小胶质细胞标志物[16],当BBB保持完整时脑内IBA-1阳性细胞可认为是小胶质细胞,然而一旦BBB开放IBA-1就难以区别小胶质细胞和外周巨噬细胞。研究表明,脑型疟的发生与BBB损伤密切相关,疟原虫特异性CD8+T细胞通过ECM的病理过程可迁移到脑血管,进而杀伤内皮细胞[17],启动BBB外侧炎症损伤;而在BBB内侧,小胶质细胞则可能是发挥主要作用的炎性细胞。基于脑型疟BBB开放这一重要病理变化,本研究利用BBB物理区隔小胶质细胞和外周巨噬细胞,为研究小胶质细胞在脑型疟中的作用提供可行的思路。
本研究发现,PbA感染后第5 d,促炎因子TNF-α和IL-6的转录水平在不同脑区发生一定程度上调,而抑炎因子Fizz1的转录水平则下调。EB渗出实验证实,BBB 显著开放出现在PbA感染后第6 d,说明脑内炎症水平在BBB开放前已经发生改变。此外,小胶质细胞是脑内仅有且数量丰富的固有免疫细胞,极有可能通过发挥巨噬细胞炎性功能参与脑内炎症发生。感染后不同时间点提取脑内小胶质细胞分析结果也表明,与未感染小鼠相比,CD11b+细胞比例和数量均显著上调,提示小胶质细胞确实参与脑型疟发生。此外,本研究对已报道的小胶质细胞标志物脑内转录水平的检测也提示,不同神经系统疾病模型中小胶质细胞的表达标志物可能存在差异,与相关研究结果一致[18-19]。
本研究对巨噬细胞标志分子CD45、巨噬细胞M1型活化相关因子CCR2及配体CCL2进行了检测,结果发现感染后第5 d,上述这些分子转录水平有一定程度上调,提示PbA感染可触发小胶质细胞的活化。流式细胞技术分析也证实,感染后第5、6、7 d,小胶质细胞中的CD45+细胞比例和数量均显著上调,提示CD45可能与小胶质细胞的活化相关。进一步分析发现,脑内CD11b+细胞可根据CD45表达量差异分为CD11b+CD45high和CD11b+CD45int两群,且在BBB明显开放前即PbA感染后第5 d,两群细胞的数目均显著增多,提示静息态和活化态小胶质细胞数目均随感染上调。以往研究认为小胶质细胞CD45的表达水平低于外周巨噬细胞[20],但近期研究也发现,小胶质细胞活化后CD45表达上调[21]。本研究发现CD11b+CD45high细胞亚群占比在感染后第5 d下调而第7 d上调,与此同时CD11b+CD45int细胞亚群占比则发生相反的变化,提示随着感染进程持续小胶质细胞逐渐由静息态向活化态转变,其CD45的表达量随之上调,进一步说明CD45的表达很可能与小胶质细胞的活化相关。部分研究显示,脑缺血模型中脑损伤区域的小胶质细胞可通过快速增殖加重炎症反应[22],本研究通过BrdU免疫荧光染色也可见到小胶质细胞增殖的现象。
值的注意的是,EB作为偶氮染料,可随血浆白蛋白从BBB开放区进入脑实质区,因此,EB渗出时已是BBB内皮细胞紧密连接被完全破坏的阶段。然而,在BBB紊乱的较早期且内皮细胞紧密连接完全破坏之前,EB是不能进入脑内的,此时是否存在巨噬细胞主动穿越BBB的可能尚不能确定。
综上所述,小胶质细胞参与了脑型疟脑部炎症反应,且通过BBB天然屏障作用与外周巨噬细胞物理区隔,在BBB开放前脑内炎症水平上调,小胶质细胞活化与上调CD45表达量相关,以上结果将为深入研究小胶质细胞在脑型疟CNS病理损伤的作用提供更多的研究思路。

