MicroRNA-582-5p在HBV感染中的作用及分子机制研究
代晓朋,宋 兵,牛霄英,焦艳梅,陶维光,吴逢英,盖丽娜,崔 澂
HBV感染是人类最常见的慢性传染病,是全球性的公共卫生问题。目前全世界范围内大约有2.92亿HBV携带者,每年有近90万人死于HBV相关的并发症[1]。HBV感染是慢性肝炎、肝硬化和肝细胞癌的关键危险因素,HBV在宿主体内复制和表达是HBV相关并发症的主要原因。HBV与宿主之间存在复杂的相互作用,深入了解HBV在宿主体内的复制和表达的分子机制,有利于进一步阐明HBV致病机制并为抗HBV药物研发和改进提供新的思路。
微小RNAs(microRNAs,miRNAs)是病毒与宿主相互作用的一类新的调控分子[2-3]。miRNAs是由19~23个核苷酸组成的小的非编码RNA,通过与目标转录本的3´非编码区(untraslated regions,UTR)配对,抑制mRNA翻译和/或降解mRNA,在基因表达调控中发挥重要作用[4]。miRNAs与HBV之间存在着多方面的相互作用。一方面,HBV调节宿主细胞miRNAs的表达,增强自身复制能力,逃避免疫系统监视,从而使病毒在受感染的肝细胞中持续增殖[5];另一方面,宿主miRNAs能调控HBV的复制和表达,miRNAs可以通过与HBV转录本直接结合影响HBV复制,也可以通过靶向与HBV生命周期相关的转录因子间接影响HBV复制[6]。此外,miRNAs还参与调节信号转导通路中的相关基因,在HBV致病中发挥重要作用。
前期为了探索miRNAs在 HBV复制中的作用及分子机制,分别以HepG2、HepG2.2.15、HepAd38作为无 HBV复制细胞模型、HBV低复制细胞模型、HBV高复制细胞模型,进行miRNAs芯片检测,分析3种细胞模型miRNAs表达谱,发现miRNA-582-5p (miR-582-5p)表达水平与HBV复制水平呈负相关[7]。本研究以miR-582-5p为研究对象,探究其在HBV复制和表达中的作用及其调控机制。具体报道如下。
1 材料和方法
1.1 材料 Huh7、HepG2、HepG2.2.15、HepAd38细胞系由研究室留存。pGL3-S1 promoter、pGL3-S2 promoter、pGL3-Core promoter、pGL3-EnhancerⅠ等报告基因质粒,pcDNA3.1-HBx、pcDNA3.1-HBP、pcDNA3.1-HBLS、pcDNA3.1-HBP等HBV蛋白表达质粒由本研究室留存[6]。miR-582-5p mimics、miR-582-5p inhibitor及其无关序列阴性对照(negative control,NC)购自上海吉玛制药技术有限公司;RPMI Medium 1640 basic、DMEM basic、胎牛血清、Lipofectamine 2000、TRIzol Reagent(invitrogen)购自上海立菲生物技术有限公司;rTaq DNA聚合酶、dNTP 等购自TaKaRa公司;HBsAg诊断试剂盒、HBeAg检测试剂盒购自北京万泰生物药业股份有限公司; HBV核酸定量检测试剂盒(PCR-荧光探针法)购自凯杰生物工程(深圳)有限公司;GoScript Reverse Transcription System反转录试剂盒、Go Taq qPCR Master Mix定量检测试剂盒购自Promega公司。质粒提取试剂盒、琼脂糖凝胶回收试剂盒等购自北京全式金生物技术有限公司。
1.2 方法
1.2.1 细胞培养和转染 含10%胎牛血清、2 mmol/L L-谷氨酰胺、100 U/ml青霉素和100 mg/ml链霉素的DMEM培养基培养HepG2、Huh7。含380 μg/ml G418的RPMI 1640培养基培养 HepG2.2.15、HepAD38。细胞在含 5%CO2的37 ℃孵箱中进行培养。用胰酶消化细胞,计数后铺板,待细胞生长到90%~95%融合度时使用Lipofectamine 2000 按照说明书进行转染。
1.2.2 实时定量PCR(quantitative real-time PCR,qRT-PCR)检测miRNA、mRNA和HBV DNA 用TRIzol Reagent(invitrogen)按说明书提取细胞内总RNA。根据GoScript Reverse Transcription System反转录试剂盒说明书,取1 μg总RNA反转录为cDNA,然后根据Go Taq qPCR Master Mix定量检测试剂盒说明书,取2 μl反转录的cDNA,分别以U6 snRNA和β-actin为miRNA和mRNA检测内参,检测miR-582-5p、HBV mRNA和NOTCH1 mRNA表达水平(反转录及定量检测引物见表1)。定量PCR 仪上反应程序:95 ℃,2 min; 95 ℃,15 s,60 ℃,60 s,40循环;熔解曲线。用2-△△Ct法计算相对表达量[8]。HBV DNA检测按照HBV核酸定量检测试剂盒(PCR-荧光探针法)说明书进行。

表1 引物及序列Table 1 Primers and sequences
1.2.3 ELISA检测HBsAg和HBeAg 根据HBsAg诊断试剂盒、HBeAg检测试剂盒操作说明书进行操作。
1.2.4 Western blot检测蛋白表达 收集细胞,加入预冷RIPA裂解缓冲液处理10~20 min以裂解细胞,离心去除细胞碎片,加入上样缓冲液煮沸10 min后上样。在SDS-PAGE中进行电泳,电泳结束后使用半干法将蛋白质转移到PVDF膜上。TBST洗膜液漂洗,5%的牛奶封闭1 h。将NOTCH1一抗稀释(1∶500稀释)后室温下轻摇孵育1 h,4 ℃静置过夜。洗涤后与辣根过氧化物酶偶联的山羊抗兔IgG二抗室温孵育1 h。二抗孵育结束后洗膜液清洗5次,用增强化学发光法显色。
1.2.5 靶基因预测 本研究中使用3个网站进行 miR-582-5p靶 基 因 预 测:TargetScan (http://www.targetscan.org/)、Pictar(http://pictar.bio.nqyu.edu/)和 MiRanda (http://microrna.sanger.ac.uk/)。
1.2.6 双荧光素酶报告基因检测 双荧光素酶报告基因分析系统检测荧光素酶活性。将基因表达质粒、报告基因质粒和内参质粒组合后转染Huh7细胞,48 h后收集细胞,加入Passive Lysis Buffer裂解细胞,离心去除细胞碎片。用双荧光素酶报告基因检测试剂盒(Promega)进行报告基因检测。RLU1为萤火虫荧光素酶反应强度,RLU2为内参海肾荧光素酶反应强度,计算Ratio=RLU1/RLU2。
1.3 统计学处理 每个实验至少重复3次,应用GraphPad Prism 8软件进行统计分析。正态分布的计量数据用±s表示。2组荧光素酶相对活性、mRNA和miRNA表达水平的比较采用成组t检验,多组数据的比较采用单因素方差分析,进一步两两比较用LSD-t检验。P<0.05表示差异具有统计学意义。
2 结 果
2.1 miR-582-5p对HBV复制和表达的影响
2.1.1 过表达miR-582-5p抑制HBV复制和表达 本研究室之前通过miRNAs芯片检测HepG2、HepG2.2.15、HepAd38 3种细胞miRNAs表达谱,发现miR-582-5p表达水平随着HBV复制水平升高而降低。进一步通过qRT-PCR验证HepG2、HepG2.2.15、HepAd38 3种细胞miR-582-5p的表达水平,结果如图1A所示,与芯片结果一致,随着HBV表达水平升高,miR-582-5p的表达逐渐降低,提示miR-582-5p可能参与HBV的复制和表达。
首先分析过表达miR-582-5p对HBV复制和表达的影响。将miR-582-5p mimics与pHBV1.2共同转染Huh7细胞,qRT-PCR检测细胞上清HBV DNA,结果如图1B所示,miR-582-5p使细胞分泌到上清中的HBV DNA水平降低,提示miR-582-5p表达抑制了HBV复制;qRT-PCR检测细胞内HBV RNA,结果如图1C所示,miR-582-5p使细胞内HBV RNA水平降低,提示miR-582-5p表达抑制了HBV转录;ELISA法检测细胞上清HBeAg和HBsAg,结果如图1D、E所示,miR-582-5p使细胞分泌到上清中的HBeAg和HBsAg降低,提示miR-582-5p表达抑制了HBV蛋白表达。以上结果表明,miR-582-5p过表达能抑制HBV复制和表达。

图1 过表达miR-582-5p抑制HBV复制和表达A.3种细胞HepG2、HepG2.2.15、HepAd38 miR-582-5p的相对表达量检测(3组两两比较,P均<0.05);B~E.miR-582-5p mimics与pHBV1.2共同转染Huh7细胞,HBV相关指标监测,HBV DNA(B)、HBV RNA(C)、HBeAg(D)、HBsAg(E)Figure 1 Overexpression of miR-582-5p inhibits HBV replication and expression
2.1.2 抑制内源性miR-582-5p表达能促进HBV复制和表达 进一步分析抑制内源性miR-582-5p表达对HBV复制和表达的影响。将miR-582-5p inhibitor与pHBV1.2共同转染Huh7细胞,qRT-PCR检测细胞上清HBV DNA,结果如图2A所示,抑制内源性miR-582-5p表达使细胞分泌到上清中的HBV DNA水平升高,提示抑制内源性miR-582-5p表达促进了HBV复制;qRT-PCR检测细胞内HBV RNA,结果如图2B所示,抑制内源性miR-582-5p表达使细胞内HBV RNA水平升高,提示抑制内源性miR-582-5p表达促进了HBV转录;ELISA法检测细胞上清HBeAg和HBsAg,结果如图2C、D所示,抑制内源性miR-582-5p表达使细胞分泌到上清中的HBeAg和HBsAg水平升高,提示抑制内源性miR-582-5p表达促进了HBV蛋白表达。以上结果表明,抑制内源性miR-582-5p表达能促进HBV复制和表达。
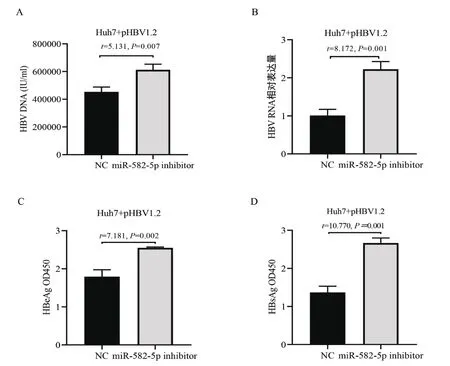
图2 抑制内源性miR-582-5p表达促进HBV复制和表达A~D.miR-582-5p inhibitor与pHBV1.2共同转染Huh7细胞,HBV相关指标监测,HBV DNA(A)、HBV RNA(B)、HBeAg(C)、HBsAg(D)Figure 2 Downregulation of endogenous miR-582-5p expression promotes HBV replication and expression
2.2 miR-582-5p调控HBV表达和复制的分子机制
2.2.1 miR-582-5p抑制HBV启动子和增强子活性 miRNA能通过直接与HBV转录产物相互作用,或者通过靶向HBV生命周期相关的重要细胞因子从而间接调控HBV复制和表达。通过生物信息学分析,排除了miR-582-5p与HBV转录产物的直接结合。当HBV感染肝细胞后,基因组被释放到肝细胞核中,松弛环状DNA转化为共价闭合环状DNA(covalently closed circle,cccDNA),cccDNA合成以及以cccDNA为模板进行的基因转录是HBV复制和表达的重要环节,在这一过程中,HBV启动子与增强子等调控元件发挥重要作用。
分析miR-582-5p对HBV启动子和增强子的影响。将miR-582-5p mimics分别与pGL3-S1 promoter(S1p)、pGL3-S2 promoter(S2p)、pGL3-Core promoter(Cp)、pGL3-EhancerⅠ组合转染 Huh7细胞,双荧光素酶报告基因检测相对活性,结果如图3A所示。miR-582-5p抑制了HBV S2 promoter和HBV EhancerⅠ活性,提示miR-582-5p可能通过抑制HBV S2 promoter和HBV EhancerⅠ的活性从而抑制HBV复制和表达。
2.2.2 miR-582-5p对HBV促进因子NOTCH1的影响 miR-582-5p不能直接靶向HBV转录产物,提示miR-582-5p可能通过靶向抑制HBV复制和表达的正调控分子,从而间接抑制HBV复制与表达。该靶基因分子应满足以下两个条件:①该分子3´UTR能与 miR-582-5p互补配对;②该分子是HBV复制与表达的正调控分子。通过TargetScan,PicTar和MiRanda预测,结合文献调研,发现NOTCH1分子同时满足以上两个条件,结果如图3B所示,miR-582-5p能直接靶向NOTCH1 3´UTR的1558—1564位。
分析miR-582-5p对NOTCH1的影响。首先分析miR-582-5p是否可以直接结合NOTCH1 3´UTR。将 miR-582-5p mimics与 pGL3-NOTCH1 3´UTR组合转染Huh7细胞,双荧光素酶报告基因检测相对活性,结果如图3C所示,miR-582-5p抑制了pGL3-NOTCH1 3´UTR报告基因活性。进一步分析miR-582-5p对NOTCH1复制和表达的影响,将miR-582-5p mimics转染Huh7细胞,qRTPCR检测NOTCH1 mRNA表达,Western blot 检测NOTCH1蛋白表达,检测结果如图3D、E所示,miR-582-5p使NOTCH1 mRNA和蛋白表达水平降低,提示miR-582-5p表达抑制了NOTCH1转录和翻译。以上结果表明,miR-582-5p能直接靶向并抑制NOTCH1表达。

图3 miR-582-5p抑制HBV启动子和增强子活性,并靶向抑制NOTCH1表达A.将miR-582-5p分别与HBV启动子和增强子报告基因载体组合转染Huh7细胞,荧光素酶报告基因检测相对活性;B.miR-582-5p与NOTCH1 3´UTR的1558-1564位直接结合;C.将miR-582-5p与NOTCH1 3´UTR报告基因载体组合转染Huh7细胞,荧光素酶报告基因检测相对活性;D~E.将miR-582-5p转染Huh7细胞,qRT-PCR检测NOTCH1 mRNA表达(D),Western blot检测NOTCH1蛋白表达(E)Figure 3 miR-582-5p inhibits activity of HBV promoter and enhancer and inhibits expression of NOTCH1 by targeting
2.3 HBV复制和表达对miR-582-5p的影响 在支持HBV复制HepG2.2.15和HepAd38细胞中,miR-582-5p表达较不含HBV的HepG2细胞表达低(图1A)。我们进一步分析HBV对miR-582-5p表达的影响。
将pHBV1.2载体转染Huh7细胞,qRT-PCR检测miR-582-5p的表达情况,结果如图4A所示,HBV的复制和表达抑制miR-582-5p的表达。分别将HBV蛋白表达载体转染Huh7细胞,qRT-PCR检测HBV不同蛋白对miR-582-5p的表达情况,结果如图4B所示,HBx抑制miR-582-5p的表达。通过将HBx腺病毒蛋白Ad-HBx感染Huh7细胞,如图4C所示,进一步证明HBx抑制miR-582-5p的表达。以上结果表明,在HBV感染中,HBV的复制与表达,特别是HBx蛋白,能够抑制miR-582-5p的表达。
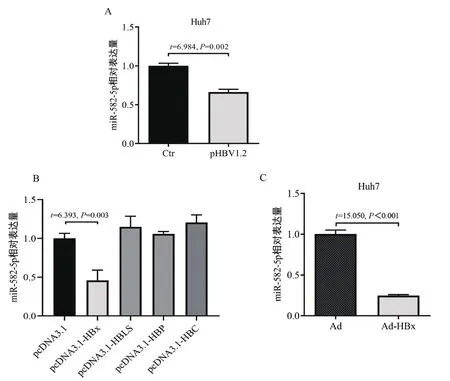
图4 HBV抑制miR-582-5p表达A.将pHBV1.2和空载体(Ctr)分别转染Huh7细胞,qRT-PCR检测miR-582-5p表达;B.将不同HBV蛋白表达载体转染Huh7细胞,qRT-PCR检测miR-582-5p表达;C.将HBx腺病毒表达载体感染Huh7细胞,qRT-PCR检测miR-582-5p表达Figure 4 HBV inhibits miR-582-5p expression
3 讨 论
miRNAs在宿主与HBV的相互作用扮演着重要的角色,可以直接与HBV转录本相互作用,也可以间接调节HBV 转录因子,从而影响HBV复制和表达;HBV的复制和表达也可以影响宿主miRNAs表达。
miRNAs可以直接靶向HBV转录本,抑制病毒复制。研究表明,miR-122直接靶向HBV聚合酶的编码区和HBV核心蛋白的3´UTR从而抑制病毒复制[9],而miR-125a-5p、miR-199a-3p和miR-210则直接靶向HBsAg编码区发挥抑制作用[10-11]。在本研究中,发现miR-582-5p可以抑制HBV DNA、HBV RNA、HBeAg和HBsAg的分泌。然而,通过生物信息学分析发现miR-582-5p与HBV基因组之间没有直接的相互作用位点。因此,我们推测miR-582-5p可能通过调节转录因子而间接影响HBV复制和表达。
miRNAs可通过靶向与病毒复制相关的转录因子来间接调节HBV的复制和表达。研究表明,miR-122对HBV感染发挥双重作用,miR-122通过靶向抑制血红素加氧酶-1促进病毒复制[12],而通过靶向N-myc下游调控基因3来抑制病毒复制[13]。miR-29c通过靶向炎症和免疫的主要调节因子肿瘤坏死因子α诱导蛋白3发挥抑制HBV复制的作用[14]。miR-125b靶向抑制敏感钠离子通道蛋白1α来抑制HBV DNA中间体形成以及HBsAg和HBeAg的分泌[15]。miR-141和miR-155分别通过直接靶向过氧化物酶体增殖物激活受体α[16]和CCAAT/增强子结合蛋白β[17]而间接抑制HBV复制。miR-130a通过靶向HBV转录增强剂过氧化物酶体增殖物激活受体-γ共激活因子-1α和过氧化物酶体增殖物激活受体γ来抑制HBV复制[18]。研究发现miR-582-5p可以通过抑制HBV S2 promoter和HBV EnhancerⅠ的活性而抑制HBV的复制与表达。
此外,本研究发现miR-582-5p可以直接靶向Notch信号通路关键分子NOTCH1。Notch信号通路是一个进化上高度保守的信号转导通路,在肝脏的发育、再生、肝癌和HBV感染中发挥非常重要的作用[19-20]。研究发现,抑制NOTCH1后,HBV DNA、HBV cccDNA和 HBV RNA等HBV复制和表达相关指标受到明显抑制,表明NOTCH1能够促进HBV复制和表达[21]。本研究表明NOTCH1是miR-582-5p靶基因,因此,miR-582-5p可以通过抑制NOTCH1的表达,从而抑制HBV复制与表达。值得关注的是,NOTCH1还是miR-146a、miR-139-5p等miRNAs的靶基因[22-24],提示miRNA与NOTCH1的相互作用在不同疾病和生理状态下的重要作用。
HBV感染能导致宿主miRNAs表达水平发生变化。研究表明,miRNAs可以在损伤后从细胞中泄漏,或者可以从细胞分泌到循环中,这些循环中的miRNAs可以稳定地存在于血清/血浆中,可作为非侵入性生物标志物[25]。研究表明,HBx蛋白可以通过直接与miR-15a/miR-16-1结合的方式降低其表达[26]。HBx蛋白通过诱导miR-205启动子高甲基化来抑制肿瘤抑制基因miR-205表达[27]。据报道,miR-122、miR-22和miR-99a在HBV感染者血清中上调1.5倍,可作为疾病特异性生物标志物[28]。本研究发现HBx蛋白抑制miR-582-5p表达,但是HBx降低体内miR-582-5p表达的分子机制及其临床意义需要更多的研究来进一步阐明。
本研究证明,在肝细胞中,miR-582-5p既可抑制HBV S2 promoter和HBV EnhancerⅠ的活性,又可以靶向抑制HBV促进因子NOTCH1,最终抑制HBV复制和表达;反过来,HBV的复制与表达又能抑制miR-582-5p的表达,表明HBV-miR-582-5p与NOTCH1之间存在复杂的相互作用。由此推测在HBV感染中,HBV可以通过抑制miR-582-5p的表达,解除对HBV促进因子NOTCH1的抑制,从而有助于HBV的复制与表达。病毒诱导miRNAs异常表达和miRNAs可以调节HBV复制和表达,提示miRNAs可能成为治疗HBV感染和HBV相关性肝癌的潜在靶点。深入研究miRNAs在HBV感染中的作用和机制对于探索治疗HBV相关疾病的新策略具有重要意义。
本研究有不足之处。最新的研究表明,miR-582-5p通过降低NOTCH1在非小细胞肺癌中的表达来抑制细胞增殖和侵袭,miR-582-5p是否在HBV相关的肝细胞癌中发挥作用还有待于进一步深入研究[29]。

