综合根系活性及叶片光合速率揭示碳纳米材料对湿地中水生植物的影响
杨祥宇,邓亚宏,石益广,袁小兵,孙志国,何强,陈一,*
1. 重庆大学三峡库区生态环境教育部重点实验室,重庆大学,重庆 400045 2. 国家低碳和绿色建筑国际研究中心,重庆大学,重庆 400045 3. 重庆大学环境与生态学院,重庆 400045 4. 中建三局第二建设工程有限责任公司,武汉 430000
碳纳米材料(carbon nanomaterials, CNMs)因其独特的力学性能、热持久性和化学稳定性而被广泛应用于众多领域,如柔性导电复合材料[1]、合金[2]和混凝土[3]等。随着含有CNMs的商品材料大量合成、使用和处理,CNMs不可避免地被释放到环境中,对生态环境和人体健康造成威胁。污水处理系统作为CNMs进入环境的必经途径,其受影响情况尚未明确。
人工湿地作为生态友好型污水处理系统,具有结构简单、低能耗、维护方便等优点,已经越来越得到水处理行业的认可和推广[4]。由于生物膜特殊的截留能力及纳米颗粒超大的比表面积,虽然人工湿地对常规氮磷污染物有良好的去除效果,但也被认为是纳米级颗粒污染物的重要聚集区[5-6]。湿地植物作为人工湿地重要的组成部分,它们能直接或间接地去除湿地水体中污染物[7],例如吸收同化氮、磷养分,富集重金属,还可有效去除废水中的有机污染物[8]。此外,湿地植物还可以调节pH值,释放有机分泌物、氧气,以增强根际微生物对污染物的降解和转化[9]。植物的景观功能也展现了湿地系统的美学价值。然而,CNMs对湿地植物的生物毒性以及因此对湿地除污效能的影响目前还没有被充分阐明。
在响应国家“节能减排”、“创建生态友好型宜居环境”政策的大背景下,人工湿地的推广应用已成为趋势。为使人工湿地系统更好地服务城镇废水处理,在居民环境中营造更好地景观氛围。了解CNMs对水生植物的毒性影响十分必要。尽管之前已有关于CNMs对植物的生理毒性报道,但大多数CNMs的毒理学研究都在土壤或水培等单一处理基础上,采用较高剂量对农作物或敏感植物进行研究,不适宜说明CNMs在湿地废水处理这样的复杂生态系统中对大型水生植物的影响过程。因此本研究重点考察了3种常见CNMs包括单壁碳纳米管(SWCNTs)、多壁碳纳米管(MWCNTs)和纳米富勒烯(nC60)在人工湿地中对植物生长的影响。
1 材料与方法(Materials and methods)
1.1 实验材料(Experimental materials)
3种碳纳米材料(CNMs)购自江苏纳米先丰(XFNANO)材料科技有限公司。实验中,SWCNTs和MWCNTs被放置在12 mol·L-1盐酸溶液浸泡11 h去除残留金属催化剂,之后用去离子水清洗直到中性[10]。nC60分散到甲苯中,150 r·min-1振荡2 h,然后加入4倍体积的去离子水继续振荡,直到甲苯挥发完全[11]。随后通过0.22 μm滤膜(ANPEL,上海,中国)。所有洗过的CNMs在60 ℃的烘箱中干燥过夜以得到粉末。
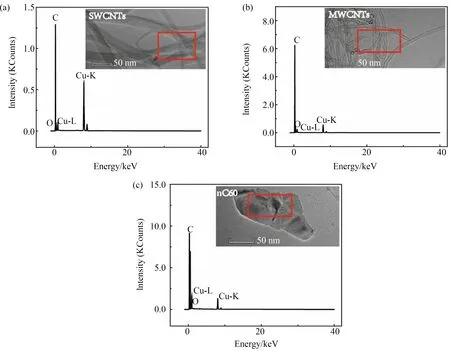
图1 人工配水中不同碳纳米材料(CNMs)的透射电镜(TEM)图像和X射线能谱(EDS) 分析结果(红色矩形区域内材料的元素分布)注:SWCNTs为单壁碳纳米管,MWCNTs为多壁碳纳米管,nC60为富勒烯纳米材料。Fig. 1 Transmission electron microscopy (TEM) images of different carbon nanomaterials (CNMs) in artificial wastewater and energy-dispersive X-ray spectroscopy (EDS) analysis results (the area indicated by the red rectangle in TEM images)Note: SWCNTs mean single-wall carbon nanotubes; MWCNTs mean multi-wall carbon nanotubes; nC60 means fullerene.
1.2 实验设计(Design of experiment)
本研究建立了21个序批次潜流人工湿地(SSF CWs),水力停留时间(HRT)为5 d,每个湿地的体积为0.045 m3(长0.3 m、宽0.3 m、高0.5 m)。湿地内部用砾石(直径5~8 mm,孔隙度0.4)填充40 cm高,种植香蒲(约20 cm高,种植深度约15 cm,密度约为267 株·m-2),孔隙体积为12 L。21个反应器共设置4个体系,其中3个湿地为空白组,SWCNTs组、MWCNTs组和nC60组各6个湿地(3个10 μg·L-1浓度处理组,3个1 000 μg·L-1浓度处理组)。所有湿地均置于(25±1) ℃的空调玻璃温室内。温室昼夜时间及温度为18 h/6 h、28 ℃/22 ℃。温室相对光照度和湿度分别为160 μmol·m-2·s-1和60%。实验开始前,湿地通入人工配水进行4个月的挂膜启动过程,以建立稳定的生物膜和植物根系。人工配水从湿地顶部的入口倒入,从底部靠重力排出,停留时间为5 d。正式实验分为短期急性暴露(5 d)和长期慢性累积(180 d)2个阶段。
1.3 取样(Sampling)
植物样品:植物根系样品在实验开始第一批次(5 d)及最后一个批次(180 d)结束后进行取样,最大程度取同深度、同粗细的根系5 g,取出后进行酶活性、根系活力及其他项目的检测。
1.4 根系抗氧化酶活性和丙二醛分析(Analysis of antioxidant enzyme activity and malondialdehyde in root system)
取1 g鲜根置于预冷研钵,加少量二氧化硅颗粒后冰浴研磨至砂浆状。加入于5 mL 50 mmol·L-1磷酸缓冲液(pH=7.0,1 mmol·L-1EDTA和2% PVP)混匀。随后,将匀浆置于10 mL离心管中,4 ℃、10 000 r·min-1离心15 min,分离上清液进行抗氧化酶活性分析[5]。
通过测定超氧化物歧化酶(SOD)抑制硝基蓝四唑(NBT)还原能力,确定SOD活性;根据过氧化氢分解速率确定过氧化氢酶(CAT)活性;通过测定愈创木酚的氧化速率,确定过氧化物酶(POD)的活性;通过测定硫代巴比妥酸反应物质(TBARS)的浓度,确定丙二醛(MDA)浓度。所有物质浓度均采用分光光度计(DR6000,HACH,日本)进行确定。
1.5 光合作用、根系活力、生物量和元素分析(Photosynthesis, root activity, biomass and elemental analysis)
实验开始后5 d和180 d,中午10:00—11:00期间,在每个反应器中最大程度选取同高度、同大小、同状态的3片叶子利用光合作用仪(LI-COR 6400 XT, Licor, USA)测定净光合速率,测定过程中保证CO2浓度400 μmol·mol-1和光照度450 μmol·m-2·s-1。根活力测定采用氯化三苯基四氮唑(TTC)还原法确定,具体实验步骤参考《植物生理学实验指导》[12]。采用电感耦合等离子体质谱法(ICP-MS) (iCAP-6300-Duo, Thermo Fisher Scientific, USA)确定植物体内磷的含量,180 d后获湿地植物,清洗根部并分离根叶,直接称量确定湿质量,烘干(75 ℃,3 d)后确定干质量,烘干后的根叶分别研磨过筛(60目)后进行消解,消解方法参考文献[13]。采用元素分析仪(Vario EL Cube, Elementar, Germany)对植物中C、N含量进行检测。
1.6 数据分析与处理(Statistical analysis)
所有处理组均设置3个平行,结果以平均数±标准差(Mean±SD)表示。采用方差分析(ANOVA)检验结果的显著性,P<0.05为差异有统计学意义(SPSS 22.0, IBM).
2 结果与讨论(Results and discussion)
2.1 根系活力的改变(Changes of root activity)
根系活力可以直接反映植物根系生长状态。如图2所示,实验开始5 d后,各组植物根系活力没有显著差别;而180 d后,10 μg·L-1和1 000 μg·L-1的CNMs对根系活力产生了显著影响,分别降低了14.6%和36.8%(P<0.05,SWCNTs组)、7.1%和42.4%(P<0.05,MWCNTs组)、9.9%和11.5%(P<0.05,nC60组)。本研究揭示了CNMs对水生植物根系活力的抑制作用,其影响植物根系生长已有文献报道。袁刚强等[14]发现SWCNTs暴露可以显著降低水稻根长耐性指数,导致根部生长缓慢。相反,Caas等[15]发现SWCNTs在水培条件下可以促进洋葱和黄瓜的根伸长;罗春燕等[16]发现nC60存在可以缓解菲对水稻根系生长的抑制作用,对植物的根系也有促进作用。关于MWCNTs对植物根系活力的影响,郭敏等[17]发现水稻幼苗根系活力随MWCNTs浓度升高而显著降低,该结论与本研究相同。根系活力之所以受到抑制,离不开根系细胞活性的改变。为了说明植物细胞活性的改变,本研究对根系酶活性进行了检测。
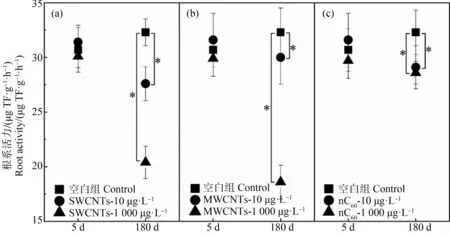
图2 CNMs处理5 d和180 d后湿地植物根系活力的变化注:*表示样品间有显著性差异(P<0.05)。Fig. 2 Root activity of wetland plants under 5 d and 180 d exposure to CNMsNote: *indicates values significantly different from the control over the same exposure period (P<0.05).
2.2 根系酶活性的变化(Changes of enzyme activity in root system)
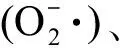
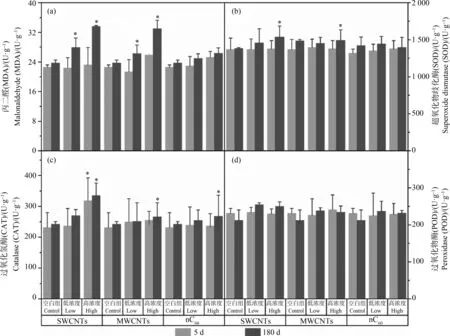
图3 植物根系丙二醛(MDA)含量及抗氧化酶活性在不同浓度的CNMs及不同暴露时间(5 d和180 d)下的变化注:*表示与对照组相比,处理组样品有显著差异(n=3、P<0.05)。Fig. 3 The changes of malondialdehyde (MDA) and antioxidant enzyme activities in roots under different concentrations of CNMs stress after 5 d and 180 d exposureNote: *indicates statistically significant differences (n=3, P<0.05) from the control.
2.3 光合作用速率改变(Changes of photosynthesis rate)
光合作用被认为是植物最重要的功能之一。本研究利用光合作用仪对净光合速率进行了检测。如图4所示,在实验开始5 d后,各组植物的净光合作用,除了SWCNTs组有轻微降低外(3.6%~7.0%),另外2组CNMs处理并没有显著变化。在180 d的实验结束后,10 μg·L-1和1 000 μg·L-1的3种CNMs处理对净光合作用均有显著的抑制作用,分别下降17.5%~52.3%(SWCNTs组)、1.0%~47.7%(MWCNTs组)、3.6%~17.3%(nC60组)。相比之下,SWCNTs的暴露对植物叶片净光合作用最显著,其次是MWCNTs,nC60的影响较小。
一般来说,光照度、温度等外部因素以及还原型辅酶Ⅱ(NADPH)量、Rubisco(1,5-二磷酸核酮糖羧化酶/加氧酶)浓度等内部因素都会影响光合效率[28]。在本研究中,MDA的存在表明,根系细胞膜可能被过氧化物破坏[5]。此外,MDA的产生过剩也会损害光合作用系统中的关键功能过程。同样,Huang等[29]报道,由于过量的ROS存在,水生植物中肋骨条藻(Skeletonemacostatum)叶绿素含量和光合系统(PSⅡ)功能、活性都会下降。考虑到ROS的存在,电子传递速率也随着抑制强度的增加而降低[30]。关于CNMs对植物光合作用的影响,王李原[31]研究了MWCNTs对芦荟和蜈蚣草的影响,发现短时间(24 h)暴露于MWCNTs可以促进植物的光合作用,而长时间(72 h)暴露光合作用则会受到抑制,但并没有解释产生机理。对于nC60影响大型水生植物光合作用的研究并不多,但是Tao等[32]和Santos等[33]对栅藻的研究表明,nC60会降低光合产物和叶绿素的含量,最终造成栅藻死亡、浮萍生长受阻。因此,对于本研究中影响叶片净光合作用程度由大到小依次是SWCNTs>MWCNTs>nC60,与实验中CNMs诱导MDA产生程度相一致,以此可以推测CNMs诱导植物产生过量MDA是导致叶片净光合作用下降的关键因素。
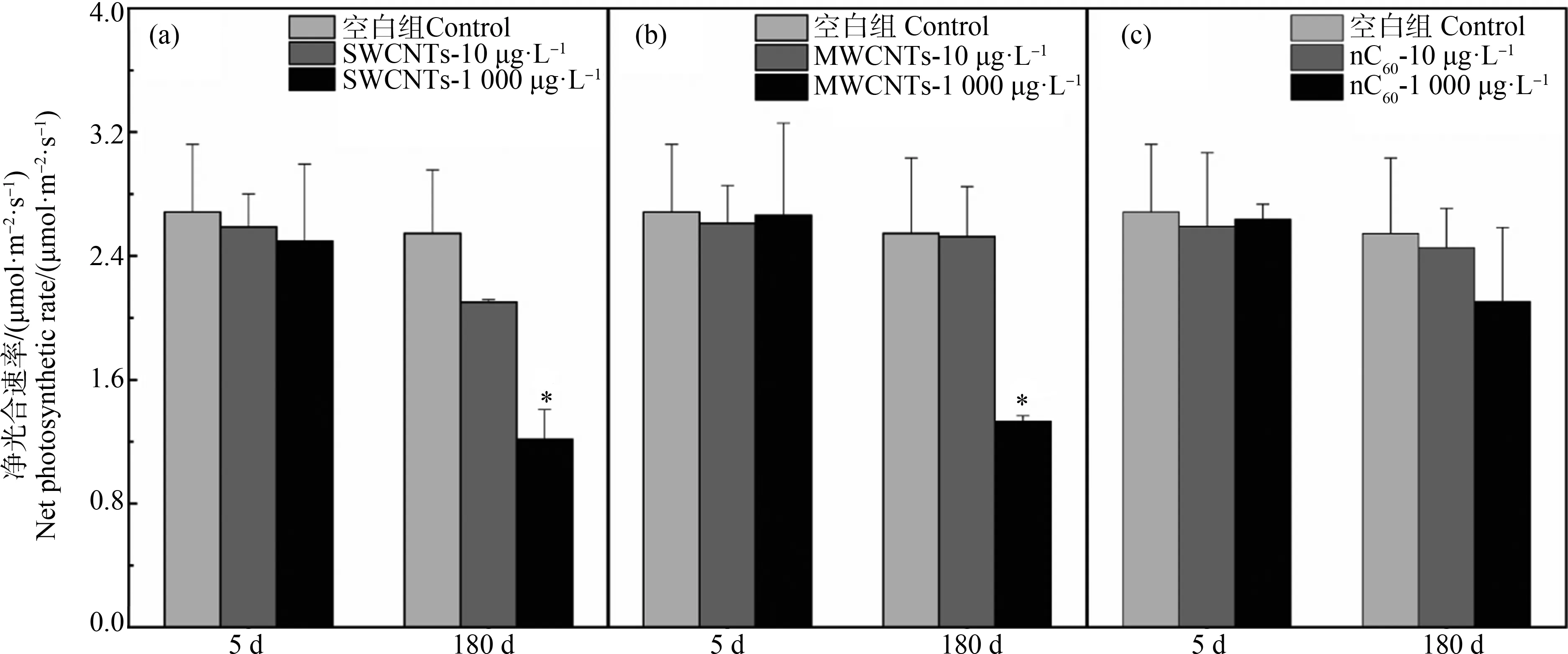
图4 CNMs处理5 d和180 d后湿地植物叶片净光合速率的变化注:*表示与对照组相比,处理组样品有显著性差异(n=3、P<0.05)。Fig. 4 Net photosynthetic rate of wetland plants under 5 d and 180 d exposure to CNMsNote: *indicates values significantly different from the control over the same exposure period (n=3, P<0.05).
2.4 生物量的变化(Changes of biomass)
对于CNMs的暴露,植物根叶的响应最终表达在生物量上。经过180 d的暴露试验后,平均每株植物生物量情况,如表1所示。由表1可知,处理组大部分生物量指标含量略低于空白组。尤其值得注意的是,经SWCNTs和MWCNTs处理180 d后,植株平均总质量低于空白组1%~6%,这样的削弱趋势也显著体现在根干质量和叶干质量上。而nC60处理组没有植物生长量低的现象。在本实验中,对植物体内主要元素C、N和P的含量也进行了测定,同时计算了其占植物干质量的比例。结果显示,与空白组相比,在SWCNTs处理180 d后,C、N和P的百分含量在低、高浓度处理组分别显著降低8.1%和17.1%、17.8%和50.5%、14.5%和52.6%;MWCNTs处理组中分别降低0.3%和10.5%、21.7%和32.7%、20.1%和45.0%。不同的是,nC60组表现出了低浓度处理提升植物体内C、N和P含量(分别升高1.7%、8.0%和5.8%),而高浓度处理则削减3种元素含量(分别下降3.5%、10.0%和16.6%)。不同组别内植物生物量的差异充分反映了3种CNMs在湿地系统中对湿地植物生长状况的影响。结合上文提到的根部根系活力、抗氧化酶活性改变以及叶部净光合作用速率的变化等结果,并通过分析3种CNMs对植物的作用机理,可认定存在于废水中的CNMs在湿地系统中长期累积,会显著改变湿地植物的生长状态。植物作为湿地中不可或缺的组成部分,其根系分泌氧分子及微量有机物对根际微生物生理活性具有很好的促进作用,借此间接影响湿地处理效能;同时根系吸收废水中含N、P元素的营养盐等,也可以直接影响湿地处理效能。不论是直接还是间接影响,都离不开植物良好的生长状态。
2.5 湿地水处理效能变化情况(Changes of treatment efficiency of wetland system)
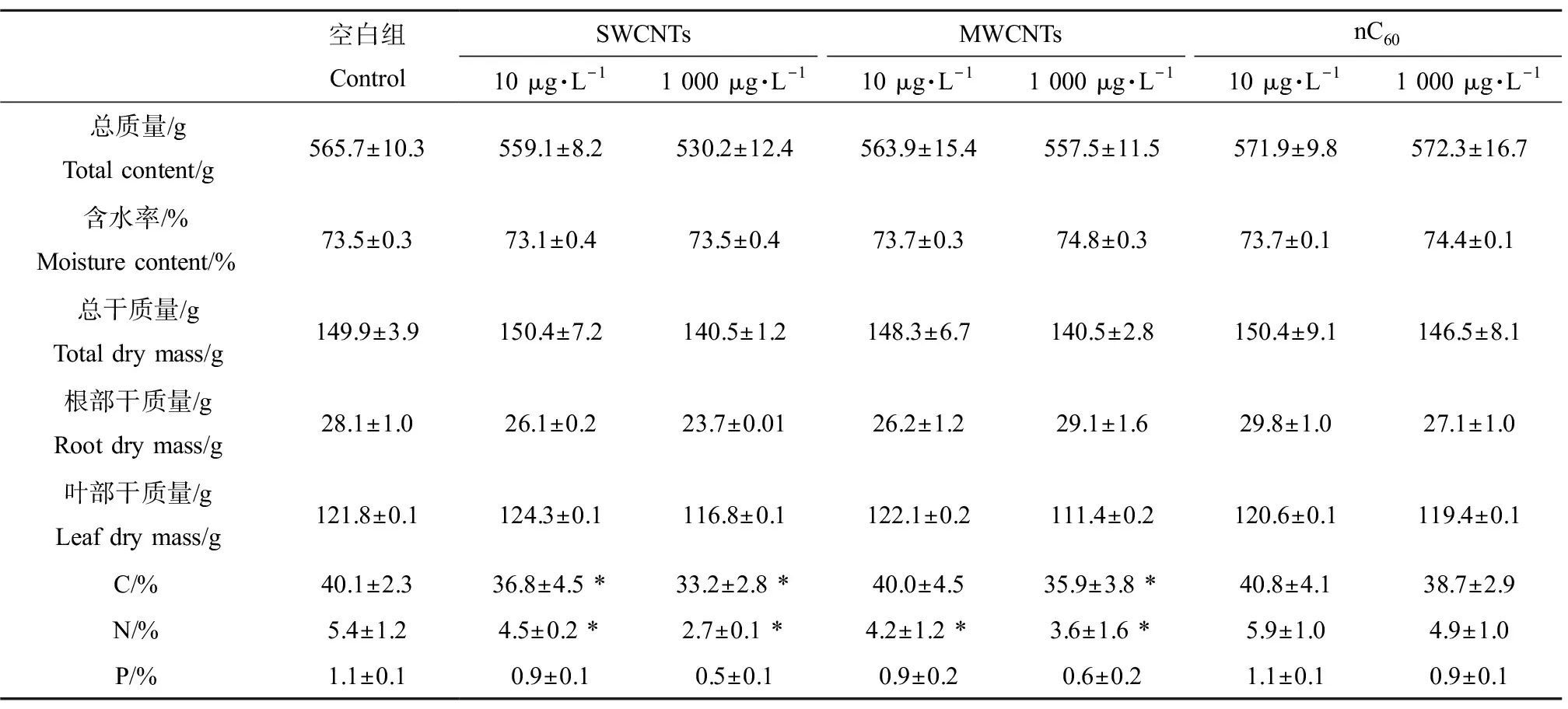
表1 湿地处理含CNMs人工废水180 d后湿地植物生物量指标变化Table 1 Changes of plant biomass index in wetland system after treating artificial wastewater containing CNMs for 180 d
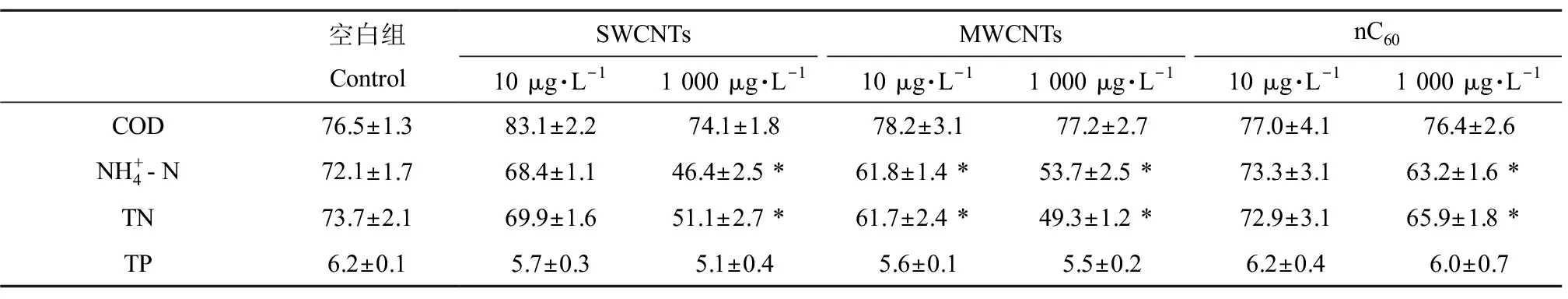
表2 不同浓度CNMs处理176~180 d水质各指标去除效率变化Table 2 Changes in removal efficiency of each nutrient at 176~180 d after treatment with different concentrations of CNMs (%)
水生植物是人工湿地中不可缺少的组成部分,其健康情况也直接影响人工湿地中营养盐的去除。CNMs胁迫降低了植物体内碳氮磷3种大量元素的百分含量(表1),这也间接说明CNMs投加导致了植物对碳氮磷养分吸收同化能力的降低,从而削弱了湿地的除污能力。
本研究调查了香蒲在人工湿地连续处理含有3种CNMs废水的短期和长期响应规律。结果表明,香蒲急性(5 d)接触CNMs并没有显著的生理活性方面的改变;连续处理含CNMs废水180 d(慢性暴露)后,香蒲根系细胞受CNMs胁迫,胞内抗氧化酶活性及MDA含量升高,导致根系活力受到显著抑制,抑制程度由强到弱依次为SWCNTs>MWCNTs>nC60;根部MDA含量增加以及抗氧化酶活性上升,说明CNMs与香蒲根系长期接触,干扰了根系细胞生理活性,这种干扰在SWCNTs组和MWCNTs组尤为突出,而nC60处理组与空白组比较并没有统计学上的显著差异。同时,本实验证明,由于根部遭到CNMs的干扰,香蒲地上部叶片的净光合作用也表现出下降趋势。暴露于含CNMs的废水180 d后,由于香蒲生理活性的改变,其生物量严重减少,SWCNTs组和MWCNTs组最为显著,nC60处理组表现为短期轻微促进、长期抑制的结果。

