人工沉积物中四氧化三铁纳米颗粒对斑马鱼胚胎发育和氧化应激水平的影响
文婷,隋彦伯,周雅娜,张赟,魏晨曦
淡水鱼发育生物学国家重点实验室,湖南师范大学生命科学学院,长沙 410081
四氧化三铁纳米颗粒(Fe3O4NPs)大量应用于生物医学[1]和生态环境领域[2],存在广泛需求,因此Fe3O4NPs在市场上被大规模生产。但是,Fe3O4NPs的大规模生产及使用导致包含Fe3O4NPs的生活废水或工业废水排放进入水生生态系统。由于Fe3O4NPs不溶于水,并且具有很强的吸附性,最终会沉降进入沉积物中积累起来,导致沉积物中所含污染物的浓度是水相中的数百倍甚至数十万倍[3]。当受到外界的干扰时,沉淀在沉积物中的污染物会通过重悬浮、转运等作用重新释放出来,对环境形成二次污染[4],从而对水生植物、底栖生物、浮游生物和鱼类等造成一定的影响。诸多文献表明,铁系纳米材料对生物具有一定的毒性作用[5-6],细胞可通过胞饮、扩散和吞噬等途径摄入Fe3O4NPs。研究表明Fe3O4NPs具有细胞毒性[7],对藻类的生长的也有抑制作用[8]。也有证据表明,斑马鱼胚胎及幼鱼连续在Fe3O4NPs中暴露28 d后,继续放入清水中排出Fe3O4NPs 24 d,与对照组相比,斑马鱼体内依然有大量的铁积累[9],但斑马鱼胚胎短期暴露的积累量并没有研究。
目前,大量的人工纳米材料对水生生物的毒性研究大部分都是在水相中进行的,而在沉积物中的研究很少[10-11]。美国环境保护局认为,沉积物的质量安全评价是研究和管理水质的紧要任务[12]。欧洲环境毒理化学学会认为,生物暴露实验是评价沉积物中污染物的唯一可靠途径。进行毒性暴露实验所需要的污染沉积物一般是通过2种方式获得:(1)直接采样;(2)在相对纯净的沉积物中,人工添加某种化学污染物,获得所需污染沉积物,这种方法叫做“加标”[13]。由于自然沉积物杂质太多且不能完全控制成分变化,而加标沉积物各种成分及理化性质都可以由人工调控,所以可以在毒理学暴露实验中建立特定的“剂量-效应”依赖关系。
本文参考已发表的文献研究[14]确定起始加标量后,设置浓度梯度,以斑马鱼胚胎作为受试动物,以沉积物表面作为受试场所,对斑马鱼的胚胎进行了为期96 h的急性毒性测试。该测试评估了斑马鱼胚胎生活的沉积物表面,由含有不同含量Fe3O4NPs的沉积物释放的Fe3O4NPs和经自然沉降后游离在沉积物表面的Fe3O4NPs对斑马鱼发育以及氧化应激的影响。暴露在Fe3O4NPs下产生的活性氧(ROS)可诱导氧化应激,这是Fe3O4NPs产生毒性的机制之一[15]。最后,我们对斑马鱼幼鱼组织中的Fe3O4NPs含量进行了检测,旨在了解Fe3O4NPs含量的增加与氧化应激之间存在的关联。与此同时,天然水体中关于Fe3O4NPs的含量还没有报道,希望我们的研究能够为沉积物中Fe3O4NPs的含量给出一个安全参考范围。
1 材料与方法(Materials and methods)
1.1 化学药品与试剂
活性氧(ROS)、丙二醛(MDA)、超氧化物歧化酶(SOD)、总抗氧化能力(T-AOC)以及组织铁的检测均使用购买的试剂盒进行。ROS试剂盒、MDA试剂盒、SOD试剂盒、T-AOC试剂盒、组织铁试剂盒均购自南京建成生物工程研究所。Folin-酚蛋白检测试剂盒购自北京鼎国昌盛生物技术有限公司。20 nm Fe3O4NPs、85 μm SiO2和高岭土购自上海阿拉丁生化科技股份有限公司。海盐购自Aquarium Systems公司。其他试剂均为国产分析纯。
1.2 海盐水的配制与作用
称取60 mg盐,加入1 L的超纯水,充分溶解后制成浓度为60 mg·L-1的海盐水。海盐水用于胚胎的培养以及加标沉积物的配制。
1.3 Fe3O4 NPs的TEM表征检测
使用浓度为60 mg·L-1海盐水配制20 mg·L-1的Fe3O4NPs溶液样品,超声30 min后,用FEI TECNAI G2 F20 200 kV场发射透射电子显微镜(TEM)对样品的形貌进行表征,观察Fe3O4NPs的形貌以及分散情况。用Nano measure统计Fe3O4NPs的粒径。
1.4 斑马鱼养殖与胚胎收集
AB品系野生型斑马鱼购自中国科学院水生生物研究所。14 h光照、10 h黑暗光周期处理,饲养于水温(28.5±0.3) ℃的循环水生系统中。每天喂食2次丰年虫卵。收集胚胎的前一个晚上将雄鱼和雌鱼以2∶1的比例放入交配缸中,并用透明隔板将雄鱼和雌鱼隔离开来,第2天早上8∶30左右抽开透明挡板,使雄鱼和雌鱼交配产卵。交配1 h后收集鱼卵至培养皿中,并用海盐水清洗胚胎。清洗后的胚胎需要经过显微镜观察选择,将劣质的胚胎去除后再进行染毒实验。
1.5 人工沉积物配制
由于自然沉积物中杂质太多,且成分不可控制,Fe3O4NPs浓度也不能确定,所以本实验采用沉积物加标的方法,根据OECD No.233配制人工纯净沉积物,通过定量添加Fe3O4NPs,对斑马鱼胚胎进行染毒实验。
纯净的人工沉积物按照OECD Test No.233[16]说明配制。配方为5%的泥炭土(pH 5.5~6.0)+20%的高岭土+75%的二氧化硅(50~200 μm)。将泥炭土过筛(100目)处理,筛出杂质以及大颗粒,将过筛后的泥炭土放入烧杯,加入适量的双蒸水,使用磁力搅拌器搅拌2 d使之均匀。再加入高岭土和石英砂,继续搅拌至粘稠状,最后用CaCO3调节pH至7.0±0.5,在通风阴凉处风干至干粉状待用。
1.6 人工沉积物清洗
在开始加标前,将风干好的人工沉积物加入适量双蒸水,放入摇床中摇动12 h,取下后静置12 h,倒掉上层水。重复一遍以上操作,最后风干待用。此步骤的目的是为了充分清洗人工沉积物,以免发生毒性作用。结果也表明经过清洗后的纯净人工沉积物并未发现毒性作用,洗涤2次后的死亡率下降到2.2%左右,非常接近纯净胚胎培养液的死亡率。
1.7 纯净人工沉积物加标
称取64 mg球型Fe3O4NPs,倒入试剂瓶中,加50 mL海盐水,超声30 min使之分散,形成悬浊液。然后迅速倒入盛有10 g纯净人工沉积物的烧杯中,用少量双蒸水清洗试剂瓶2次并倒入烧杯,使用磁力搅拌机充分搅拌人工沉积物3 d左右,使其成为凝固状态,然后继续人工搅拌4 d左右至干燥状态,最后使用玻璃棒碾碎成为粉末状备用。
按照实验所需的浓度按比例加入制备好(包含Fe3O4NPs和纯净沉积物)的干粉和纯净沉积物(总质量为2 g),加入20 mL海盐水,摇床摇动12 h,取下静置24 h,便可用于斑马鱼胚胎染毒。
1.8 斑马鱼胚胎染毒
沉积物质量与海盐水比例为1∶10,即1 g沉积物添加10 mL的海盐水。向100 mL烧杯中添加2 g沉积物,并加入20 mL的海盐水,摇床摇动12 h,静置沉降24 h。实验组所采用的沉积物中Fe3O4NPs浓度分别为0.2、0.4、0.8、1.6和3.2 mg·g-1,对照组为不含Fe3O4NPs的沉积物,每个烧杯中放入30枚斑马鱼胚胎。每个实验组每次实验都包含5个平行的重复组。试验期间,每隔24 h需要挑出死亡胚胎及幼鱼,避免污染其他胚胎。在72 hpf记录孵化率,96 hpf在显微镜下观察每一只鱼,并统计斑马鱼畸形率、心率和自主活动次数。
1.9 斑马鱼样品制备与检测
收集暴露于不同浓度Fe3O4NPs中存活的96 hpf幼鱼,再使用1×PBS清洗幼鱼,一共清洗3次。按照每尾鱼20 μL PBS的比例置于玻璃匀浆器中,冰上研磨。最后取匀浆后的斑马鱼幼鱼样品于4 ℃、13 000g,离心10 min,取上清。上清用于蛋白质、ROS、MDA和T-AOC含量的检测。用于组织铁生物累积检测样品的制备略有不同,收集96 hpf存活的幼鱼,用1×PBS清洗,一共清洗3次,按照每尾鱼10 μL生理盐水的比例匀浆。匀浆液于4 ℃、2 500g,离心10 min,取上清进行蛋白质含量和组织铁的检测。以上指标的检测步骤均严格按照所购买的试剂盒说明书进行,并按照说明书提供的方法进行计算,得出结果。
1.10 斑马鱼组织铁检测
由于Fe3O4NPs没有直接的方法可进行检测,故采用组织铁试剂盒进行检测。在酸性溶液和还原剂的作用下,使运铁蛋白中铁与蛋白分离,使血清中的高铁还原成亚铁,后者与双吡啶结合成粉红色的络合物,在一定范围内,铁离子的含量与色泽成正比。酶标仪520 nm处测OD值,根据标准曲线获得计算公式,求得Fe2+含量,从而反映Fe3O4NPs含量。
1.11 统计与分析
本实验所得数值用平均值±标准差表示,采用SPSS Statistics 25进行统计分析,多个处理组使用单因素方差分析(one-way ANOVA),Dunnett检验用于比较实验组与对照组之间均值的差异显著性。显著水平定为P<0.05。使用GraphPad Prism 8作图。
2 结果(Results)
2.1 Fe3O4 NPs的TEM表征
海盐水中Fe3O4NPs的TEM成像与粒径分布如图1所示,其粒径分布主要在13 nm左右,显示了超声处理后Fe3O4NPs的良好分散性。TEM表征得出材料粒径均在纳米尺度范围内,与厂商提供粒径相比略小,这可能是因为超声处理使Fe3O4NPs的粒径变小。
2.2 沉积物中的Fe3O4 NPs对斑马鱼胚胎发育的影响
0.2 mg·g-1与0.4 mg·g-1Fe3O4NPs组对斑马鱼胚胎的孵化率影响不大(图2(a)),与对照组的97.66%孵化率相比,这2组的72 hpf孵化率分别为92.59%(P>0.05)和84.85%(P>0.05)。与对照组相比,斑马鱼胚胎在0.8、1.6和3.2 mg·g-1Fe3O4NPs暴露组中的孵化率显著降低,分别降低了41.7%(P<0.05)、38.1%(P<0.05)和40.96%(P<0.05)。
96 hpf斑马鱼幼鱼的死亡率如图2(b)所示,与对照组相比,人工沉积物中低浓度(0.4 mg·g-1)Fe3O4NPs对斑马鱼幼鱼的死亡率影响较小,而高浓度Fe3O4NPs则显著增加了96 hpf斑马鱼幼鱼的死亡率。其中,与对照组相比,0.8 mg·g-1组的死亡率上升了5.4%(P<0.05),1.6 mg·g-1和3.2 mg·g-1组的死亡率分别上升了9.5%(P<0.01)和14.6%(P<0.01)。人工沉积物中Fe3O4NPs对96 hpf斑马鱼幼鱼的心率影响如图2(c)所示,0.2、0.4、0.8和1.6 mg·g-1的Fe3O4NPs对斑马鱼幼鱼心率的影响并不显著,只有轻微的下降(P>0.05)。而高浓度暴露组(3.2 mg·g-1Fe3O4NPs)的斑马鱼幼鱼平均心率与对照组相比,下降了8.7%(P<0.05),差异显著。
96 hpf斑马鱼幼鱼的自主运动能力如图2(d)所示,与对照组平均游动次数27 min-1相比,低浓度组(0.2 mg·g-1和0.4 mg·g-1Fe3O4NPs)斑马鱼幼鱼平均游动次数分别为24.3 min-1和24 min-1,游动频率分别下降了10%(P>0.05)和11.1%(P>0.05)。与对照组相比,中高浓度组(0.8、1.6和3.2 mg·g-1)中斑马鱼幼鱼的平均游动次数分别为17.3、16.3和16.6 min-1,游动频率分别下降了35.9%、39.6%和38.5%(P<0.05)。
人工沉积物中析出的Fe3O4NPs对斑马鱼所造成的畸形问题主要有脊柱弯曲和卵黄囊肿。少数的尾部畸形、心包水肿等其他畸形(图3(a)~图3(d))。斑马鱼的畸形率如图3(f)所示,人工沉积物中析出的Fe3O4NPs对斑马鱼的发育影响比较明显,呈现浓度梯度依赖。与对照组相比,除了0.2 mg·g-1的Fe3O4NPs组外,其他浓度暴露组的斑马鱼畸形率均显著增加。其中,0.4 mg·g-1和0.8 mg·g-1的Fe3O4NPs组的畸形率分别为5%和5.3%(P<0.05),1.6 mg·g-1和3.2 mg·g-1浓度组的畸形率分别为10.5%和11.2%(P<0.01)。
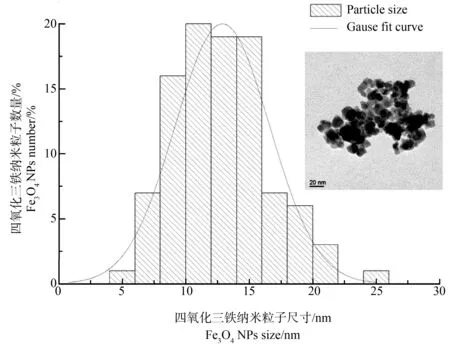
图1 四氧化三铁纳米粒子(Fe3O4 NPs)的透射电镜(TEM)表征(n=100)Fig. 1 Transmission electron microscope (TEM) characterization of Fe3O4 nanoparticles (Fe3O4 NPs) (n=100)
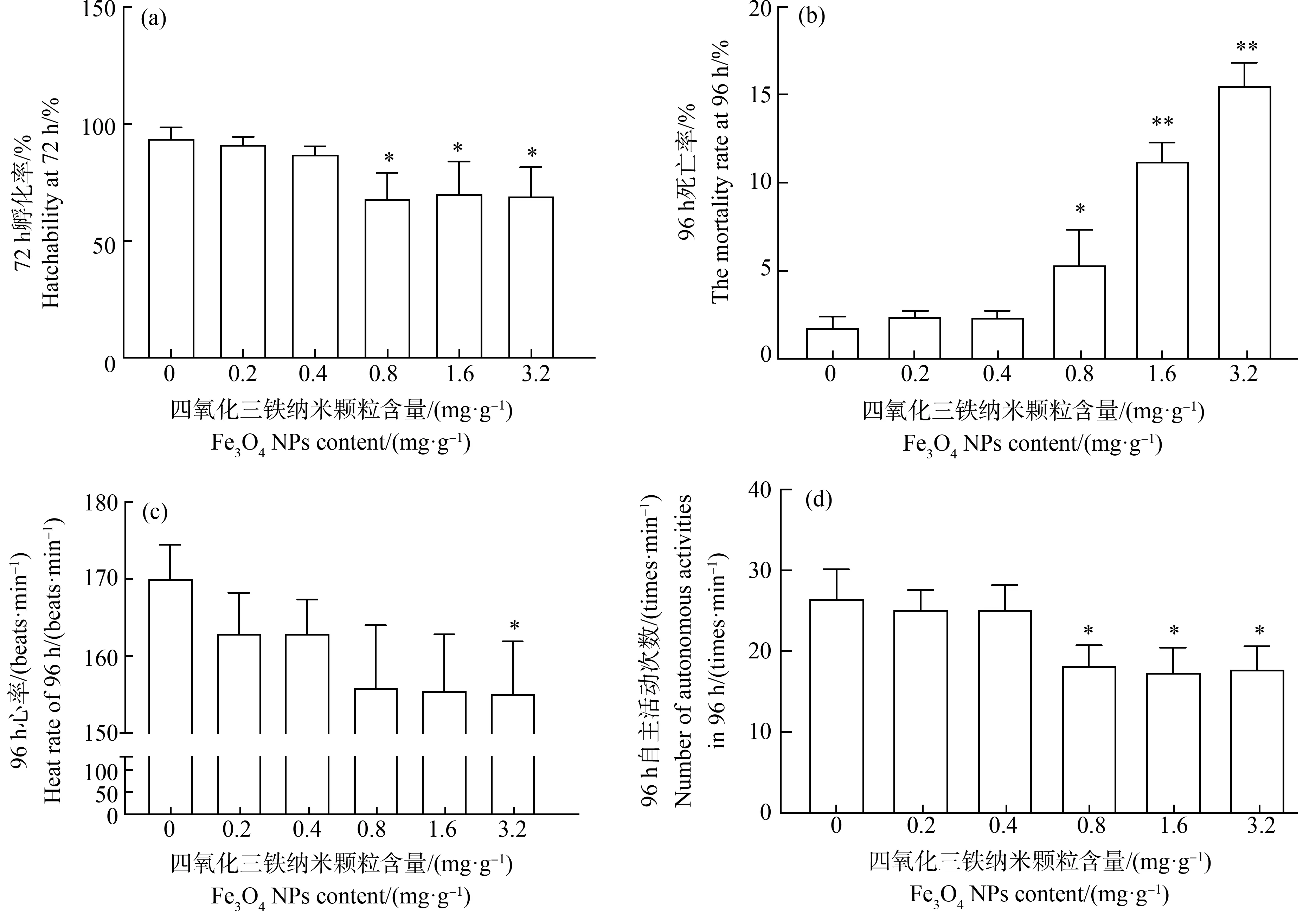
图2 沉积物中Fe3O4 NPs对斑马鱼胚胎的发育毒性注:(a)72 h斑马鱼胚胎的孵化率,(b)96 h斑马鱼的死亡率,(c)96 h斑马鱼30 s内心率,(d)96 h斑马鱼每分钟自主活动次数; 与对照组相比,*表示P<0.05,**表示P<0.01。Fig. 2 Developmental toxicity of Fe3O4 NPs on zebrafish embryosNote: (a) Hatchability at 72 h, (b) The mortality rate at 96 h, (c) Heat rate of 96 h in 30 s, (d) Number of autonomous activities per minute in 96 h; compared with the control group, *represents P<0.05, **represents P<0.01.
2.3 沉积物中的Fe3O4 NPs对斑马鱼幼鱼氧化应激水平的影响
斑马鱼胚胎暴露于含有Fe3O4NPs的人工沉积物后,除了0.2 mg·g-1的Fe3O4NPs组外,96 hpf斑马鱼幼鱼体内的ROS水平均出现显著上升(如图4(a))。最高浓度(3.2 mg·g-1)时,斑马鱼幼鱼体内ROS水平与对照组相比上升了100%(P<0.01)。96 hpf斑马鱼幼鱼体内MDA含量如图4(b)所示,与对照组相比,低浓度(0.2 mg·g-1)Fe3O4NPs组中斑马鱼幼鱼体内MDA含量略微升高,但差异并不显著。中高浓度(0.4、0.8、1.6和3.2 mg·g-1)Fe3O4NPs组中,斑马鱼体内MDA含量分别升高了260%、230%、200%(P<0.05)和373%(P<0.01),差异显著。
如图4(c)所示,与对照组相比,低浓度(0.2 mg·g-1和0.4 mg·g-1)Fe3O4NPs组的斑马鱼幼鱼SOD活性有轻微上升,但不显著。而从0.8 mg·g-1的Fe3O4NPs组开始,斑马鱼幼鱼SOD活性与对照组相比开始下降。高浓度1.6 mg·g-1和3.2 mg·g-1Fe3O4NPs组中斑马鱼幼鱼SOD活性与对照组相比显著下降,分别下降了约24%和25%(P<0.05)。在低中浓度(0.2、0.4和0.8 mg·g-1)的Fe3O4NPs组中,96 hpf斑马鱼幼鱼的T-AOC总抗氧化能力与对照组相比有轻微下降,但是并不显著(P>0.05)。在1.6 mg·g-1和3.2 mg·g-1的Fe3O4NPs组中,T-AOC分别下降了33.8%(P<0.05)和62%(P<0.01),差异显著(如图4(d)),总抗氧化能力明显下降,说明斑马鱼幼鱼受到氧化损伤。
2.4 人工沉积物中的Fe3O4 NPs对斑马鱼幼鱼的组织铁含量的影响
斑马鱼胚胎暴露于含Fe3O4NPs的人工沉积物的表面后,96 hpf斑马鱼幼鱼体内Fe3O4NPs含量剂量依赖性上升(图5)。与对照组相比,低浓度(0.2 mg·g-1)Fe3O4NPs组的斑马鱼幼鱼体内Fe3O4NPs含量略有增加,但差异不显著。与对照组相比,0.4 mg·g-1、0.8 mg·g-1、1.6 mg·g-1和3.2 mg·g-1Fe3O4NPs组的斑马鱼幼鱼体内Fe3O4NPs含量上升了130%(P<0.05)、540%(P<0.01)、620%(P<0.01)和1 150%(P<0.01)。因此,沉积物中的Fe3O4NPs在斑马鱼中的生物积累效应明显。
3 讨论(Discussion)
沉积物是水生生态系统的重要组成部分,在调节水质中起着至关重要的作用,影响重金属和有机污染物的固定化和再活化的过程[17]。重金属离子在水中不断地沉降,被水中的沉积物吸附与凝聚,最终会进入水生生态系统并不断累积在沉积物中[18]。但这个过程是可逆的,所以沉积物中的重金属污染物在一些特定的条件下会释放到水体中从而形成二次污染[19]。因此,被大量使用的Fe3O4NPs进入水生生态系统后不断累积在沉积物中,成为一个危害水生生态系统安全潜在的威胁[20]。我们的研究也证明了,即使Fe3O4NPs经过长时间的沉降,生活在沉积物表面的鱼类也会遭受到沉积物中Fe3O4NPs的影响。
研究表明,纳米粒子产生毒性的主要方式是发生氧化应激反应[21]。Fe3O4NPs进入细胞后产生活性氧簇后与过氧化氢酶反应生成的过氧化氢(H2O2),H2O2再与Fe2+发生芬顿反应,产生无法被清除的羟基自由基(·OH),导致毒性产生,这是Fe3O4NPs独有的致毒机理[22]。
斑马鱼的胚胎是一颗受精卵,此时期只有一层卵膜包裹,胚胎膜相当于细胞膜。有研究表明,附着在细胞膜上的纳米颗粒引起氧化损伤从而导致细胞膜完整性丧失。纳米粒子穿孔导致细胞膜损伤和膜通透性增加从而导致细胞内物质的渗漏。同时,还观察到细胞表面的粗糙度增加和膜损伤,纳米颗粒可以迅速穿透生物膜,从而导致细胞损伤[23]。研究表明,释放到水生环境中的工程金属纳米粒子会在沉积物中积累[24-25],且Fe3O4NPs具有磁性[26],所以会比其他的金属纳米粒子更加容易聚集沉降。同时,在本研究中,沉积物经过沉降后上覆水中的颗粒物减少,此时斑马鱼胚胎静置在沉积物表面,未产生扰动。因此,大多数的Fe3O4NPs进入到了沉积物当中。所以,沉积物表面的Fe3O4NPs通过扩散作用透过卵膜进入斑马鱼胚胎中,这是斑马鱼胚胎时期Fe3O4NPs进入斑马鱼体内的主要方式。胚胎在Fe3O4NPs的刺激下发生氧化应激反应,刺激胚胎中生成多种活性氧簇,胚胎中活性氧在过氧化物酶的作用下转变为H2O2。然后,Fe2+通过Fenton反应催化H2O2转变为毒性更强的·OH,而·OH不能被体内任何已知的酶清除,因此导致严重的体内毒性。为了解Fe3O4NPs对斑马鱼可能造成的氧化损伤,检测了斑马鱼体内的氧化应激指标。随着沉积物中Fe3O4NPs含量的增加,氧化应激水平也相应发生了变化,各指标呈一定的剂量-效应关系。这个结果与其他研究者已发表的结果一致[27]。
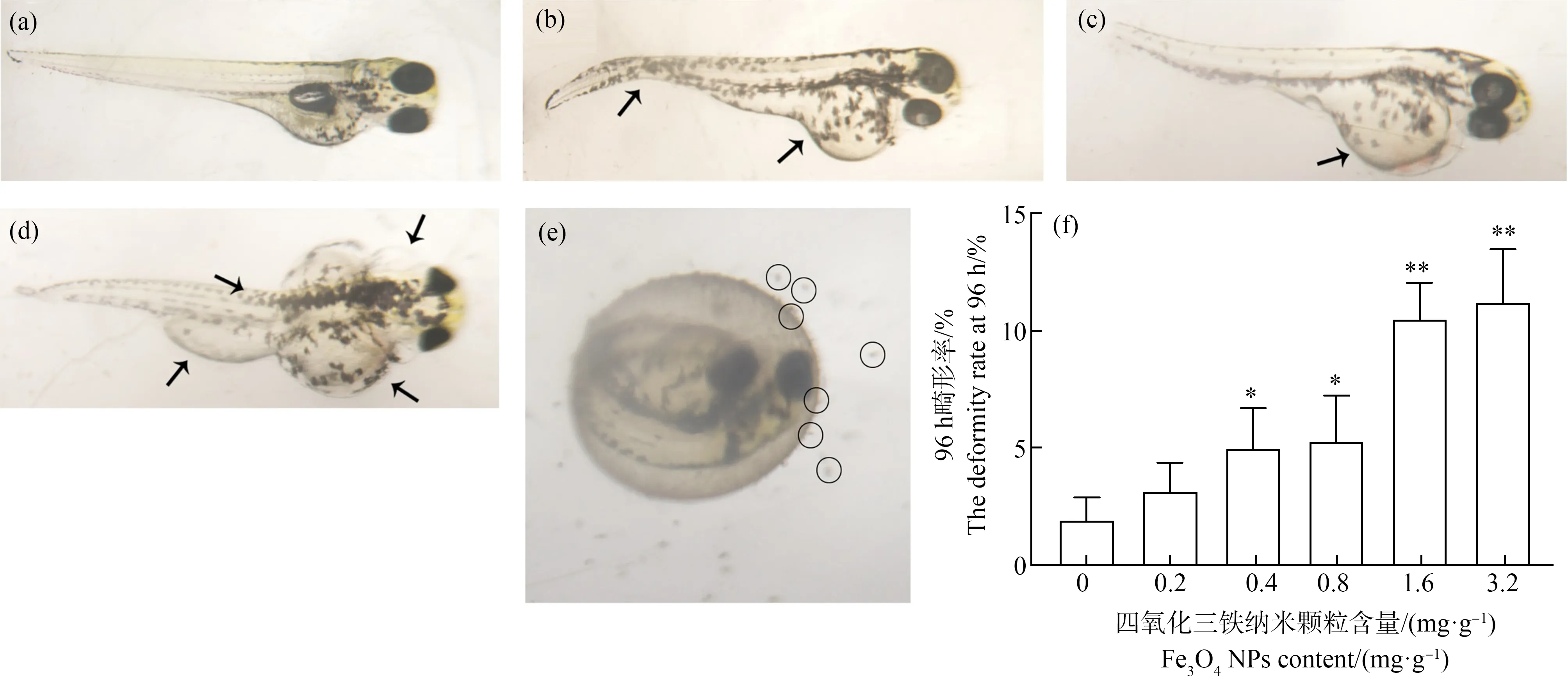
图3 Fe3O4 NPs致斑马鱼胚胎畸形注:图中箭头所指为畸形部位;(a)为正常幼鱼形态,(b)为卵黄肿大,尾巴弯曲,(c)为卵黄肿大,(d)为脊柱弯曲,心包水肿,卵黄肿大, (e)圆圈所圈的表示与土壤吸附团聚的Fe3O4 NPs,(f) 96 h畸形率;与对照组相比,*表示P<0.05,**表示P<0.01。Fig. 3 Deformity of zebrafish embryos induced by Fe3O4 NPsNote: The position indicated by the arrow is a deformed position; (a) Normal fish, (b) Yolk cyst, tail bending, (c) Yolk enlargement, (d) Spinal column curvature, pericardial edema, yolk cyst, (e) Soil agglomeration, (f) The deformity rate at 96 h; compared with the control group,*represents P<0.05, **represents P<0.01.
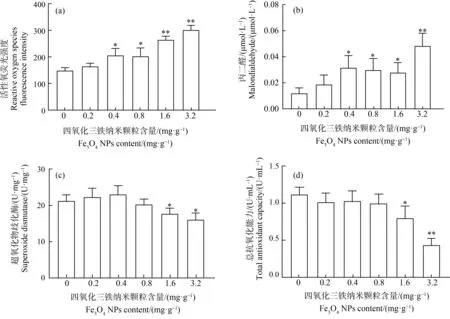
图4 Fe3O4 NPs对斑马鱼胚胎的氧化应激效应注:与对照组相比,*表示P<0.05,**表示P<0.01。Fig. 4 Effects of Fe3O4 NPs on oxidative stress in zebrafish embryosNote: Compared with the control group, *represents P<0.05, **represents P<0.01.
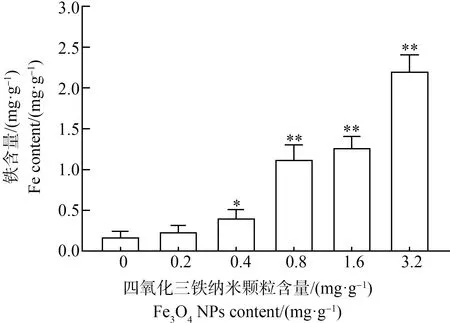
图5 Fe3O4 NPs在斑马鱼胚胎中的蓄积注:与对照组相比,*表示P<0.05,**表示P<0.01。Fig. 5 Accumulation of Fe3O4 NPs in zebrafish embryosNote: Compared with the control group, *represents P<0.05, **represents P<0.01.
在本研究中,从0.8 mg·g-1的Fe3O4NPs开始,斑马鱼死亡率逐渐升高,孵化率降低。在斑马鱼胚胎时期,随着沉积物中Fe3O4NPs浓度的增加,更多的Fe3O4NPs可以透过胚胎膜进入到胚胎中产生氧化应激反应。在斑马鱼幼鱼时期,斑马鱼在沉积物表面休憩会摄取表面沉积物为食从而使Fe3O4NPs进入体内[28-29]。同时,鳃呼吸也会使纳米粒子进入幼鱼体内[29]。斑马鱼幼鱼从底部相对静止状态到水中游动状态时会产生扰动,扰动效应会使得沉积物表面携带Fe3O4NPs的沉积物颗粒被激起[28-29]。此时幼鱼主要通过体表吸附以及呼吸作用摄入游离在水中的Fe3O4NPs颗粒,这都使斑马鱼的幼鱼产生了大量的活性氧簇,导致死亡增加,组织中铁离子含量的增加也印证了此推论。斑马鱼孵化率降低的原因除了Fe3O4NPs可以透过卵膜进入胚胎产生氧化毒性之外,还因为Fe3O4NPs具有超顺磁性[26],Fe3O4NPs可以和更多的沉积物结合吸附,部分形成土壤团聚物,包裹在胚胎表面,使胚胎不能突破卵膜,导致胚胎窒息死亡。同时也有研究证明,高浓度的Fe3O4NPs可以使受精卵孵化延迟[30]。
Fe3O4NPs可使斑马鱼畸形率升高。斑马鱼出现的畸形情况主要有卵黄肿大、脊柱弯曲和心包水肿。卵黄肿大的原因是Fe3O4NPs进入幼鱼体内,发生氧化应激毒性,导致炎症的发生而使卵黄肿大,同样心包水肿也有炎症反应的参与。另外,研究证明斑马鱼在高含量铁环境下,Bmp2受到抑制作用,定量验证发现铁过载后runx2a、runx2b和sp7等成骨基因均下调,从而导致成骨代谢的异常[31]。因此,Fe3O4NPs在体内不断积累,抑制斑马鱼鱼骨的形成,导致斑马鱼骨骼畸形。
斑马鱼幼鱼自主运动能力、活力下降的一个原因是斑马鱼幼鱼受到的氧化损伤会使机体发育迟缓从而导致运动器官发育不足。在研究中观察到Fe3O4NPs使斑马鱼孵化降低,这从侧面佐证Fe3O4NPs导致的氧化损伤能够造成发育迟缓,使胎膜内的小鱼无法突破卵膜。其活力下降的另一个原因:暴露在高浓度铁环境下,铁与活性氧中间物发生反应,产生的自由基引起脑内不同的细胞和血红蛋白的防御反应,导致了神经元的毒性作用[32]。Zhang等[33]认为铁过载会引发铁超负荷心肌疾病。我们在研究中也观察到了心率下降的现象。
随着沉积物中Fe3O4NPs含量的增加,斑马鱼体内Fe3O4NPs也相应增加。在本研究中,斑马鱼体内Fe3O4NPs增加,尤其是中高浓度组(0.8 mg·g-1和1.6 mg·g-1),增加量十分显著,并出现一定的浓度剂量依赖。氧化应激的指标也会与斑马鱼体内Fe3O4NPs的积累量呈现正相关的关系,即斑马鱼组织中检测出的Fe2+浓度越高就意味着进入到幼鱼体内的Fe3O4NPs越多,导致的氧化毒性就越剧烈。因此,可认为,斑马鱼受到氧化损伤程度与沉积物中的Fe3O4NPs在斑马鱼体内不断积累有关。Fe3O4NPs的铁积累在生物体内的现象并不是孤例。Zhang等[9]采用为期52 d的连续半静态水暴露方案,研究了2种氧化铁纳米材料(nano-Fe2O3和nano-Fe3O4)在斑马鱼体内的累积和消除情况。成年斑马鱼暴露在初始浓度为4.0 mg·L-1和10.0 mg·L-1的nano-Fe2O3、nano-Fe3O4悬浮液中持续28 d,然后将其转移到清水中24 d以进行消除实验。通过测量鱼体和粪便中的铁含量发现,Fe在浓度4.0 mg·L-1和10.0 mg·L-1的nano-Fe2O3处理组中最高累积量分别为1.32 mg·g-1和1.15 mg·g-1,Fe在浓度为4.0 mg·L-1和10.0 mg·L-1的nano-Fe3O4中最高累积量分别为1.25 mg·g-1和0.90 mg·g-1。在藻类的研究中,小球藻中累积的铁含量随着Fe3O4NPs的浓度和暴露时间的增加而增加[34]。经72 h、浓度为400 μgmL-1的Fe3O4NPs处理的藻细胞,铁的生物积累量是对照组的35倍。在此处理条件下,铁的生物积累量从24 h至72 h增加了2.81倍。因此,经Fe3O4NPs处理后,无论是植物还是动物都会表现出一定程度的铁积累,并呈现剂量依赖关系,所以铁积累是一个普遍的现象。那么,Fe3O4NPs进入到生物体内后产生氧化毒性从而导致生物体死亡也会成为一个普遍的现象。
综上,沉积物中游离出来的Fe3O4NPs积累在斑马鱼幼鱼体内导致氧化损伤从而引起斑马鱼幼鱼发育异常。这种氧化损伤也可能会通过食物链层层放大进而对人类健康构成一定威胁。除此之外,由于沉积物中物质复杂多变,累积在沉积物中的Fe3O4NPs可能与其他污染物联合作用从而导致巨大的生态风险。

