有害结局路径在农药风险评估及管理中应用的探讨
张婉君,范瑞祺,黄超,罗荪琳,贾栗,陈义强,苑晓燕,*
1. 中国人民解放军疾病预防控制中心,北京 100171 2. 动物营养学国家重点实验室,中国农业大学动物科技学院,北京 100193 3. 杭州瑞欧科技有限公司,杭州 311121
1 农药风险评估和AOP的背景介绍(Introduction of pesticides risk assessment and AOP)
1.1 农药管理的热点问题
我国在果蔬生产管理过程中,农药使用量大、使用种类繁多。我国国家统计局数据显示,我国2018年农药使用量为150.36万t。由于农药混合使用的情况常有发生,故多种农药残留的现象较为普遍。Li等[1]评估了我国柑橘中农药残留情况,从2013—2018年收集的2 922个样本中共检出40种农药,其中毒死蜱的检出率高达40%。Liu等[2]调查了在我国收集的柿子、枣及其种植土壤样品中的农药残留情况,在36.4%的柿子样品和70.8%的枣样品中,发现有机磷类、有机氯类和拟除虫菊酯类等多种农药化合物的残留成分。
由于食品、环境介质中的农药残留,农药可以通过各种方式进入人体,在人体中富集。Kuang等[3]综述了1980—2020年我国母乳中的农药残留情况及其对母婴健康的危害,这项母乳调查覆盖了中国22个省级行政区域,结果表明,母乳中有机氯农药的残留水平排序为滴滴涕类、六六六类>狄氏剂类>六氯苯>氯丹类,但是目前尚无相关标准为母乳中农药的安全水平提供参考。此外,Tang等[4]的研究表明,在我国,尿液中拟除虫菊酯生物标志物3-苯氧基苯甲酸(3-PBA)的检出率在36.0%~98.8%之间。
多种农药污染物共存可能会导致联合毒性效应风险放大,国内外已有一些基于斑马鱼等模式动物和细胞模型的研究证实农药复合污染存在协同作用、拮抗作用和相加作用。Kim等[5]研究发现,当农药硫丹和菲(具有3个稠合苯环的多环芳烃)按各自的LC50浓度1∶1混合时,混合物对斑马鱼的复合毒性呈现协同作用,而在其他组合比例下呈现拮抗作用。Wang等[6]研究了单独和联合使用4种农药对斑马鱼的致死率和基因转录水平的影响,结果表明,在异菌脲+吡唑醚菌酯、异菌脲+嘧霉胺、异菌脲+啶虫脒和嘧霉胺+啶虫脒4种农药的二元混合物中观察到协同作用,在嘧霉胺+吡唑醚菌酯、吡唑醚菌酯+啶虫脒的二元混合物中分别观察到加和以及拮抗作用。农药复合暴露可能会为人类健康和环境带来更大的影响和危害,也为风险评估带来了更大的挑战,因此农药复合污染风险评估十分重要。
1.2 毒性测试和风险评估研究进展
毒性测试旨在通过急性暴露或者多次暴露来识别化学品对人类、动物等造成的有害影响[7],根据动物反应来表征危害[8]。传统的毒理学评估要求使用动物模型来测试化合物[9],即用化合物对动物进行暴露,将毒性终点与对照组进行比较[10]。但是动物测试昂贵耗时,且不能评估所有关键终点和生命阶段。而低成本、高通量的体外测定法具有替代动物模型的潜力。替代动物实验的测试方法支持实现3R原则(reduction, replacement, refinement),减少了动物测试实验。一些新的技术也在不断发展中,如有害结局路径(adverse outcome pathway, AOP)、高通量高内涵筛选、组学和生物信息学等,这些新技术提高了替代方法的化学品安全性评价的有效性。
美国环境保护局(US EPA)认为风险是当人体或生态系统暴露于环境压力源时,对人体健康或生态系统造成有害影响的机会。风险评估过程包括问题阐述、暴露评估、效应评估和风险表征4个环节[11]。US EPA使用风险评估来表征人类和其他生物受到来源于化学污染物和其他压力因素的健康风险的严重程度。
农药风险评估是指采用科学技术及信息,在特定条件下,就农药对人类健康及环境产生不良效应的可能性和严重性进行科学评价[12]。根据保护的目标分为健康风险评估和生态风险评估。其中,健康风险评估又包括膳食风险评估、职业健康风险评估和居民健康风险评估等[13]。风险评估对于农药管理至关重要,新农药必须经过风险评估才能进入市场,并且必须时常对现有农药进行定期再评估,以确保它们符合更新后的安全标准。此过程有助于更好地保护农业生产,并确保农药对人类和环境无有害影响[14]。
传统的风险评估是基于单独的化学品进行的,即一种化学品和一种暴露途径[15]。然而环境中存在大量混合化学物质,人类和环境经由多种暴露途径暴露于多种化学物质。因此,构建混合物风险评估的框架尤为重要。混合物风险评估(mixture risk assessment, MRA)代表对多种化学物质的综合接触所产生的风险评估[16]。欧洲食品安全局(EFSA)、经济合作与发展组织(OECD)等组织正在积极构建此类风险评估的框架。
1.3 AOP的理念与新思路
AOP是一个概念框架,在与风险评估相关的生物学组织层面上,描述了有关分子起始事件与有害结局之间联系的现有知识。2010年,AOP的概念被正式提出,随后,OECD于2012年启动了一项AOP构建计划[17],为构建和评估AOP提供了更清晰的定义和流程。
AOP描述了从分子起始事件到分子、细胞、组织和器官水平上的关键事件以及到群体水平有害结局的途径。AOP涵盖4个要素,分别是分子起始事件(molecular initial event, MIE)、关键事件(key event, KE)、关键事件关系(key events relationships, KER)以及有害结局(adverse outcome, AO)。图1显示了AOP的框架图。现有300多个AOP,发布在AOP wiki网站上。
AOP概念框架已成为组织框架,以促进替代测试方法的构建和集成,并评估化学物质对人类健康和环境的危害。构建AOP的主要动机是为了将体外、化学和计算机信息与体内毒性数据联系起来,从而支持化学品的风险评估[18]。基于AOP的整合测试与评估策略(integrated approaches to testing and assessment, IATA)将有助于农药风险评估[19],整理了AOP wiki上目前列出的与农药相关的AOP,涉及神经毒性、内分泌干扰、遗传毒性和致癌性等多种毒性分类(附表1)。AOP有望阐明农药潜在的毒性机制,为农药分组提供信息,促进筛查分析的施行以及指导综合测试策略[20]。
2 AOP在农药风险评估中的应用(Application of AOP in pesticides risk assessment)
2.1 AOP在神经毒性测试中的应用
对于大多数化学品,发育神经毒性(DNT)仍然是未知的,建立基于AOP的相关测试方法可以减少化学品DNT的知识空白,同时可避免复杂的动物实验。
EFSA植物保护产品及其残留物(Plant Protection Products and Their Residues, PPR)工作组应用AOP概念框架来为流行病学研究中观察到的帕金森氏病(PD)与农药暴露之间的相关性提供支持[21]。滴滴涕、百草枯和鱼藤酮等农药被认为是PD发生的潜在促成因素,流行病学研究也证实了农药暴露与PD发生显著相关,但是流行病学研究不能提供与PD发病有关的分子机制。Terron等[22]构建了AOP3——黑质纹状体神经元线粒体复合物Ⅰ的抑制导致PD运动功能障碍,证明了在流行病学研究中有关农药暴露与PD患病风险增加存在机制合理性。即该AOP的构建为农药暴露与PD患病风险增加之间提供了机制信息,如图2和图3所示。鱼藤酮是该AOP的应激源之一,具有高证据强度。该AOP有望阐明鱼藤酮等农药诱导PD发生的潜在毒性机制,从而为农药风险评估提供机制信息。
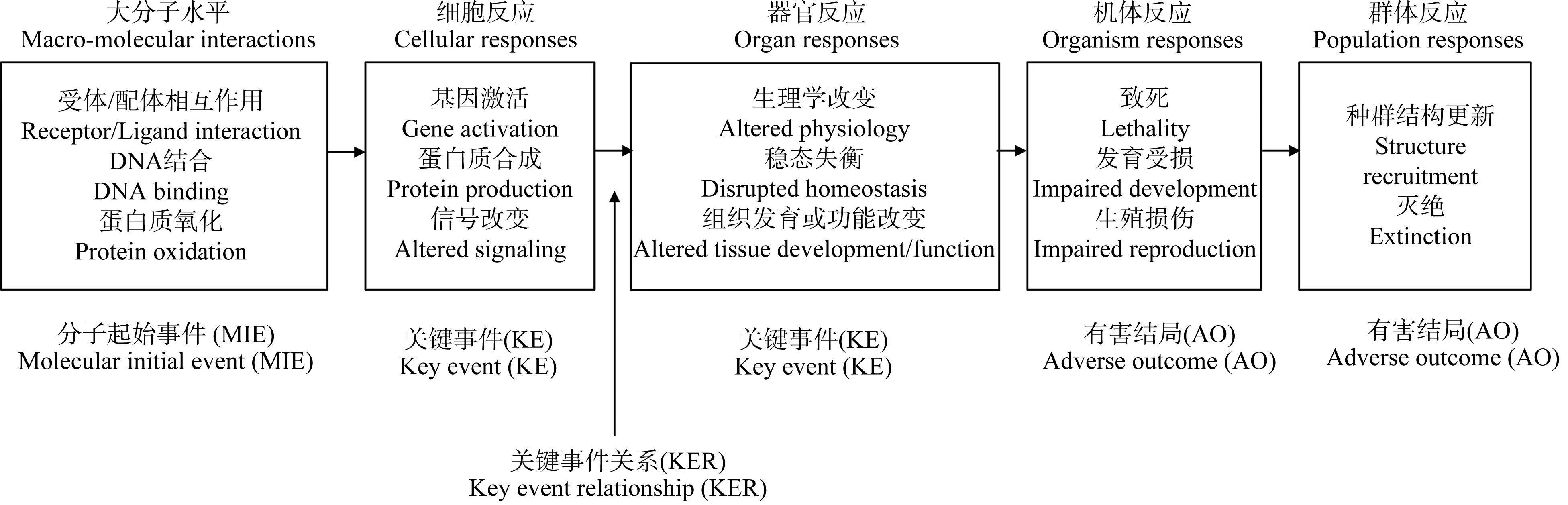
图1 有害结局路径(AOP)框架图Fig. 1 Structure of adverse outcome pathway (AOP) framework
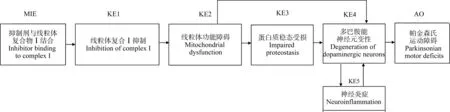
图2 AOP3——抑制剂与线粒体复合体Ⅰ结合导致帕金森氏运动缺陷的示意图(改编自[22])Fig. 2 Schematic overview on the AOP3 for the development of Parkinsonian motor deficits by inhibitor binding to mitochondrial complex I, which was adapted from reference [22]
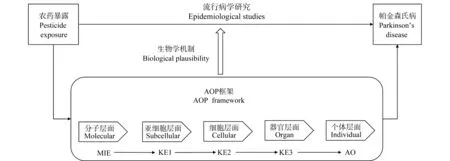
图3 欧洲食品安全局(EFSA)关于在帕金森氏病上将流行病学和实验研究相结合的科学观点的项目概况(改编自[21])Fig. 3 The project landscape of the European Food Safety Authority (EFSA) scientific opinions on Parkinson’s disease and on integration of epidemiology and experimental research, and the schematic overview was adapted from reference [21]
2.2AOP在内分泌干扰方面的应用
一些农药对动物具有内分泌干扰作用。蜕皮激素激动导致不完全蜕皮相关的死亡(AOP4)中,虫酰肼和甲氧虫酰肼等农药是该AOP的应激源之一,且具有高证据强度。相关AOP的构建有助于对内分泌干扰物的筛选和鉴定。
US EPA内分泌干扰物筛查计划(Endocrine Disruptor Screening Program, EDSP)是一项用于筛选和测试对人类和野生生物具有潜在内分泌干扰作用的化学品的项目。EDSP对于潜在雌激素活性物质分为两级筛查方法,如表1所示。1级筛选目的是测量MIE,捕获早期的细胞反应,显示化学物质内分泌活性的潜力。对于确定具有内分泌活性的化学物质需要进行2级测试,2级测试包括确定风险评估终点,以及表征剂量反应关系和AO[23]。
图4为雌激素受体激动导致生殖功能障碍(AOP29)的示意图,EDSP使用该AOP来组织和整合1级和2级测试的生物学数据,以评估化学品的内分泌活性。如图5所示,该AOP的MIE——雌激素受体激活可以与EDSP1级筛选中的雌激素受体结合试验相关联;在细胞水平上的KE——雌激素受体活性增加可以与EDSP1级筛选中的雌激素受体反式激活试验相关联;在器官、系统水平上的KE以及在生物体和群体水平上的AO可以与1级筛选和2级测试中的其他试验相关联,如子宫质量增加试验、一代繁殖毒性延长试验等。EDSP在AOP框架中组织数据,可以评价多个测定之间的反应一致性,同时收集在AOP中除了1级和2级测试试验的其他来源的数据,进一步提高置信度。
随着高通量筛选(high throughput screening, HTS)的发展,EDSP在内分泌干扰测试和筛选框架中也考虑了ToxCastTM和Tox21项目中的HTS数据,EDSP计划采用HTS和计算模型作为目前1级筛选中雌激素受体结合试验、雌激素受体反式激活试验和子宫质量增加试验的替代方法[24]。与1级筛选中低通量体外测试相比,HTS具有每年筛查数千种化学物质的能力以及成本更低的优势。AOP提供了一种路线图,来评估HTS测试的性能,以及将HTS测试结果与相应的低通量1级筛选体外测试结果进行比较。
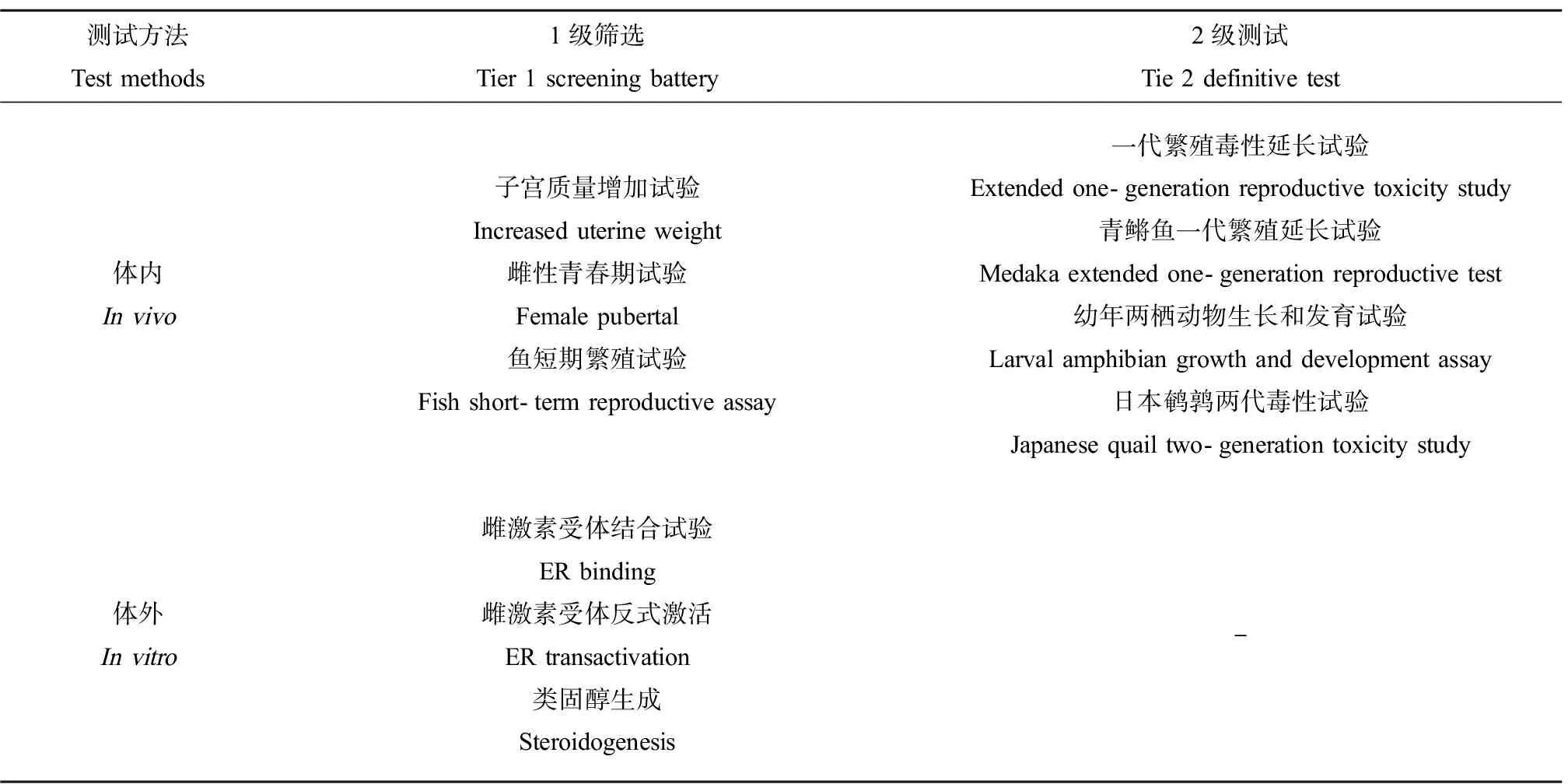
表1 内分泌干扰物筛查计划(EDSP)中用于筛选潜在雌激素活性物质的1级筛选和2级测试方法(改编自[23])Table 1 Endocrine Disruptor Screening Program (EDSP) Tier 1 screening battery assays and Tier 2 testing assays for the female mammalian estrogen (ER) agonist signaling pathway (adapted from reference [23])
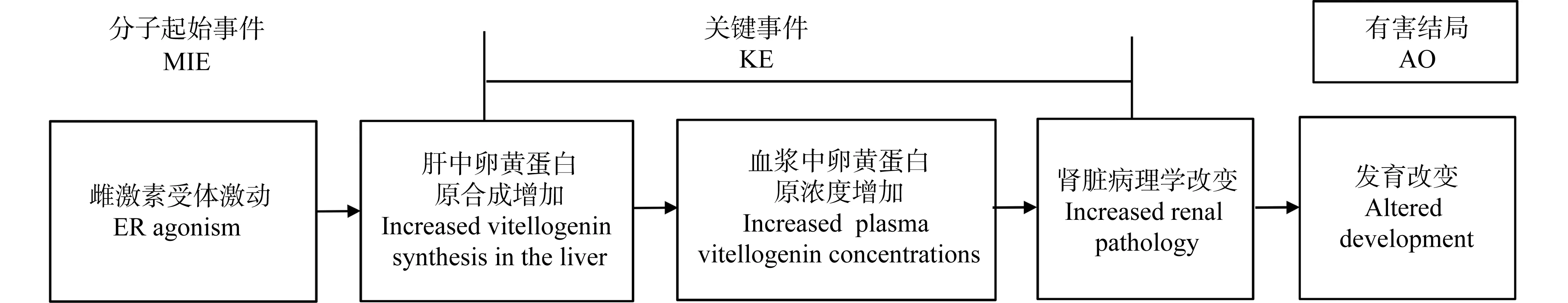
图4 正在构建中的AOP29——雌激素受体激动导致生殖功能障碍的示意图(摘自AOP wiki)Fig. 4 Schematic overview on the AOP29 for the development of reproductive dysfunction by estrogen receptor (ER) agonism (adapted from AOP wiki)
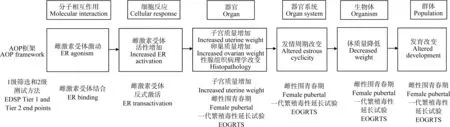
图5 用AOP框架组织1级和2级筛选和测试中的终点(改编自[23])注:EOGRTS表示一代繁殖毒性延长试验。Fig. 5 EDSP Tier 1 and Tier 2 end points relevant to the female mammalian estrogen (ER) agonist signaling pathway can be organized using an AOP framework, and theFigure was adapted from reference [23]Note: EOGRTS stands for extended one-generation reproductive toxicity study.
单一、线性和定性的AOP在风险评估中的用途有限,具有相同MIE或KE或AO的AOP可以整合到一个AOP网络中。AOP网络更能直观地表现出单个MIE可以导致多个AO,或多个MIE可以导致相同的AO[21]。Noyes等[25]使用体外测试法,鉴定在甲状腺途径上与靶标相互作用的化学物质,在甲状腺AOP网络中将体外测定得到的MIE数据与体内测定得到的下游关键事件和AO的数据相连接,可以帮助阐明化学物质是否通过甲状腺激素信号通路介导AO。在这个过程中,AOP网络提供了一种可以在多个生物组织水平上(细胞、组织、器官、系统、生物体和群体)收集甲状腺激素信号相关数据的工具。
2.3 AOP在生殖发育毒性方面的应用
AOP可以用于生殖发育毒性中的化学物筛选和优先性排序。Jeong等[26]建立了将氧化应激与生殖毒性联系起来的AOP研究案例,量化了在秀丽隐杆线虫中银纳米颗粒通过氧化应激诱导的生殖毒性。Dan Villeneuve等构建了AOP25——芳香酶抑制导致鱼生殖功能障碍,示意图如图6所示,该AOP中的大多数KE和KER具有广泛、可量化的证据支持,并且已经完成了对该AOP的科学置信度的详细分析[27];这使得芳香酶抑制导致鱼生殖功能障碍的AOP具有较高置信度。同时,该模型构建适用于定量预测,它可以从体外数据着手,分析测量发生AO的可能性。该AOP中的MIE和KE的检测方法已应用于US EPA高通量筛选计划ToxCast中[28]。
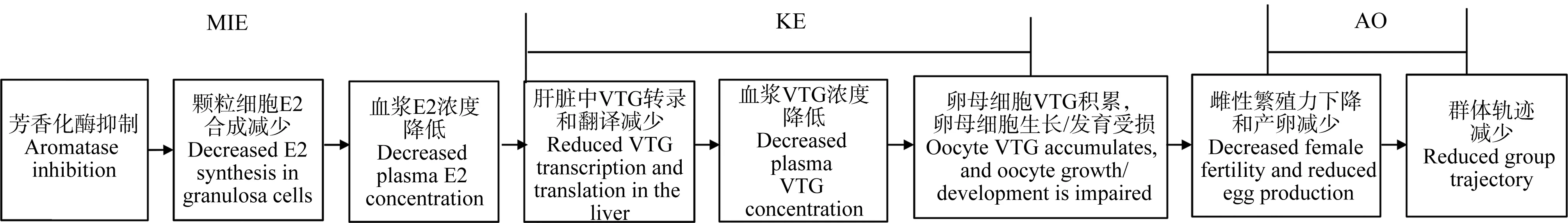
图6 AOP25——芳香酶抑制导致鱼生殖功能障碍的示意图(改编自[27])注:E2表示17β-雌二醇,VTG表示卵黄蛋白原。Fig. 6 Schematic overview on the AOP25 for the development of fish reproductive dysfunction by aromatase inhibition, and theFigure was adapted from reference [27]Note: E2 stands for 17β-estradiol; VTG stands for vitellogenin.
2.4 AOP在遗传毒性方面的应用
目前,农药的风险评估主要是获取毒理学数据,而流行病学数据却处于缺失状态。由此导致农药暴露与人类疾病之间无法建立深入的联系,AOP可以为流行病学研究提供机制的合理性,建立农药暴露与人类疾病之间的关联,通过机制证实毒性终点,最终为风险评估中的危害识别和危害表征提供证据。
例如,婴儿白血病是胎儿发育早期子宫内起源的罕见疾病,在流行病学研究中,母亲或者胎儿暴露于某些化学物质与婴儿白血病有关。EFSA构建了AOP202——拓扑异构酶Ⅱ抑制导致婴儿白血病,该AOP是通过拓扑异构酶Ⅱ(topo Ⅱ)功能紊乱导致MLL基因重排,最终形成急性白血病[29],示意图如图7所示。农药毒死蜱是该AOP的应激源之一,该AOP通过确定毒死蜱等化学物诱导婴儿白血病的潜在病因机制,填补了病因学和风险评估之间的知识空白,从而有助于在风险评估过程中对流行病学研究进行解释和整合。
2.5 AOP在致癌性方面的应用
在AOP wiki中,有一些农药作为应激源导致癌症的AOP,AOP162——肝分解代谢甲状腺激素增强,最终导致大鼠和小鼠甲状腺滤泡细胞腺瘤和癌。噻唑烟酸、除虫菊酯类和拟除虫菊酯类农药是该AOP的应激源,且具有中等证据强度。
与致癌性有关的AOP中的MIE和一些早期KE是导致癌症的必要不充分条件,化学物质是否能引起肿瘤的形成与导致异常增生变化的后续关键事件密切相关[30]。Rooney等[31]对导致肝癌的AOP中主要MIE和KE进行了检测,并据此预测化学物质的短期暴露是否会在啮齿动物中引起肝癌。通过基于化合物AOP的预测,可以锁定癌症风险的早期指标,这有助于在早期阶段进行风险评估。AOP框架提供了直观的风险识别信息,将AOP应用于化学物致癌风险的评估具有良好的前景[32]。
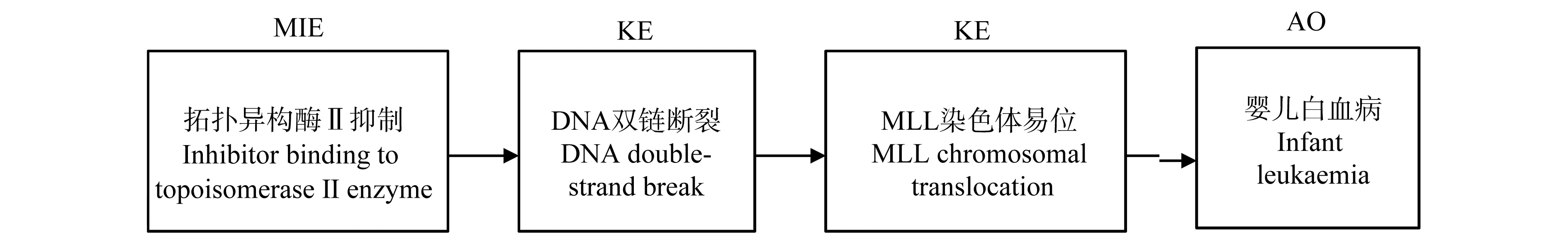
图7 AOP202——DNA拓扑异构酶II抑制导致婴儿白血病的示意图(摘自AOP wiki)Fig. 7 Schematic overview on the AOP202 for the development of infant leukaemia by inhibitor binding to topoisomeraseⅡenzyme (adapted from AOP wiki)
2.6 定量AOP的应用
AOP潜在的应用包括完善试验结果和KE之间的知识空白,以及对测试物的优先性进行排序,在此基础上,AOP还能进一步演变为将暴露数据与AO相关联的定量预测工具[18]。大多数AOP是基于定性的机制证据构建的,而定量AOP则建立在毒代动力学-毒效动力学建模方法的基础上。定量AOP对于筛选新型污染物以及评价其测试优先级是必要的,同时进行定量AOP测试也可以支持危害和风险决策。
在一个定量AOP中,对于每对KE,可以得出定量的KER,并且通过对每个建立定量关系的KER,可以快速建立预测性AOP模型的原型。Foran等[33]使用基于现有知识构建定量AOP的方法,演示了2种定量AOP,分别是抑制细胞色素P450芳香化酶导致黑头软口鲦繁殖力降低以及离子型谷氨酸受体介导的兴奋性毒性导致人的记忆障碍。Doering等[34]也构建了一种定量AOP,从芳香烃受体(aryl hydrocarbon receptor, AhR)的激活到鸟类和鱼的早期生命阶段死亡,进行了MIE和AO之间的间接、定量连接。将MIE的激活水平与AO的预期程度或发生的可能性进行定量关联。当在体外AhR的反式激活发生时,该定量AOP能够从摩尔质量以及化学物的物种特异性着手,预测二噁英类化合物引起鸟类和鱼类早期生命阶段死亡率的剂量反应曲线。
2.7 AOP在农药复合暴露的风险评估中的应用
在农业生产中,农药的混合使用会带来累积风险,为了评估农药的累积风险,EFSA在2019年提出了一种新的农药风险评估方法,该方法考虑了农药在累积评估组(cumulative assessment groups, CAGs)中的协同作用,即使农药活性物质具有不同的作用模式(mode of action, MOA),但是它们影响了相同的靶器官或系统,则将其分组在一起[35]。目前EFSA的工作重点是将这种方法与定量构效关系(QSAR)建模相结合,将农药分为相似的组,预测它们的联合毒性效应。
AOP框架可以为农药的累积风险评估的分组提供参考和依据,因为AOP框架可以将具有相同MIE或KE的化学物质混合物进行汇总,进行风险表征[36]。此外,AOP的研究对象是MIE或KE,而不必拘泥于单一化学物质,故AOP网络的概念可用于农药复合暴露的风险评估,且可以将复合污染中具有相似特性的化合物进行分组。混合物中的各物质可能在不同生物水平上具有共同的作用位点,例如共同的靶器官、共同的效应或者有害结局。当在评价混合物的复合暴露风险的过程中遇到缺少某些物质AO毒性数据的情况时,还可以使用AOP网络中KE的毒性数据来进行分组。
对于农药风险评估中的危害评估部分,可以使用2种方法来评估化学混合物的毒性。一种方法是测试整个混合物的效应(自上而下的方法),另一种方法是测试混合物中单个化合物的效应(自下而上的方法)。测试整个混合物效应的方法经常应用于环境样品,该方法具有评估未知成分混合物毒性的优点[37]。
AOP可以支持自上而下的方法,单一化学物质的水平通常会低于化学分析和生物学的检测限,但是它们联合暴露可能产生可检测的生物学反应,此时便可利用AOP网络来评估混合污染物的复合暴露。基于AOP的方法可以有助于解释混合物的效应,而不必解析混合物的每个成分[38]。另一方面,混合物复合暴露的风险评估的实验数据可以基于AOP框架中的生物测定法进行评估,这有助于鉴定化学物质和毒性途径。
3 AOP在农药风险管理中的应用(Application of AOP in pesticides risk management)
由于田间经常使用多种毒性不同的农药,各个农药暴露时间和水平也不相同,评估农药对人类健康影响的风险并非易事。但是无论农药对人类健康影响的风险有多困难,农药商业化的授权都需要活性物质对人类健康潜在不良影响的数据。这些数据通常来源于急性毒性、亚慢性或亚急性毒性、慢性毒性、致癌性、遗传毒性、致畸性测试以及以大鼠为哺乳动物模型的刺激性试验。US EPA用于评估农药对人类健康风险的毒性测试分为急性毒性试验、亚慢性毒性测试、慢性毒性测试、生殖发育测试、致突变测试和内分泌干扰测试[39]。AOP的构建可以优化这些毒性测试,并且AOP中整合的机制信息可以有效指导测试方法的选择。
农药风险评估提供人类健康风险或生态风险的信息,农药风险管理则考虑农药风险评估和其他因素,权衡各种政策要求,从而选择适当的预防和控制措施[40]。AOP可以应用在化学管理的各个阶段的各种化学决策场景中,以汇集数据并为化学物评估和管理提供指导。如研究人员可以使用AOP框架来识别KEs,在早期研发阶段筛选测定化合物,完整的AOP网络则可指导筛选出更安全的候选化合物[41]。EDSP也在使用AOP来组织和整合生物学数据,以评估化学品的内分泌活性[23]。
4 总结与展望(Conclusion and outlook)
AOP的构建可以为农药暴露与人类疾病患病风险增加之间提供机制信息,有望阐明农药潜在的毒性机制,从而促进筛查分析的施行。除此之外,AOP还可以为农药复合暴露的累积风险评估提供农药分组的依据[42]。AOP方法为风险评估者创造了优势,因为它们描述了从暴露源到AO的因果关系。通过这种手段,可以对当前知识、数据缺口和风险评估结果的不确定性进行科学的评估。
随着风险评估研究不断深入,目前的风险评估及管理对探究机制层面原因的需求不断增加,同时面临着日益严重的化学物质复合暴露风险的管控。同时,减少实验动物使用的要求也日益迫切。针对以上问题,实施和使用AOP将作为当前和未来化学风险评估中的战略步骤。
综合来看,尽管AOP可填补效应和机制之间的知识空白,也可对混合物中的各种成分进行归类,但是单一、线性和定性的AOP在风险评估中的用途有限。因为生物途径是复杂的,而且仅以定性术语来描述AOP,无法了解MIE、KE和AO之间的定量关系,对于AOP的定量理解是风险评估所必需的。此外,毒性机制可能包括正反馈回路,如乙酸乙烯酯会代谢形成2种代谢物,一种可能引起细胞毒性,另一种诱导DNA-蛋白质加合物,这2个事件表现出协同作用,线性AOP难以呈现这种复杂的机制[43]。因此,在未来的农药风险评估及管理中,应更加关注AOP网络的应用。在AOP网络中,可以将单个MIE与多个AO联系起来,更有助于未来的研究以及非动物毒性测试方法的发展[44]。

