实时荧光定量PCR技术在太湖蓝藻监测和评估中的应用
周君薇,张丽娟,周宇昆,张效伟,3,*
1. 江苏省环境经济技术国际合作中心,南京 210000 2. 南京大学环境学院,南京 210023 3. 江苏省生态环境保护化学品安全与健康风险研究重点实验室,南京 210023
蓝藻大量繁殖所形成的有毒水华严重威胁饮用水安全,是全球性环境问题。水库与湖泊是世界各国重要的公共给水水源之一。随着国民经济与社会的发展,湖泊富营养化加剧,藻类水华暴发频率增高,富营养化是我国湖泊的主要问题,成为制约流域社会经济持续发展的环境问题[1]。富营养化的淡水中,蓝藻是水体中水华的主要组成,蓝藻中包含了多种具有产生毒素及嗅味物质这2类代谢物的藻种[2],例如:微囊藻(Microcystisspp.)、柱孢藻(Cylindrospermosisspp.)等,会产生微囊藻毒素(microcystin, MC)、柱孢藻毒素(cylindrospermopsin, CYN)和蛤蚌毒素(saxitoxin, STX)等;鱼腥藻(Anabaenaspp.)、假鱼腥藻(Pseudanabaenaspp.)等会产生土臭素(geosmin)、2-甲基异茨醇(2-methylisoborneol, 2-MIB)等嗅味物质。当饮用水源中存在藻类毒素与嗅味物质时,除了影响饮用水的安全外,对饮用水的水质会产生影响,因此是管理及供水部门面临的重要议题。
太湖是我国受蓝藻水华暴发影响水质安全问题最突出的地区。太湖周边经济发达的重要城镇高度依赖太湖水资源,而近年来太湖却深受蓝藻水华的影响。为了有效管理太湖的水资源,基于藻蓝素及叶绿素监测的蓝藻在线自动监测系统被广泛应用,以便实时了解水体中蓝藻数量,达到预警目的。然而许多环境样品分析研究指出,同一藻种的蓝藻中,可分为具有产毒能力和不具产毒能力的蓝藻,两者不仅时常同时存在[3-5],且从形态学上无法区分[6],因此准确辨别蓝藻种类至关重要。
基于DNA的分子检测方法为环境生物监测提供了精准高效的替代技术。有别于传统生物性监测(如蓝藻显微镜镜检),实时荧光定量PCR(qPCR)技术是发展相对更为健全且能广泛运用的生物监测方法。通过专一性的引子(primer)和探针(probe),得以快速了解当下污染物种类(定性)及污染程度(定量)。因此,可依据蓝藻产生藻类毒素及嗅味物质的生化反应途径,找出合适的功能性基因,以qPCR快速定量水体中具有产生藻类毒素/嗅味物质能力的蓝藻数量,可作为分析水体中二次代谢物存在程度的依据。同时整合传统分析法(毒素的ELISA法及嗅味素的SPME-GC-MS法)与qPCR定量系统的分析结果,可找出藻类代谢物与基因量、蓝藻细胞数之间的相关性,大幅提高藻类计数的时效性[7-8],也可克服传统分析方法的缺点,如耗时过长、无法清楚区分藻种以及无法利用肉眼判断藻种是否产生毒素或嗅味物质等。
尽管分子监测技术已经取得长足进步,如何将其应用于水生态环境管理仍然面临挑战。在过去20年间,有许多研究都在利用qPCR技术定量产毒及产臭基因区段。在产MC基因方面,qPCR的分析结果与MC有良好的相关性[9-16];在产CYN基因方面,亦有许多研究都在利用qPCR来定量产毒柱孢藻的数量[11-20];而在产2-MIB基因方面,以qPCR定量产2-MIB基因的研究相对较少[21-22]。本研究重点将应用基于qPCR技术的快速分子监测技术,分析产毒微囊藻、产毒柱孢藻和产2-MIB基因;同时采用酶联免疫法(enzyme-linked immuno-sorbent assay, ELISA)分析MC和CYN这2种毒素,并用气相色谱-质谱联用法(GC-MS)分析嗅味物质2-MIB。2019年7—12月开展连续监测,建立太湖本土化水源地的相关数据库,以便实时掌握太湖水体中藻类毒素及嗅味物质的潜在风险,及时将分析结果反馈给管理部门,让管理部门有足够的时间启动紧急应变程序,为水源安全提供快速且有效的保障。
1 材料与方法(Materials and methods)
1.1 样品采集点位
根据江苏省环境监测中心针对太湖全区水质监测的例行点位进行采样,采样点位均匀分布于全湖各处(图1),总共24个采样点。太湖是典型的浅水性湖泊,采样点水深都在2 m左右,采样深度<0.5 m。由于夏季气温高,适合蓝藻大量生长,为了解不同季节蓝藻的状况及分布,2019年7—12月,每月采样1次,其中8月及9月为太湖水华好发期,因此这2个月额外增加一次采样,共8次采样。
1.2 DNA提取方法
为有效达到破坏藻体细胞壁的目的,在DNA提取前利用玻璃珠破壁技术。将10 mL样品过滤至0.22 μm的醋酸纤维滤纸后,置于1.5 mL的离心管中,而后于离心管中加入400 μL缓冲液,利用振荡器(SI-G560, Vortex-Gene 2, Scientific Industries,美国)震荡10 min,在65 ℃温度下反应10 min后,便可开始进行DNA提取。DNA的提取则选用植物基因组DNA提取微型套组(DNA-0301, Plant Genomic DNA Extraction Mini Kit,绿准生物科技有限公司,中国),最后可取得100 μL的DNA提取液。
1.3 qPCR定量系统
利用实时定量聚合酶链式反应(qPCR) (CFX Connect, Real-Time PCR Detection System, BIO-RAD,美国)进行目标基因的定量分析。qPCR操作条件:首先以95 ℃预先反应300 s,之后开始进行循环放大步骤,每次循环包括95 ℃下变性10 s、60 ℃下接合20 s,此步骤重复40个循环,并于单次循环结束后获得波长519 nm的荧光强度值。本研究采用功能性基因作为蓝藻定量标准,参照Chiu等[7, 22]的研究方法,将包含产毒微囊藻基因、产毒柱孢藻基因和产2-MIB基因,以10倍序列稀释取得各浓度标样,测定范围如表1所示。
1.4 藻类毒素的定量分析
采用商品化的盘式酶联免疫套组(ELISA Kit)(微囊藻毒PN 520012、柱孢藻毒PN 522011,Abraix LLC,美国)[23],参照套组所附的标准作业程序进行分析,用多孔吸光分光亮度仪(Multiskan FC,Thermo Scientific,芬兰)在450 nm波长下取得吸光值,并经由标准曲线回推取得MC和CYN浓度。样品分析前,先以快速冷冻破壁技术进行样品前处理,利用液态氮快速冻溶方式,确保目标微生物体得到有效破坏,使藻体内部的藻毒素完全释出到水体中,再经0.22 μm滤膜过滤,去除样品中细胞残骸等悬浮性物质,以免干扰后续分析。

图1 太湖监测点位分布图Fig. 1 Distribution map of routine monitoring points in Lake Tai
1.5 嗅味素的定量分析
参照Lin等[24]的方法,于50 mL的样品中加入15 g的氯化钠,以固相微萃取法(solid phase micro-extraction, SPME)于65oC恒温水浴下吸附30 min,将水样中嗅味物质吸附于吸附纤维上,再用GC-MS(6890/5973,安捷伦,美国),将吸附完毕的吸附针注入GC-MS,定量分析嗅味素。
1.6 分析灵敏度与质量控制
分析技术的质量控制(quality control)规范如表2所示,用以确认分析是否受到环境基质干扰。
1.7 统计分析
利用SPSS 17.0统计软件(IBM,美国)针对传统分析法与qPCR技术的结果进行线性回归分析,同时用公式(1)计算线性回归在95%置信水平下的预期区间[25]。
(1)

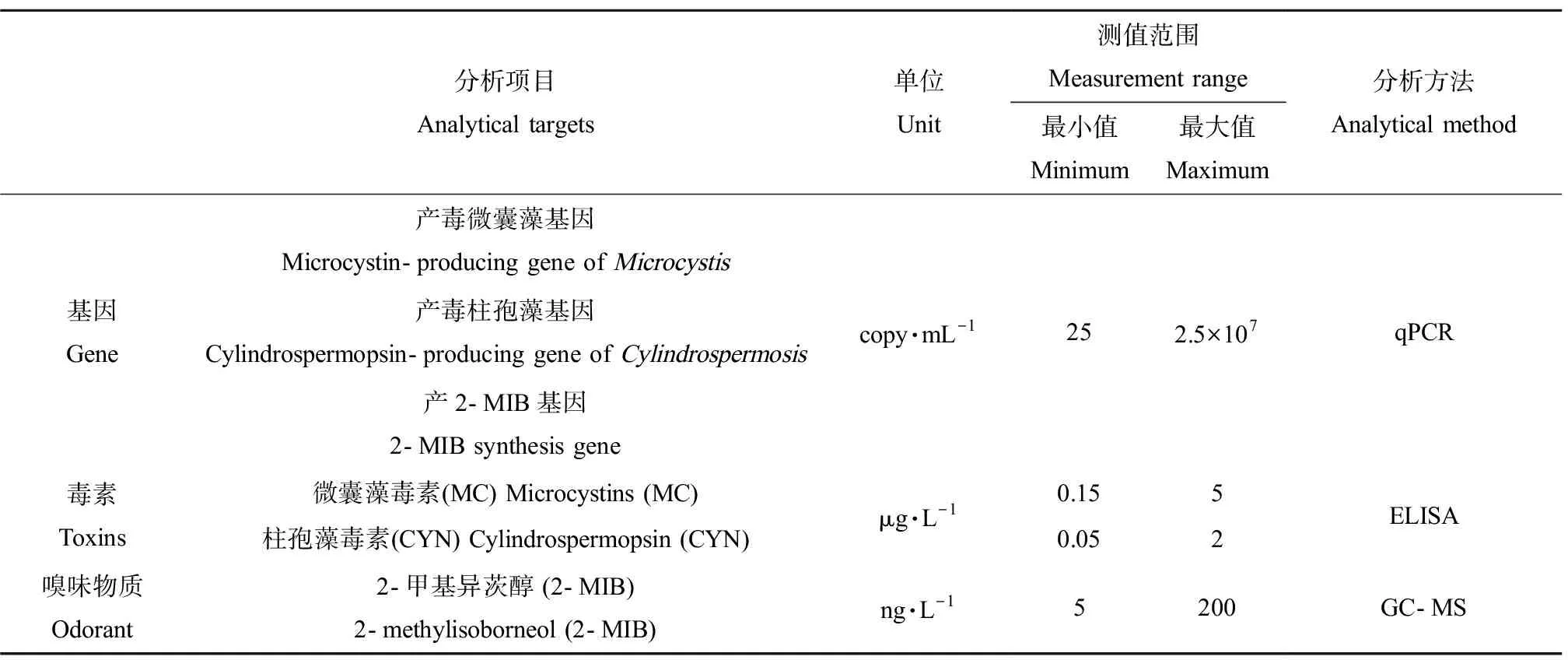
表1 分析方法测值范围Table 1 Concentration range for each analytical method

表2 样品质量控制规范Table 2 Quality control for sample measurement
利用皮尔逊相关系数γ(Pearson’s Correlation Coefficient)分析基因和藻类毒素、嗅味物质的相关性。当相关系数为0.3以下时为低相关,0.3~0.7为中等相关,0.7以上为高度相关。
2 结果(Results)
2.1 太湖蓝藻基因和代谢物的时空分布2.2.1 蓝藻产毒基因的时空分布
太湖产毒微囊藻基因的拷贝数范围为55~2.48×107copy·mL-1,平均值为7.83×105copy·mL-1。产毒微囊藻基因具有明显的时空分布特征。时间上,产毒微囊藻基因的丰度在7、8月不断上升,9月达到最高值,10—12月逐渐下降(图2(a))。空间上,产毒微囊藻基因呈现出西部最高,北部次之的空间分布特征,其中太湖西北部的竺山湖心7月的产毒微囊藻基因的拷贝数达到2.48×107copy·mL-1,北部的梅梁湾在9月上旬的产毒微囊藻基因的拷贝数达到1.24×107copy·mL-1(图3)。
太湖产毒柱孢藻基因的拷贝数介于ND~1.96×106copy·mL-1,平均值为2.99×104copy·mL-1,明显低于产微囊藻毒素基因。太湖产毒柱孢藻基因在7、8月达到最高值,9—12月逐渐下降(图2(b))。总柱孢藻基因和产毒柱孢藻基因具有相似的时间分布规律,产毒柱孢藻基因/总柱孢藻基因的比值范围为4.1%~100%,平均值为88.9%,说明绝大多数柱孢藻都含有产毒素的基因。产毒柱孢藻基因显示区域性分布差异,北部和东部的产毒藻基因的拷贝数较高,如太湖东北部的五里湖心在7—11月的藻毒素基因的拷贝数均高于3.98×104copy·mL-1(图4),明显高于其他点位。
太湖产2-MIB基因丰度介于ND~2.11×106copy·mL-1之间,平均浓度为1.52×102copy·mL-1,其浓度在7、8月维持较高水平,9月开始不断下降(图2(c))。空间上,东部(尤其东南区)的产2-MIB基因浓度较高,其中7月东南部庙港的产2-MIB基因浓度最高,8月上旬漾西港的浓度达到4.19×106copy·mL-1(图5)。
2.2.2 蓝藻毒素、嗅味物质的时空分布
MC太湖检出的平均浓度为4.1 μg·L-1,最高浓度出现在9月下旬的东部位点新塘港,达到674.47 μg·L-1,其余位点的浓度均低于10 μg·L-1。MC和产毒微囊藻基因具有相似的时空分布特征。时间上,MC在9月上旬达到最高值,之后逐渐下降。空间上,MC的平均值也呈现出以西区(尤其西北部)较高的分布格局,其中9月上旬有6个采样位点的MC浓度高于世界卫生组织推荐的标准(1 μg·L-1),均位于太湖西部和北部,竺山湖和梅梁湖的浓度最高,分别达到7.53 μg·L-1和6.22 μg·L-1。
CYN在太湖的检出范围为ND~1.5 μg·L-1,平均浓度为0.2 μg·L-1。相比产毒柱孢藻基因,CYN随着时间的变化滞后,在7—9月浓度较高,之后逐渐下降(图2(b))。CYN和产柱孢藻基因的空间分布格局相似(图4),东部和南部的浓度明显高于其他区域,其中五里湖、西山西和泽山3个点位在8月下旬检出浓度偏高,分别达到1.50、1.17和1.02 μg·L-1。
太湖2-MIB嗅味物质整体浓度范围介于ND~1 122.8 ng·L-1,平均浓度为41.2 ng·L-1。2-MIB嗅味物质和基因浓度随时间的分布一致,均在8月达到峰值,之后逐渐下降(图2(c))。2-MIB在太湖东部(尤其东南部)的浓度较高,另外7—9月在太湖北部竺山湖和梅梁湾也检出较高浓度的2-MIB(图5)。
2.2 太湖蓝藻产毒基因预测代谢产物
产毒微囊藻基因与MC浓度具有中等相关性,皮尔逊相关系数γ为0.572 (P<0.01;图6(a)),其中有95.5%的数据会落在95%的预测区间内。同样地,产毒柱孢藻基因与CYN浓度呈中等相关,其皮尔逊相关系数γ为0.504 (P<0.01;图6(b)),其中有94.8%的数据会落在95%的预测区间内。而在2-MIB方面,产2-MIB基因与2-MIB浓度有中度到强度的相关性,其皮尔逊相关系数γ为0.652 (P<0.01;图6(c)),其中有97.2%的数据会落在95%的预测区间内。由相关性分析获得的相关公式可用于后续由基因浓度判断藻类毒素或是嗅味物质浓度的主要参数。
2.3 太湖蓝藻污染的环境影响因素
总微囊藻基因与pH呈显著正相关,与电导率呈显著负相关,产毒微囊藻和MC与溶解氧均呈显著负相关。柱孢藻基因未呈现出和环境因子的显著相关性,但是柱孢藻毒素呈现出与pH显著正相关,与电导率显著负相关。产2-MIB基因和嗅味物质均呈现与温度显著正相关(表3)。

图2 各月份蓝藻基因、毒素及嗅味物质的浓度变化Fig. 2 Concentration distribution of cyanobacteria gene, toxins and odorants in different months

时间Time7月July8月上旬Early August8月下旬Late August9月上旬Early September基因/(copy·mL-1)Gene/(copy·mL-1)产毒微囊藻基因Microcystin-producing gene of MicrocystisMC时间Time9月下旬Late September10月October11月November12月December微囊藻毒素/(μg·L-1)Microcystins/(μg·L-1)产毒微囊藻基因Microcystin-producing gene of MicrocystisMC

时间Time7月July8月上旬Early August8月下旬Late August9月上旬Early September基因/(copy·mL-1)Gene/(copy·mL-1)产毒柱孢藻基因Cylindrospermopsin-producing gene of CylindrospermosisCYN时间Time9月下旬Late September10月October11月November12月December柱孢藻毒素/(μg·L-1)Cylindrospermopsin/(μg·L-1)产毒柱孢藻基因Cylindrospermopsin-producing gene of CylindrospermosisCYN
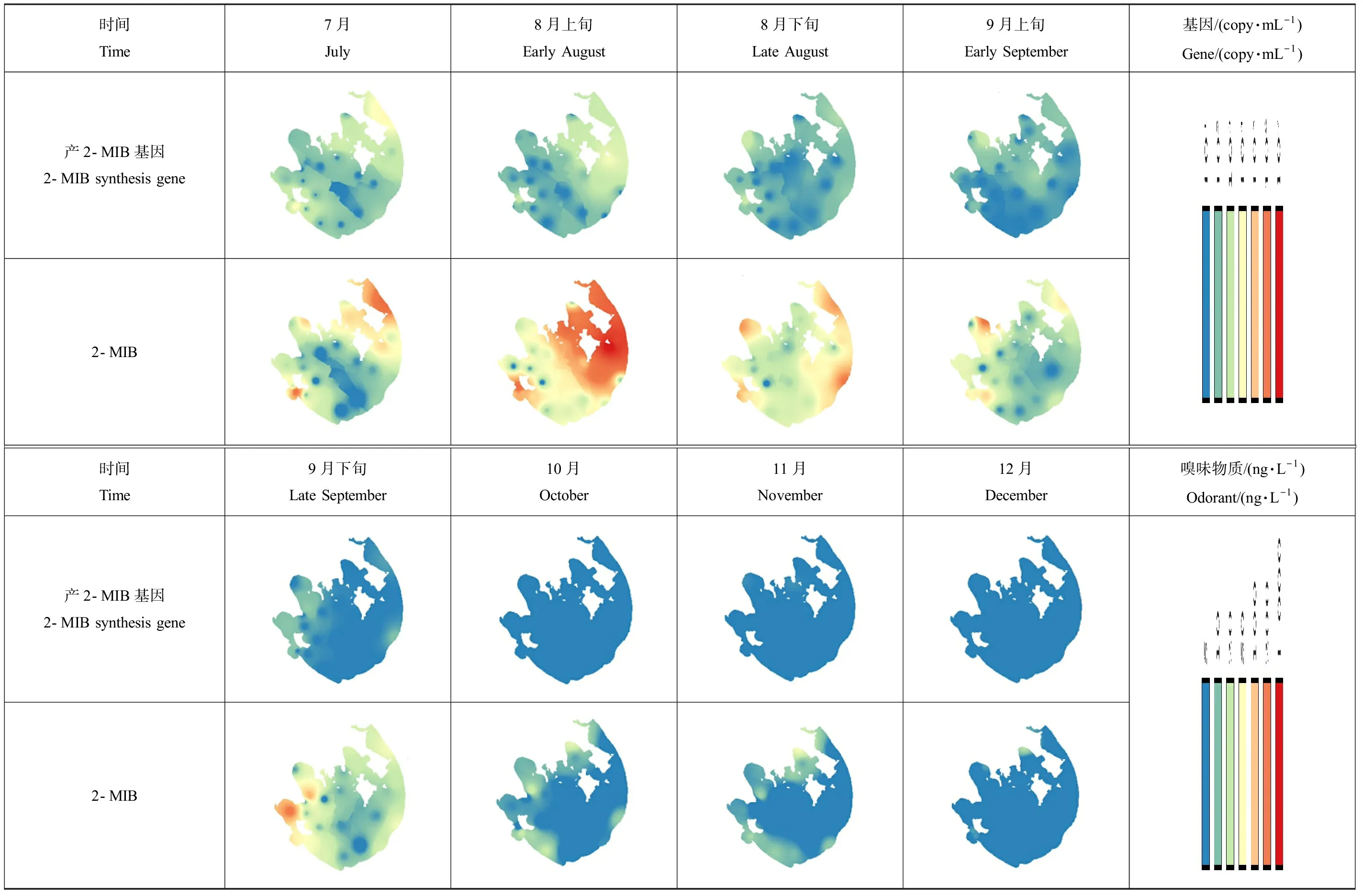
时间Time7月July8月上旬Early August8月下旬Late August9月上旬Early September基因/(copy·mL-1)Gene/(copy·mL-1)产2-MIB基因2-MIB synthesis gene2-MIB时间Time9月下旬Late September10月October11月November12月December嗅味物质/(ng·L-1)Odorant/(ng·L-1)产2-MIB基因2-MIB synthesis gene2-MIB

图6 太湖蓝藻各基因与其代谢物的相关性分析注:(a) N=177;(b) N=100;(c) N=108;基因单位为copy·mL-1,MC和CYN浓度单位为μg·L-1,2-MIB浓度单位为ng·L-1。Fig. 6 Correlation analysis of genes and metabolites of cyanobacteria in Lake TaiNote: (a) N=177; (b) N=100; (c) N=108; the units of genes were copy·mL-1, the units of concentrations of MC and CYN were μg·L-1,the units of 2-MIB concentrations were ng·L-1.
3 讨论(Discussion)
不同类型的产毒藻基因在太湖具有显著的时空分布差异。时间上,产毒微囊藻基因在9月达到浓度峰值,产毒柱孢藻和产2-MIB基因则在7、8月维持较高浓度。空间上,产毒微囊藻基因在西部(尤其西北部)的拷贝数更高,已有研究也表明,太湖西北部蓝藻水华暴发频繁,这可能由西北部的地理位置、沉积环境及入湖河流的污染等多种因素综合导致。产毒柱孢藻基因在北部和东部的拷贝数更高,产2-MIB基因则在东部(尤其东南部)的拷贝数更高。
太湖各项蓝藻产毒基因与二次代谢物具有良好相关性。蓝藻的基因和代谢产物的相关性系数反映了单位产毒基因表达转化成毒素/嗅味的能力,相关性系数越高,代表具有产毒基因的蓝藻产生毒素/嗅味的能力越强,反之亦然。太湖3种蓝藻产毒基因和其代谢产物均呈中度相关,说明基于产毒微囊藻基因的丰度可以有效预警蓝藻污染,并推测蓝藻的生成趋势。不同蓝藻基因和代谢物受环境因子的影响不同,产毒微囊藻和微囊藻毒素和溶解氧均呈显著负相关,柱孢藻毒素呈现出和pH显著正相关,和电导率显著负相关。产2-MIB基因和嗅味物质均呈现与温度显著正相关。

表3 蓝藻基因/毒素/嗅味与环境因子的相关性Table 3 Correlation between cyanobacteria genes/toxins/odorants and environmental factors
太湖蓝藻的毒素、嗅味物质和相应基因在时空上的分布格局相似。太湖产毒微囊藻基因与微囊藻毒素的线性回归模型的斜率为0.0936,与Chiu等[7]报道的斜率(0.374)[11]有差异。中国太湖产毒柱孢藻基因与柱孢藻毒素的回归斜率为0.0411 (图6(b)),有异于中国台湾地区的斜率(0.142);而在2-MIB方面,中国太湖2-MIB的回归斜率为0.291,小于中国台湾地区的斜率[22]。以上结果表明,中国太湖的产毒微囊藻、产毒柱孢藻和产2-MIB的蓝藻在生理特性与中国台湾地区的有明显的差异,中国太湖地区的斜率普遍小于中国台湾地区的,可知在同一基因水平上中国台湾地区的蓝藻毒素及嗅味问题较太湖更为严峻。
目前太湖蓝藻的研究仍集中在微囊藻及毒素方面,太湖中微囊藻毒素的平均浓度达4.1 μg·L-1,明显高于柱孢藻毒素(0.2 μg·L-1)和2-MB(41.2 ng·L-1),表明太湖蓝藻水华主要由微囊藻导致,但是柱孢藻毒素在太湖的局部区域构成低风险,其在五里湖、西山西和泽山3个点位在8月下旬检出浓度分别达到1.50、1.17和1.02 μg·L-1,超过澳洲饮用水的建议值1 μg·L-1[26-27],建议加强对太湖其他产毒蓝藻的研究。此外,太湖8月上旬和下旬分别有21个和22个点位的2-MIB浓度高于我国的建议值10 ng·L-1[28],而所有样品中有53%高于我国建议限值,最大浓度(1 123 ng·L-1)更远高于我国建议限值,为限值的112倍,说明太湖存在较高的2-MIB风险。2-MIB影响饮用水水质,且在水体中不易快速降解,建议持续关注产2-MIB基因及嗅味物质的浓度变化。
太湖的饮用水源地2-MIB风险显著高于MC和CYN。本研究共设置了5个饮用水源地点位,分别为寺前、渔洋山、金墅港、锡东水厂和庙港。相比其他采样点,饮用水源地的MC浓度较低,产毒微囊藻基因的丰度范围为55.4~1.73×106copy·mL-1,MC浓度均低于饮用水推荐浓度1 μg·L-1,其中锡东水厂和渔洋山的产毒微囊藻基因和MC浓度略高于其他饮用水点位,9月的MC浓度高于其他月份。饮用水源地的CYN浓度范围为0~0.86 μg·L-1,7、8月的浓度偏高,其中庙港和渔洋山的浓度略高于其他水源地。毒素2-MIB的浓度范围为0~412.46 ng·L-1,其中有65%的样品浓度高于我国建议限值10 ng·L-1,8、9月的浓度偏高,尤其在庙港、渔洋山和金墅港,说明太湖的饮用水源地存在较高的2-MIB风险,可能威胁到饮用水供应安全,应该重点关注。
与传统形态学相比,分子监测方法具有检测限低、检测范围广等技术优势。本研究以产毒微囊藻基因、产毒柱孢藻基因和产2-MIB基因为靶向基因,通过qPCR方法定量检测7—12月太湖产生藻类毒素/嗅味物质的蓝藻数量。qPCR技术定量蓝藻基因的检测区间为2.5 ×101~2.5×107copy·mL-1,同时提供不同功能性基因的丰度变化。结果显示,产毒微囊藻基因的平均拷贝数最高,达到7.83×105copy·mL-1,产毒柱孢藻基因次之(2.99×104copy·mL-1),产2-MIB基因的拷贝数较低,为1.52×102copy·mL-1。总微囊藻的基因拷贝数(16S rDNA基因检测)随时间变化趋势与产毒微囊藻的基本一致,每月检测到的产毒微囊藻基因均低于总微囊藻的,说明自然水体中同一蓝藻物种的有毒和无毒菌株通常共存。产毒微囊藻基因/总微囊藻基因的比值为7.6%~35.9%,说明仍有高丰度的微囊藻菌株不具有产藻毒素的潜力。相反,产毒柱孢藻基因/总柱孢藻基因的比值范围为4.1%~100%,平均值为88.9%,说明绝大多数柱孢藻都含有产毒素的基因。因此,采用产毒基因的拷贝数预测藻种的产毒能力更加准确。
本研究通过qPCR技术对太湖的3种关键产毒基因进行连续系统的监测与分析,发现产毒基因和基于传统方法监测的毒素、嗅味浓度具有较高的相关性,证明基于DNA的分子检测方法可快速准确地对产毒藻进行监测和预警,为管理部门进行蓝藻水华风险评估和管理提供技术和数据支撑,对保障该区域的饮用水安全具有重要意义。

