天然有机质对TiO2纳米颗粒与PCB-77藻类毒性影响及致毒机理
李青,张帅,*,王济
1. 贵州师范大学地理与环境科学学院,贵阳 550025 2. 贵州省喀斯特山地生态环境国家重点实验室培育基地,贵阳 550025
随着纳米技术的快速发展,纳米材料被广泛运用于农业、工业和生活中。其中纳米二氧化钛(TiO2)是应用最广泛纳米材料之一,被用于化妆品、医药、涂料、遮光剂和水处理等领域[1-2],大量的使用及生产,纳米TiO2不可避免地进入水环境中。多氯联苯(polychlorinated biphenyls, PCBs)是一种持久性有机污染物,在环境中能持久存在、远距离迁移和生物蓄积等。PCBs不仅具有生殖毒性、免疫毒性、神经毒性、内分泌干扰作用和潜在的致癌作用[3],而且会造成细胞氧化损伤和基因毒性[4-5]。天然有机质(natural organic matter, NOM)由腐殖质和富里酸等腐殖酸类物质和非腐殖酸类物质组成[6],广泛存在自然水体中。这几种物质在水环境中迁移、转化和发生相互作用,通过食物链间的传递,会对水生生物产生毒性甚至影响整个生态系统。
水生生态系统复杂多变,纳米TiO2进入水环境后与有机污染物及NOM复合效应及其机理不明,因此,对二者的复合效应及其潜在机理的研究十分必要。纳米TiO2对小球藻的毒性主要归因于氧化压力、物理损伤及遮光效应等,此外,纳米TiO2在水环境中易发生团聚[7],吸附在藻细胞表面并抑制其生长,这与先前研究纳米Al2O3对藻类的毒性效应一致[8],纳米材料团聚体会对藻细胞产生一定的遮光效应,进而抑制藻类光合作用从而影响其生长,这也是纳米材料对藻类致毒机制之一。水体中广泛存在的NOM会与纳米TiO2相互作用,改变其物理化学性质及胶体行为,进而影响藻类毒性。有研究表明,腐殖酸能通过减少活性氧(reactive oxygen species, ROS)生成及物理损伤降低纳米TiO2对藻类的毒性[9]。有机污染物的细胞毒性主要归因于与生物大分子和细胞器的相互作用,从而影响细胞的生长和代谢[10],例如,氯苯和PCBs引起内分泌紊乱、DNA损伤、电子转移与生物大分子相互作用[11]。高强光促使阿特拉津提高藻细胞丙二醛(malondialdehyde, MDA)含量,引起脂质过氧化[12]和抑制叶绿体光系统Ⅱ的电子转移和固碳[13]。因此,理论上来说纳米TiO2和PCBs对生物有不同的毒性效应和致毒机理。
小球藻是自然水体中主要的初级生产者,具有繁殖能力强、生长周期短、体积小,对多种毒物敏感、可直接在细胞水平上观察等特点,常作为受试生物来评估污染物对水生生物的毒性。目前,NOM对纳米TiO2与3,3’,4,4’-四氯联苯(3,3’,4,4’-tetrachlorobiphenyl, PCB-77)藻类毒性影响的相关研究很少,其致毒机理未得到阐明。本文通过纳米TiO2与PCB-77单独及复合暴露在NOM存在与不存在条件下,考察其对小球藻生长的影响和氧化损伤及其团聚沉降。采用透射电子显微镜(transmission electron microscope, TEM)、红外差谱和实时定量PCR等方法从亚细胞和分子水平上揭示NOM对纳米TiO2与PCB-77的藻类毒性影响及致毒机理。
1 材料与方法(Materials and methods)
1.1 化学品和生物
蛋白核小球藻(Chlorellavulgaris, FACHB-9)购于中国科学院武汉水生生物研究所淡水藻种库,用经济合作与发展组织(Organization for Economic Co-operation and Development, OECD)推荐培养基在智能培养箱(广州韶关市广智科技设备有限公司,GZ-250-GI)中培养。纳米TiO2为锐钛型,粒径为5~10 nm,纯度为98%,购于浙江弘晟材料科技股份有限公司。NOM在国际腐殖质协会(International Humic Substances Society, IHSS)获得,编号为2R101N。纯度为99%的PCB-77购买于上海阿拉丁生化科技股份有限公司。
1.2 NOM对纳米TiO2与PCB-77单独和复合暴露对小球藻毒性的影响
将处于对数生长期的小球藻置于250 mL锥形瓶中培养繁殖,锥形瓶置于光照恒温摇床中培养,瓶中为100 mL含有不同污染物的OECD培养基。整个实验在110 r·min-1的摇床中进行,未添加藻种时溶液中未沉淀的纳米TiO2浓度在80%以上。培养条件为(25±0.5) ℃、110 r·min-1、光照度为(100±5) μE·m-2·s-1、光暗比为14 h∶10 h。藻的初始浓度设置为2×105cells·mL-1,暴露96 h后,在光学显微镜(南京江南永新光学有限公司,BM1000)下用血球计数板对小球藻计数,得到各污染物对小球藻的96 h剂量-效应关系曲线,并用线性内插法计算出各污染物96 h半数抑制浓度(96 h-IC50)。
藻类生长抑制率实验分为2个部分。(1)测定小球藻的单独毒性效应。纳米TiO2和PCB-77的浓度分别为0~30 mg·L-1和0~0.01 mg·L-1,同时设置空白对照组(CK)。(2)测定纳米TiO2与PCB-77复合暴露时,NOM对小球藻毒性的影响。①NOM浓度固定为10 mg·L-1(预实验得出在NOM对小球藻无毒性情况下,对纳米TiO2和PCB-77毒性影响最大浓度),改变纳米TiO2的浓度(4、8、12、16、20和30 mg·L-1),测定NOM对纳米TiO2藻类毒性的影响。②PCB-77在溶解度范围内对小球藻的生长抑制率低于50%(单独毒性实验得出),因此PCB-77与纳米TiO2复合毒性实验初始浓度配比为(0a, 0c)、(0.2a, 0.2b)、(0.4a, 0.4b)、(0.6a, 0.6b)、(0.8a, 0.8b)和(a, b)。其中,a、b分别为纳米TiO2的参比浓度(IC50附近)和PCB-77的参比浓度(最大溶解浓度),分别为20 mg·L-1和0.01 mg·L-1。测定纳米TiO2与PCB-77复合暴露对小球藻的毒性。③在②的基础上添加NOM(10 mg·L-1),测定纳米TiO2与PCB-77复合暴露时添加NOM对小球藻生长的影响。每24 h对消耗的PCB-77进行补充。
1.3 NOM、纳米TiO2和PCB-77与藻细胞自沉降和共沉降实验
为了探究不同暴露条件下小球藻沉降情况。暴露条件和藻类毒性实验的相同,纳米TiO2、PCB-77和NOM的初始浓度分别为16、0.008和10 mg·L-1,小球藻初始浓度用660 nm处吸光度(A660)表示,为0.2。用紫外分光光度计(上海元析仪器有限公司,UV-5500)于660 nm波长处测定各悬浮液的吸光度(A)随时间的变化(总沉降时间12 h)。计算出不同时间点的吸光值与初始吸光值(A0)的比值A/A0,得到A/A0随时间的变化规律,绘制出各暴露组自沉降与共沉降曲线,从而得到NOM存在与不存在时PCB-77对纳米TiO2与小球藻自沉降与混合共沉降的影响。
1.4 小球藻细胞氧化损伤的测定
实验测定不同暴露条件下培养24 h藻细胞中ROS、MDA、超氧化物歧化酶(superoxide dismutase, SOD)和过氧化氢酶(catalase, CAT)。暴露条件和小球藻初始浓度与毒性实验的相同,物质的初始浓度与沉降实验的相同。MDA含量与生物体受到的氧化损坏伤密切相关,用硫代巴比妥酸测定MDA的含量[14]。用氧化敏感探针5(6)-氯甲基-2’,7’-二氯荧光素二乙酸酯(5-(and-6)-chloromethyl-2’,7’-dichlorouorescein diacetate, CM-H2DCFDA)测定小球藻细胞内ROS[15]。SOD和CAT是生物体的抗氧化酶,SOD是抵御机体氧化损伤的第一道防线,CAT可促使生物机体内的H2O2分解为氧和水,使机体细胞免受H2O2的氧化损伤,消除过量的ROS,维持细胞内氧化还原平衡。测试按照SOD和CAT试剂盒说明进行(南京建成生物工程研究所)。
1.5 透射电镜观察
暴露条件和小球藻初始浓度与毒性实验的相同,物质的初始浓度与沉降实验的一样。培养24 h的小球藻细胞在戊二醛中固定、脱水、包埋和切片后,使用TEM(JEM-1230,日本电子公司)观察细胞形态的变化[14]。
1.6 红外差谱
傅里叶红外光谱(Fourier transform infrared spectrometer, FTIR)分析不同暴露条件下藻细胞有关化学组分的变化。暴露条件和小球藻初始浓度与毒性实验的相同,物质的初始浓度与沉降实验的相同。培养96 h后用密度平衡法分离[16]藻细胞与游离纳米颗粒,将收集到的藻细胞用磷酸盐缓冲液(PBS, pH=7.0)冲洗3遍后,冷冻干燥得到待测藻粉。1 mg待测藻粉与100 mg KBr混合研磨压片,用红外光谱仪(Thermo Scientific Nicolet IS5,美国)进行测定,设置分辨率4 cm-1,在4 000~400 cm-1波数范围内扫描32次,用OMINIC软件对得到的红外光谱进行基线校正及归一化处理后,进行差谱分析。
1.7 基因测定
设置空白对照(CK)、PCB-77和纳米TiO2复合暴露(NOM存在与不存在)实验组,培养条件和小球藻初始浓度与毒性实验的相同,物质的初始浓度与沉降实验的相同,培养96 h后,离心(4 000 r·min-1、5 min、4 ℃)收集藻细胞,并用PBS(pH=7.0)清洗2遍。使用UNIQ-10柱式TRIzol总RNA抽提试剂盒(B511321,生工生物工程(上海)股份有限公司)提取总RNA,具体实验操作参考该产品说明书。测定提取的RNA在230 nm、260 nm和280 nm处吸光值,并计算RNA的浓度。当A260/A280比值在1.8~2.2之间,且A260/A230比值介于2.0~2.4之间时,说明RNA纯度较高。选取了13个目的基因,详细信息如表1所示。cDNA第一链合成是在水浴的nuclease-free PCR管中进行相应的反应后,再在PCR仪上按照相应的条件进行反转录反应。实时荧光定量PCR在Step One Plus型荧光定量PCR仪(ABI公司,美国)上进行。actin作为内参基因,相对表达含量是依据内参actin换算的,计算公式为2-ΔΔCp[17]。
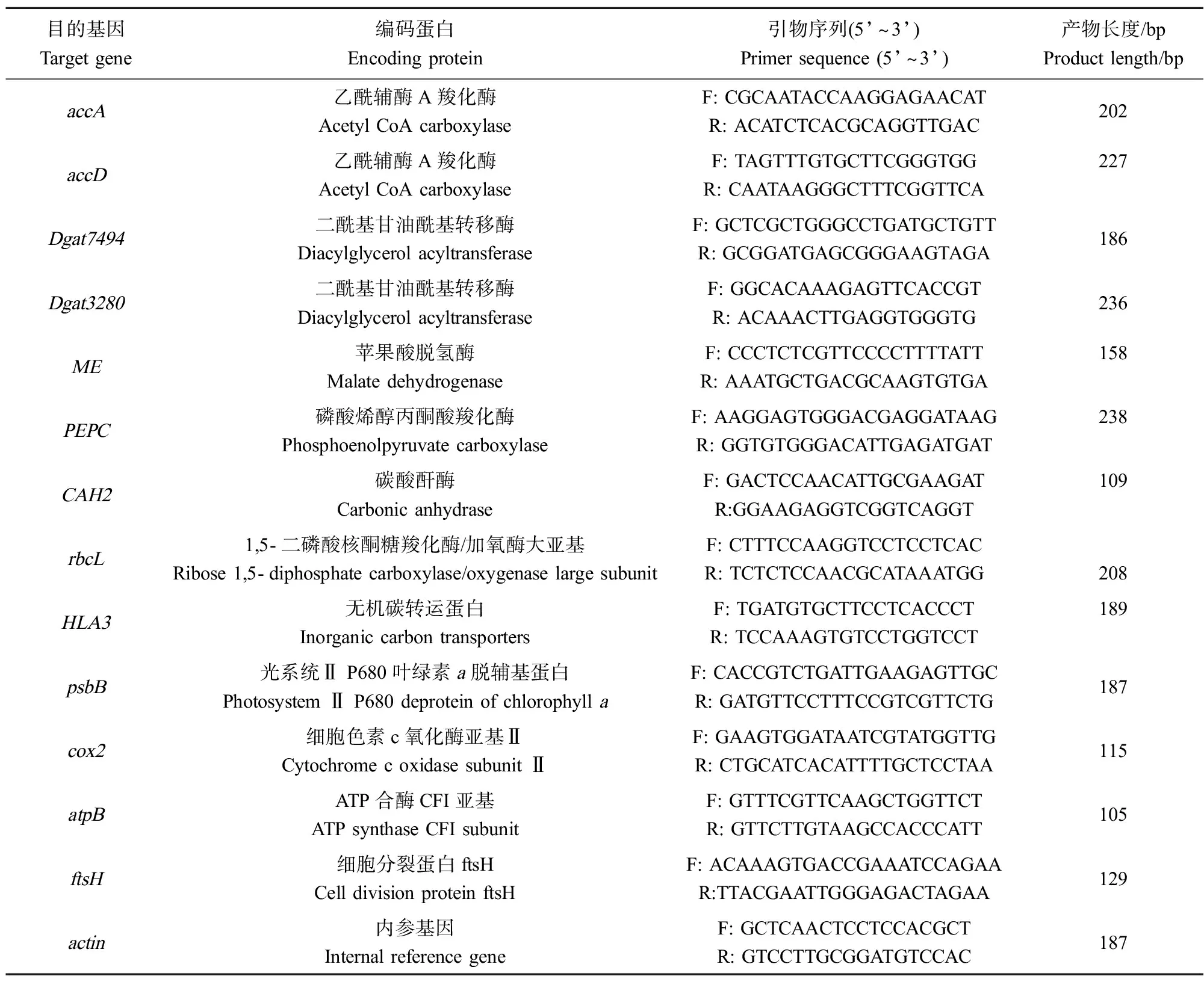
表1 目的基因的引物序列[18-19]Table 1 Sequences of primer pairs used for real-time PCR [18-19]
1.8 数据处理
本研究所有样品均设置3个平行,实验数据均使用Excel 2016进行整理及计算,在SPSS 22.0中进行单因素ANOVA方差分析及Dancan多重比较法(差异性水平为P<0.05),实验数据绘图使用Origin 2017完成。
2 结果(Results)
2.1 NOM、纳米TiO2和PCB-77对小球藻生长的影响
由图1(a)可知,PCB-77和纳米TiO2单独胁迫小球藻96 h的生长抑制率分别为19.28%和64.00%,纳米TiO2对小球藻96 h-IC50是22.30 mg·L-1。纳米TiO2浓度越高对小球藻产生的生长抑制率越高,高浓度(30 mg·L-1)培养96 h后的小球藻,藻细胞发黄,锥形瓶底部有藻细胞沉底,且有藻细胞黏附在瓶壁上,这限制了藻细胞的游动,培养体系间的营养物质和气体交换也可能受到影响。由图1(b)所示,NOM使纳米TiO2对小球藻的毒性降低,降低的最大百分比是7.67%。由图1(c)可知纳米TiO2与PCB-77复合暴露对藻细胞生长的影响,添加NOM后小球藻的生长抑制率显著增加,增大的最大百分比为9.97%。
2.2 NOM、纳米TiO2和PCB-77对小球藻团聚沉降的影响
由图2(a)所示,单独的藻细胞与NOM存在下藻细胞的沉降曲线几乎重合,表明NOM对藻细胞的自沉降影响可以忽略,但PCB-77单独胁迫时,小球藻沉降速率加快,说明PCB-77对小球藻有一定的毒性。由图2(b)所示,PCB-77对纳米TiO2的自沉降无显著影响,PCB-77对纳米TiO2悬浮液稳定性及分散性能无显著影响[20],添加NOM后,纳米TiO2和PCB-77沉降速率略微加快。由图2(c)所示,纳米TiO2与小球藻的共沉降效应非常明显,它们之间发生了明显的团聚,纳米TiO2包裹在小球藻表面,加快了沉降速率。PCB-77对纳米TiO2与小球藻的共沉降速率无显著影响,虽然PCB-77对小球藻自沉降速率有影响,但并不足以影响纳米TiO2与小球藻的共沉降速率,因为纳米TiO2与小球藻的接触异团聚效应较强,且团聚体较大,共沉降速率较快。添加NOM后,纳米TiO2与PCB-77和小球藻沉降速率加快。
2.3 NOM、纳米TiO2和PCB-77对藻细胞氧化损伤的影响
如图3(a)和3(b)所示,MDA含量的变化趋势与ROS的变化趋势基本一致,暴露在纳米TiO2悬浮液中,ROS和MDA的含量最高,说明藻细胞在纳米TiO2的作用下,发生了脂质过氧化造成氧化损伤,破坏了细胞完整性。添加NOM后,藻细胞内ROS和MDA含量显著降低,可能是因为NOM覆盖在纳米TiO2表面,通过物理阻塞减少了纳米颗粒与藻细胞的接触,从而缓解了纳米TiO2对藻细胞的氧化损伤。Lin等[9]报道腐殖酸能显著降低纳米TiO2引起的MDA含量。PCB-77单独胁迫和加入NOM后,与空白实验组相比藻细胞中ROS和MDA含量变化都不大,说明PCB-77和NOM对藻细胞内ROS和MDA含量的影响不大。PCB-77组在加入NOM后SOD和CAT活性显著升高,推测可能是由于PCB-77与NOM结合物对小球藻细胞内SOD和CAT活性有显著诱导作用,导致SOD和CAT基因编码改变,使SOD和CAT活性升高[21]。复合暴露中ROS与MDA含量比单独PCB-77胁迫时高,说明纳米TiO2是引起藻细胞内ROS和MDA含量变化的主力,添加NOM后与空白对照组相比较ROS和MDA含量升高较少,说明氧化损伤不是该复合暴露组的主要致毒机理。
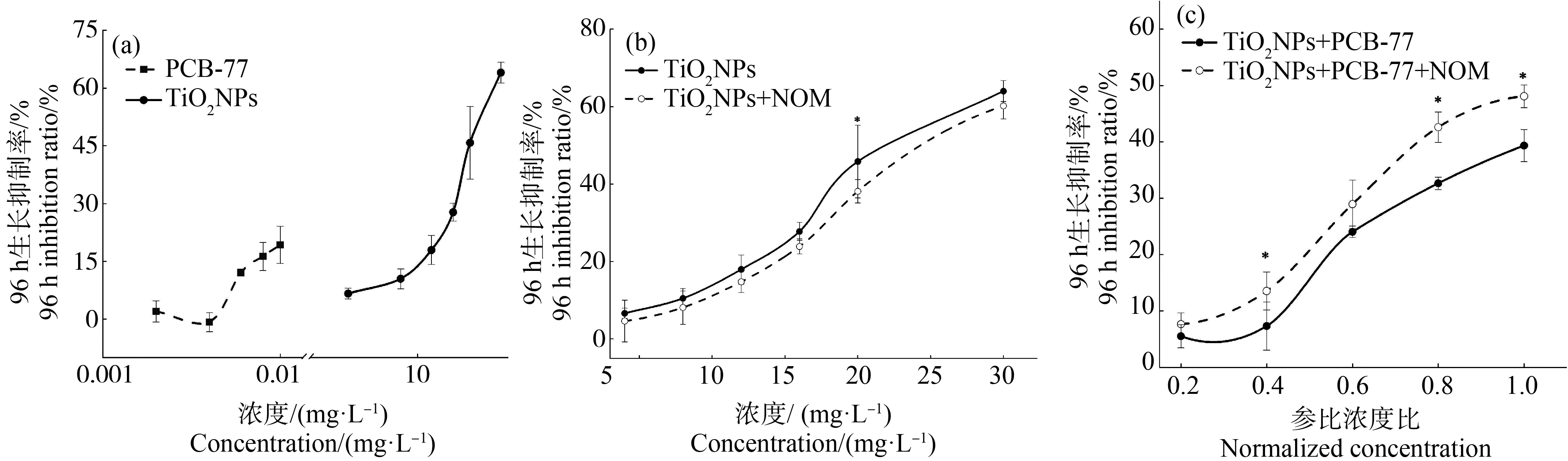
图1 各污染物单独及复合暴露对小球藻的96 h生长抑制剂量-效应曲线注:PCB-77为3,3’,4,4’-四氯联苯,TiO2 NPs为纳米二氧化钛,NOM为天然有机质;(a) PCB-77和TiO2 NPs对小球藻的96 h生长抑制 剂量-效应曲线,(b) NOM存在与不存在条件下TiO2 NPs单独暴露时小球藻的96 h生长抑制剂量-效应曲线,(c) NOM存在与不存在 条件下TiO2 NPs和PCB-77复合暴露对小球藻的96 h生长剂量-效应曲线;*表示显著性差异(P<0.05)。Fig. 1 The dose-effect curve of 96 h growth inhibition of Chlorella vulgaris by various pollutants alone or combinedNote: PCB-77 is 3,3’,4,4’-tetrachlorobiphenyl, TiO2 NPs is nano-TiO2 and NOM is natural organic matter; (a) 96 h growth inhibition dose-effect curve of PCB-77 and TiO2 NPs on Chlorella vulgaris; (b) 96 h growth inhibition dose-effect curve of TiO2 NPs on Chlorella vulgaris alone with or without NOM; (c) 96 h growth dose-effect curve of Chlorella vulgaris exposed to both TiO2 NPs and PCB-77 with or without NOM; *means significant difference (P<0.05).
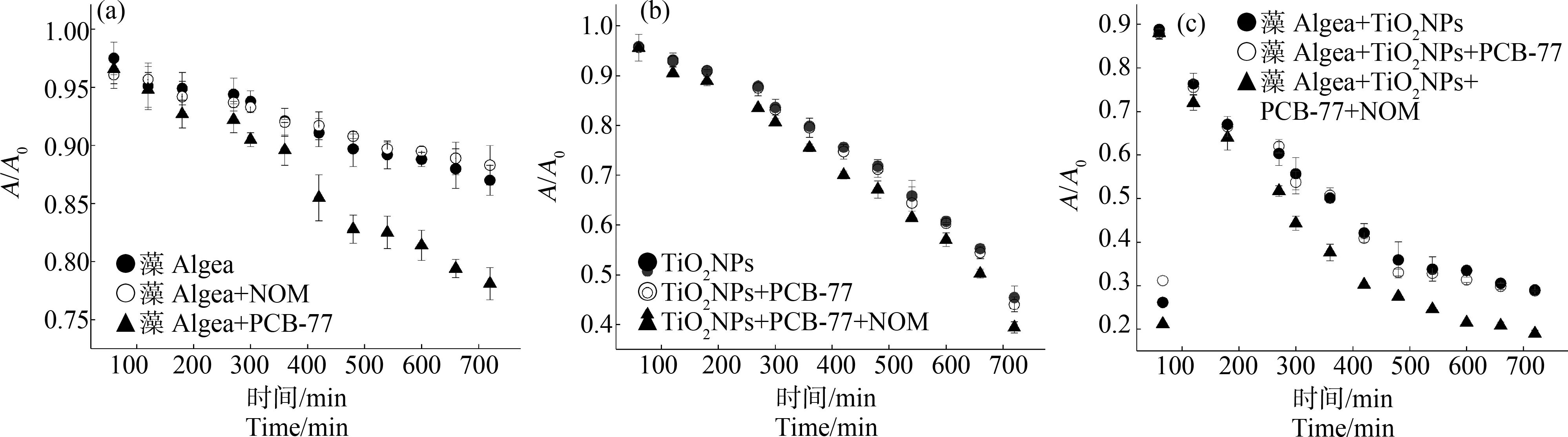
图2 各污染物单独及复合暴露对小球藻自沉降和共沉降的影响注:(a) PCB-77、NOM对小球藻沉降的影响;(b) PCB-77、NOM对纳米TiO2沉降的影响;(c) PCB-77、NOM对纳米TiO2和小球藻共沉降的影响。Fig. 2 Effects of single and combined exposure of various pollutants on the self-sedimentation and co-sedimentation of Chlorella vulgarisNote: (a) Effects of PCB-77 and NOM on Chlorella vulgaris sedimentation; (b) The effects of PCB-77 and NOM on the deposition of nano-TiO2; (c) The effect of PCB-77 and NOM on the co-sedimentation of nano-TiO2 and Chlorella vulgaris.
生物体有自我调节能力,在氧化压力增大时,SOD与CAT的活性将提高以缓解氧化压力[22]。因此CAT和SOD的活性与细胞受到的氧化压力有关,当氧化压力胁迫过高,CAT和SOD也不能完全消除氧化压力,将产生氧化损伤,当氧化损伤达到一定程度,SOD与CAT的活性下降,细胞内ROS积累更多,细胞逐渐受损凋亡。如图3(c)和3(d)所示,藻细胞内SOD和CAT活性与MDA和ROS含量有较好的相关性,细胞所受氧化压力较大时,SOD和CAT活性由于细胞的氧化应激而升高;MDA和ROS含量较少时,SOD和CAT也相对较低。
2.4 NOM、纳米TiO2和PCB-77对小球藻细胞结构变化的影响
图4为不同处理条件下藻细胞透射电镜图,空白对照组的藻细胞结构完整,细胞膜和细胞壁紧密结合,淀粉粒和脂滴等能量物质比较丰富。藻细胞单独暴露在纳米TiO2悬浮液中出现了质壁分离和细胞膜破损,纳米TiO2能使藻细胞的细胞壁和细胞膜完整性受到破坏并且能使藻细胞的形态发生改变,这与先前研究一致[23],暴露在含有NOM的纳米TiO2悬浮液中的细胞形态相比较于单独暴露在纳米TiO2悬浮液中的细胞损伤更小,这与NOM降低纳米TiO2的藻类毒性结果相符。PCB-77对小球藻细胞形态影响较小,PCB-77与纳米TiO2复合暴露中,藻细胞外附着大量纳米TiO2,细胞器结构不清晰,并出现电子致密体,添加NOM后细胞器结构更加不清晰,出现了较大的空泡结构。有纳米TiO2存在的实验组藻细胞内均出现含有电子致密体和空泡的结构,而这些电子致密体和空泡结构在其他实验组中并未出现,因此可以判断主要是由纳米TiO2暴露造成。推测也可能是藻细胞对纳米TiO2的胞吞行为或对进入到细胞内的纳米TiO2及被纳米TiO2伤害细胞器的胞吐行为引起的。
2.5 NOM、纳米TiO2和PCB-77对藻细胞化学组成的影响
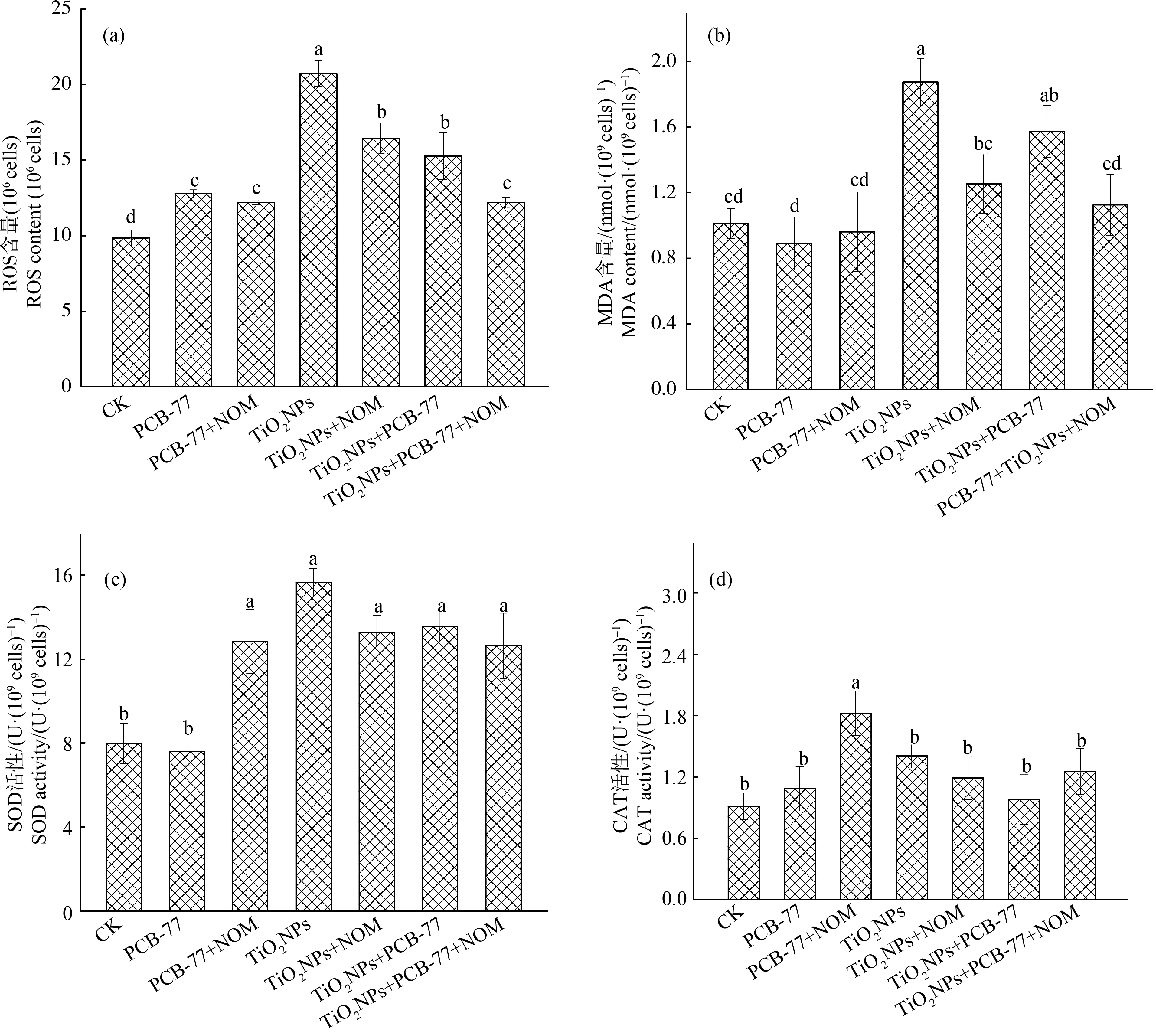
图3 各污染物单独及复合暴露对小球藻氧化损伤的影响 注:CK为空白对照组,24 h藻细胞内(a)活性氧(ROS)、(b)丙二醛(MDA)、(c)超氧化物歧化酶(SOD)和(d)过氧化氢酶(CAT)的测定值; 不同字母差异有统计学意义(P<0.05)。Fig. 3 Effects of single and combined exposure of pollutants on oxidative damage of Chlorella vulgarisNote: CK is blank control group; the intracellular (a) reactive oxygen species (ROS), (b) malondialdehyde (MDA), (c) superoxide dismutase (SOD) and (d) catalase (CAT) were measured at 24 h; the difference of different letters was statistically significant (P<0.05).
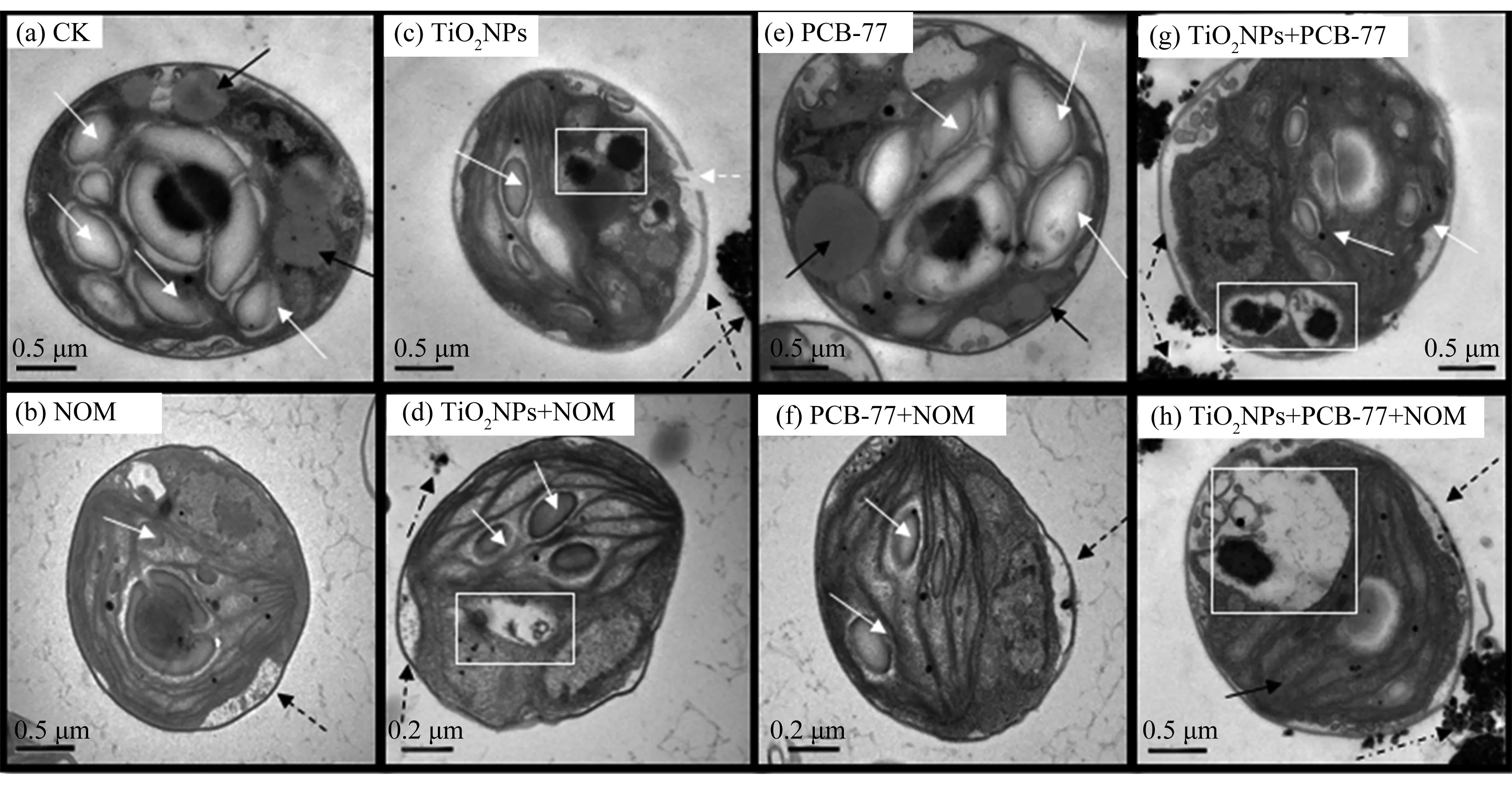
图4 各种污染物单独及复合暴露24 h后小球藻的TEM照片注:图中白实线、黑实线、白虚线、黑虚线和黑点划线箭头分别指向淀粉粒、脂滴、细胞破损处、质壁分离处和粘附 在细胞壁上的纳米TiO2,白色方框为电子致密体和空泡结构。Fig. 4 TEM images of Chlorella vulgaris exposed to various pollutants for 24 hNote: The arrows with white solid line, black solid line, white dashed line, black dashed line and black dotted line point to starch granules, lipid droplets, cell damage, plasma wall separation and nano-TiO2 adhered to cell wall respectively; the white box shows electron dense body and vacuole structure.
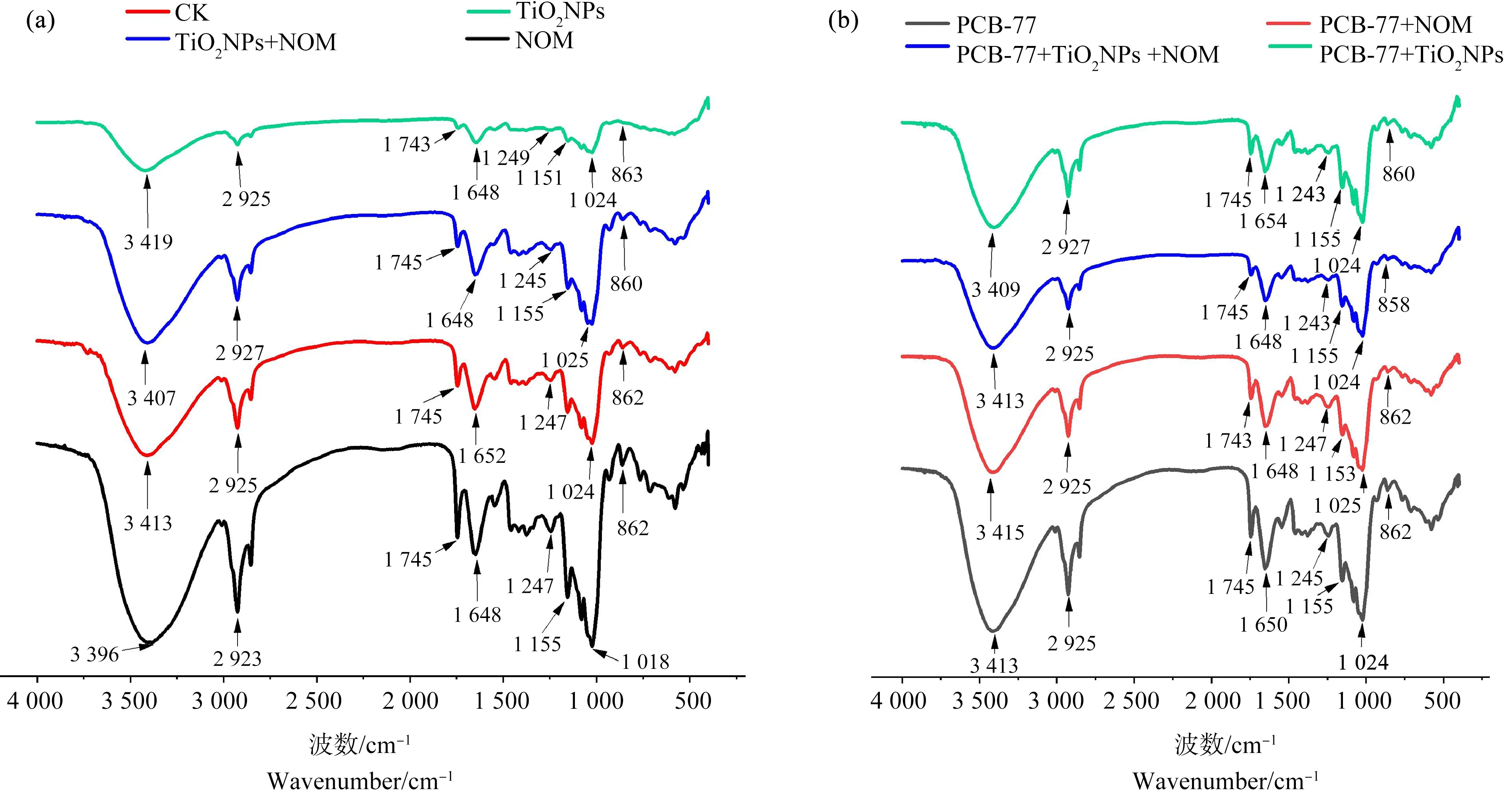
图5 各种污染物单独及复合暴露组小球藻的红外差谱注:(a) NOM存在与不存在条件下纳米TiO2单独暴露组和空白组藻细胞的红外差谱;(b) NOM存在与不存在条件下PCB-77单独 和纳米TiO2复合暴露组藻细胞的红外差谱。Fig. 5 Infrared difference spectra of Chlorella vulgaris exposed to various pollutants alone or in combinationNote: (a) Infrared difference spectrum of algae cells exposed to nano-TiO2 with or without NOM; (b) Infrared difference spectrum of algae cells exposed to PCB-77 with or without NOM.
2.6 NOM、纳米TiO2和PCB-77对藻细胞基因表达的影响
在NOM存在或不存在条件下,纳米TiO2与PCB-77复合暴露对藻细胞内13个基因表达的影响如图6所示。所选基因参与调控藻细胞的脂肪合成、光合作用、细胞呼吸及细胞分裂。乙酰CoA羧化酶和二酰基甘油基转移酶分别为催化TAG合成的第一步和最后一步关键步骤,如图6所示,纳米TiO2和PCB-77复合暴露中,基因accA、accD、dgat7494和dgat3280表达量下降,说明纳米TiO2和PCB-77复合处理藻细胞抑制TAG的合成与积累,添加NOM后,此相关基因accA、accD、dgat7494和dgat3280表达量显著上升,NOM能促进TAG的合成与积累。复合暴露组中基因ME的表达量都显著上调,说明苹果酸向丙酮酸的转化加快,导致苹果酸含量降低,NOM使苹果酸含量下降更加迅速。磷酸烯醇式丙酮(PEP)酸羧化酶固定CO2产生草酰乙酸(OAA),经NADP专一的苹果酸脱氢酶催化形成苹果酸。在细胞叶绿体中的NADP苹果酸酶催化形成丙酮酸和释放CO2,CO2通过卡尔文环固定产生3-磷酸甘油酸(PGA),再转化为糖和淀粉。NOM使基因PEPC表达量显著下降表明藻细胞中苹果酸没有得到及时补充,使藻细胞中糖和淀粉含量降低。CAH2和rbcL这2种基因主要参与光合作用的碳固定反应,不同暴露组中藻细胞内这2个基因的表达量均显著降低,参与光合作用光反应的基因psbB
的表达量变化不大,编码无机碳转运蛋白基因HLA3的表达量显著下降,参与ATP合成的叶绿体基因atpB略微下降,这几种基因表达量下降表明纳米TiO2与PCB-77复合暴露在NOM存在或不存在条件下都抑制了藻细胞光合作用。cox2表达量降低,细胞色素C氧化酶是线粒体内膜上呼吸功能链末端的特征峰,参与氧化磷酸化过程,说明线粒体呼吸功能受到影响。细胞分裂蛋白基因ftsH表达量下降,表明纳米TiO2与PCB-77复合暴露影响了小球藻分裂。可见纳米TiO2与PCB-77复合暴露在NOM存在或不存在条件下均抑制或破坏小球藻光合作用、细胞呼吸和细胞分裂,导致ATP合成减少,进而产生细胞毒性。
3 讨论(Discussion)
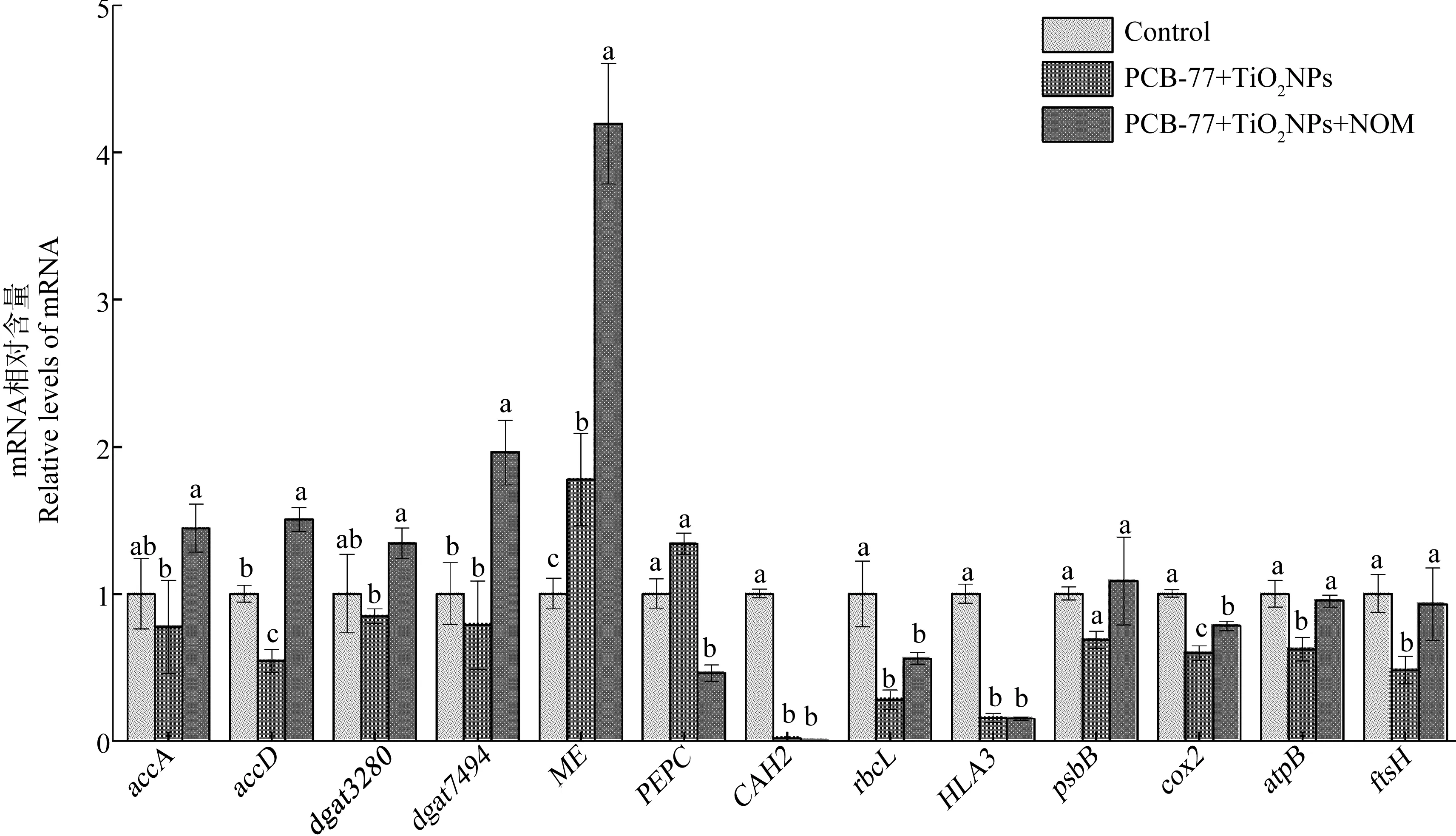
图6 NOM存在与不存在条件下纳米TiO2和PCB-77复合暴露对藻细胞内13个基因的mRNA相对含量的影响注:不同字母表示差异有统计学意义(P<0.05)。Fig. 6 The mRNA relative levels of 13 genes in algal cells with and without NOM exposed to nano-TiO2 and PCB-77Note: Different letters indicate statistically significant differences (P<0.05).
纳米颗粒与藻细胞的团聚沉降可影响小球藻的生长速率,这也是纳米材料对藻类致毒机理之一[14]。纳米TiO2在水环境中易发生团聚,在与小球藻共暴露的过程中,纳米TiO2团聚体吸附到藻细胞表面,对藻细胞有一定的缠绕作用,限制了藻细胞的游动,使细胞间产生相互遮蔽,阻碍藻细胞对营养物质及光的吸收,进而加快藻细胞团聚沉降,影响藻细胞的生长。这与纳米TiO2对月牙藻的毒性作用机理一致[32]。纳米TiO2与PCB-77复合暴露中NOM存在加快小球藻沉降,团聚体包裹着小球藻,抑制小球藻的光合作用,影响藻细胞呼吸,进而产生细胞毒性,与实时定量PCR检测基因结果相符。从TEM照片中看出,复合暴露中藻细胞外包裹有大量的纳米TiO2,藻细胞内细胞器结构不清晰,并且出现电子致密体,NOM存在使藻细胞质壁分离严重并出现空泡结构,红外差谱分析中,纳米TiO2与PCB-77单独及复合暴露在NOM存在时引起小球藻脂质、糖类和蛋白质结构的变化,因此,推测复合污染物与小球藻直接接触是导致毒性的一个重要原因。小球藻在受到污染物胁迫时会直接产生大量的ROS造成藻细胞氧化损伤,当细胞内ROS含量过高时,会与细胞膜组织或细胞器膜脂质发生脂质过氧化,同时细胞也会产生抗氧化酶SOD和CAT来缓解细胞氧化损伤,但当ROS含量过高时,抗氧化酶也不能完全消除氧化压力,从而引起藻细胞的细胞膜和细胞壁损伤,发生质壁分离现象。研究表明,增大细胞氧化胁迫是纳米TiO2致毒机理之一,且随纳米TiO2浓度增加细胞受到氧化胁迫增加[33],纳米TiO2与PCB-77复合暴露在NOM存在条件下,与空白对照组相比ROS和MDA含量变化不显著,推测氧化损伤不是该复合组的主要致毒途径,该复合组对小球藻生长的影响主要是团聚沉降产生的遮蔽效应及接触性物理损伤。
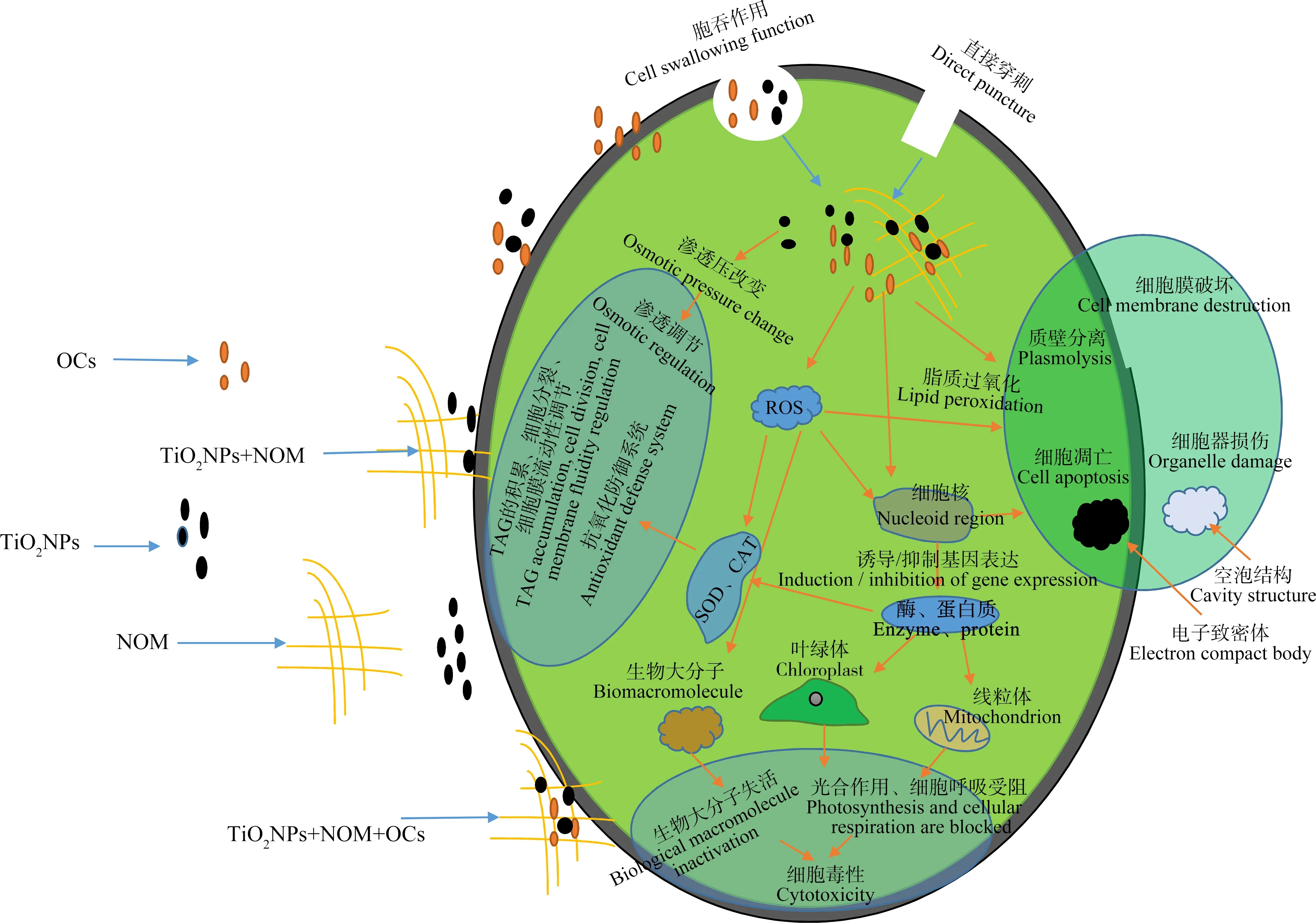
图7 NOM、纳米TiO2和PCB-77对小球藻致毒机理示意图Fig. 7 Toxic mechanism of NOM, nano-TiO2 and PCB-77 on Chlorella vulgaris
根据本实验研究结果,总结NOM、纳米TiO2和PCB-77对小球藻的致毒机制如图7所示。纳米TiO2团聚体吸附在小球藻表面,缠绕着藻细胞,影响藻细胞光合作用、细胞呼吸以及对营养物质的吸收,从TEM中观察到,复合暴露中藻细胞外包裹有大量的纳米TiO2,导致藻细胞内细胞器结构不清晰,并且出现电子致密体,当NOM存在时藻细胞质壁分离严重并出现空泡结构,进而造成细胞凋亡,NOM存在时复合毒性增大的原因主要是遮蔽效应和接触性物理损伤。ROS会导致脂质过氧化,造成细胞膜和细胞内膜损伤以及生物大分子变性。当细胞内ROS含量较低时,藻细胞中SOD和CAT酶能消除氧化压力保护藻细胞免受损伤,当细胞内ROS含量较高时,SOD与CAT酶不能消除氧化压力时,细胞内ROS积累更多,就会出现上述的不良反应,之前研究表明,增大细胞氧化压力是纳米TiO2致毒机理之一[33]。由PCR结果可知,纳米TiO2与PCB-77复合暴露在NOM存在与不存在条件下,能诱导或抑制特定基因的表达来调控相关酶和蛋白质的合成和表达,进而影响细胞呼吸、光合作用以及细胞代谢,最终影响细胞和亚细胞结构以及细胞生长或增殖。当藻细胞在受到这些污染物胁迫时还会引发一些保护性反应来维持正常的细胞功能,包括渗透压调节、细胞膜流动性以及细胞分裂等。当这些保护性反应无法抵御污染物的进攻时,就会出现细胞膜损伤、细胞器结构不清晰、质壁分离、生物大分子变性失活以及光合作用和细胞呼吸受阻造成能量代谢紊乱等破坏性反应,最终导致细胞毒性,造成细胞凋亡。

