吡唑醚菌酯和克菌丹在苹果上的残留特性及风险评估
刘霞,罗灵芝,吴燕,杨静,赵子丹,王芳,牛艳,王晓菁,*
1. 宁夏农产品质量标准与检测技术研究所,银川 750002 2. 宁夏工商职业技术学院,银川 750002
据我国农业农村部发布数据显示,2018年我国苹果产量接近4 000万t,面积和产量均居世界首位。但苹果病害仍是影响我国苹果产业健康可持续发展的限制性因素,同时给果农造成重大经济损失[1]。苹果病害主要有轮纹病、褐斑病和斑点落叶病等22种[2],严重影响苹果品质与产量。针对这些病害,目前化学防治措施是苹果园管理中最为常用且效果较为明显的防治技术[3]。吡唑醚菌酯(pyraclostrobin)作为一种广谱性杀菌剂,被广泛应用于防治苹果上由真菌引起的多种病害,如苹果上的斑点落叶病[4-5]、炭疽叶枯病[6]和褐斑病[7-8]等。克菌丹(captan)作为广谱性低毒有机硫类杀菌剂,也被应用于防治苹果苦腐病、黑星病、飞斑病和疮痂病等[9-10],同时作为种子处理剂或灌根防治茎枯病、立枯病和黑斑病[11-12]。
吡唑醚菌酯、克菌丹单剂在苹果上的残留、消解研究也已有报道[13-15]。但吡唑醚菌酯和克菌丹复合配剂在苹果上的残留规律和膳食风险评估尚未见报道。本研究在宁夏、辽宁、河南、安徽、山东、陕西、山西、新疆和天津等9地开展田间试验,建立吡唑醚菌酯、克菌丹在苹果上的残留分析方法,并根据40%吡唑醚菌酯·克菌丹悬浮剂在苹果上的消解动态及最终残留量,初步评估吡唑醚菌酯和克菌丹的膳食风险,以期为吡唑醚菌酯和克菌丹在苹果上的安全使用及安全风险评估提供参考。
1 材料与方法(Materials and methods)
1.1 试验材料
仪器:高效液相色谱仪-UV检测器(Waters e2695-2487,美国沃特世公司);气相色谱仪-ECD检测器(Agilent 6890N,美国安捷伦公司);低速台式大容量离心机(TDL-40B,上海安亭科学仪器厂,中国);旋转蒸发仪(R-215型,瑞士步琦公司);高速匀浆机(T18 basic型,德国IKA公司);电子天平(PL202-L型,瑞士梅特勒-托利多仪器有限公司)。
试剂:乙腈、甲醇、正己烷(色谱纯,美国Fisher Scientific公司);克菌丹标准品(98.6%,德国DR.公司);吡唑醚菌酯标准品(1 000 mg·L-1,天津环境质量监督检验测试中心,中国);Florisil柱(1 000 mg/6 mL,美国安捷伦公司);ZORBAX SB-C18色谱柱(4.6 mm×250mm, 5 μm,美国安捷伦公司)。
1.2 田间试验
试验遵循《农药登记残留田间试验标准操作规程》[16]于2018年在宁夏、辽宁、河南、安徽、山东、陕西、山西、新疆和天津进行。
1.2.1 最终残留量试验
每个试验点设置小区1个(苹果树不少于4棵),以1 000倍液的制剂量于苹果生长中后期施药3次,施药时使药液尽可能均匀地分布在处理小区果树的果实上,施药间隔10 d,末次施药后间隔21 d和28 d用随机的方法在试验小区内不同方向及上、中、下、里、外等不同部位采集生长正常、无病害的苹果果实,处理小区应分别采集2个独立样品,每份样品确保12个以上(不少于2 kg),用不锈钢刀具沿纵向切成均匀的4瓣,取对角的2瓣,切成1 cm以下的碎块,并充分混匀,用四分法缩分,留取300 g,装入样品容器中,贴好标签后立即放入低于-18 ℃冰箱中保存待测。
1.2.2 残留消解试验
残留消解试验与最终残留量试验设置于同一小区,采集距最终残留量试验末次施药后间隔2 h、7 d、14 d和35 d的苹果样品。同时在最终残留量试验末次施药前设置1个采样。样品采集处理同1.2.1。
1.2.3 空白试验
空白另设处理小区,不进行施药处理,但需采取必要措施避免污染,采集对照样品。样品采集处理同1.2.1。
1.3 分析方法1.3.1 样品前处理
称取苹果样品10.00 g于50 mL离心管中,加入20.0 mL乙腈,震荡约30 min,加入5.0 g氯化钠,振摇约1 min,于4 000 r·min-1离心3 min,移取上清液浓缩近干,加入3.0 mL丙酮+正己烷(V(丙酮)∶V(正己烷)=1∶9)溶液溶解后,转移至用洗脱液预淋洗过的Florisil固相萃取小柱中,重复3次,再用10.0 mL丙酮+正己烷(V(丙酮)∶V(正己烷)=1∶9)洗脱并收集,浓缩干,正己烷定容,移取一份采用气相色谱仪-ECD检测器检测克菌丹,另移取一份氮吹吹干,甲醇定容、过膜,采用液相色谱-UV检测器检测吡唑醚菌酯。
1.3.2 色谱条件
液相色谱-UV检测器:色谱柱为ZORBAX SB-C18(4.6 mm×250 mm,5 μm);柱温为40 ℃;进样量为10.0 μL;检测器波长为275 nm;等度洗脱为水+乙腈(V(水)∶V(乙腈)=3∶7),流速1.0 mL·min-1。
气相色谱-ECD检测器:色谱柱为DB-35MS UI毛细管色谱柱(30 m×0.25 mm,0.25 μm);模式为不分流进样、恒流,流量为3.0 mL·min-1;载气为氮气;尾吹流量为60 mL·min-1;进样量为1.0 μL;进样口温度为290 ℃;检测器为300 ℃;柱箱温度为100~300 ℃。
1.3.3 标准溶液的配制及标准曲线的绘制
将1 000 mg·L-1的标准溶液依次稀释得0.01、0.05、0.10、0.20、0.50、1.0和2.0 mg·L-1系列标准溶液,然后在1.3.2色谱条件下测定,以浓度为横坐标,峰面积为纵坐标,绘制吡唑醚菌酯、克菌丹线性标准曲线图。
1.3.4 添加回收率与相对标准偏差分析
分别在空白苹果基质中添加0.01、0.2和1.0 mg·L-13个水平的吡唑醚菌酯、克菌丹标准溶液,每个水平重复5次,按1.3.1和1.3.2测定回收率,并计算其相对标准偏差(RSD)。
1.4 膳食风险评估
吡唑醚菌酯、克菌丹在苹果上的膳食风险评估,是根据《食品中农药残留风险评估指南》[17]《食品中农药每日允许摄入量制定指南》[18]进行的长期膳食摄入评估,结合残留化学评估推荐的规范残留试验中值和已制定的最大残留限量(MRL),计算该农药的国家估算每日摄入量(NEDI)[19-20],计算公式如下:
NNEDI=∑[STMRi(STMR-Pi)×Fi]
式中:NNEDI表示农药的国家估算每日摄入量;STMRi表示农药在某一食品中的规范残留试验中值;STMR-Pi表示用加工因子校正的规范残留试验中值;Fi表示一般人群某一食品的消费量。
每人每日摄入总量为每日允许摄入量(ADI)与我国居民平均体质量(63 kg)的乘积,NEDI与其进行比较,计算风险商(RQ)评估实际上通过膳食长期摄入残留农药所带来的风险及其可接受程度,计算公式如下:
RRQ(%)=NNEDI/(AADI×63)
式中:RRQ表示风险商;AADI表示每日允许摄入量。
2 结果与分析(Results and analysis)
2.1 标准曲线
在选定的色谱条件下,吡唑醚菌酯、克菌丹在质量浓度0.01~2.0 mg·L-1范围内,吡唑醚菌酯、克菌丹质量浓度(x)与峰面积(y)具有良好的线性关系,吡唑醚菌酯标准曲线方程为y=39 056x+1 183,相关系数(r)=0.9994,克菌丹标准曲线为y=386 132x-21 932,相关系数(r)=0.9969,均满足外标法定量的要求[18]。
2.2 方法正确度与精密度
分别在空白苹果中添加0.010、0.2和1.0 mg·L-13个水平的吡唑醚菌酯、克菌丹标准溶液,每个水平重复5次。苹果中吡唑醚菌酯的回收率为80%~110%,相对标准偏差(RSD)为1.5%~13.3%;克菌丹的回收率为80%~110%,相对标准偏差(RSD)为5.9%~6.5%(表1),均符合《农作物中农药残留试验准则》(NY/T 788—2018)[21]中对检测方法正确度和精密度的要求。通过添加回收试验可知吡唑醚菌酯和克菌丹在苹果基质中的定量限均为0.010 mg·kg-1。
2.3 残留消解试验
采集末次施药后2 h、7 d、14 d、21 d、28 d和35 d的苹果,作为残留消解试验检测样品,测定苹果中吡唑醚菌酯、克菌丹的残留量并计算其消解率,结果如表2所示,色谱图如图1和图2(样品图以宁夏地区为代表)所示。以施药2 h后的残留量作为原始残留量,4个试验地吡唑醚菌酯、克菌丹原始残留量分别为0.024~0.26 mg·kg-1和0.14~0.28 mg·kg-1。施药后14 d,苹果中吡唑醚菌酯、克菌丹的残留量为0.076~0.11 mg·kg-1和<0.010~0.13 mg·kg-1,消解率为17%~71%和52%~100%;至施药后35 d,苹果中吡唑醚菌酯、克菌丹的残留量为<0.010~0.10 mg·kg-1和<0.010~0.12 mg·kg-1,消解率为58%~100%和44%~100%。从残留消解试验结果来看,随采收间隔延长,苹果中吡唑醚菌酯、克菌丹的残留量呈现降低趋势;吡唑醚菌酯较克菌丹在苹果中消解更慢,消解周期更长,说明吡唑醚菌酯较稳定,这与陈勇达等[22]的研究一致。

表1 吡唑醚菌酯、克菌丹在苹果中的添加回收率及相对标准偏差(n=5)Table 1 Recovery and relative standard deviation of pyraclostrobin and captan in apple (n=5)
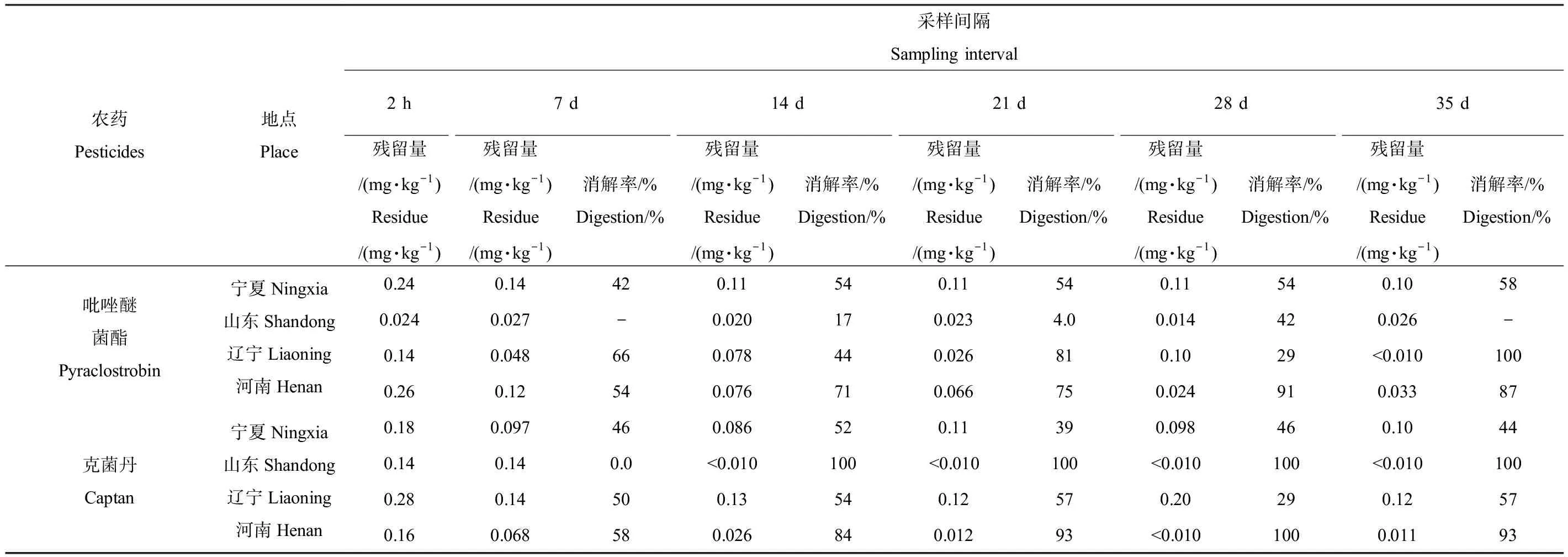
表2 苹果中吡唑醚菌酯、克菌丹残留消解结果Table 2 Results of residue degradation of pyraclostrobin and captan in apple
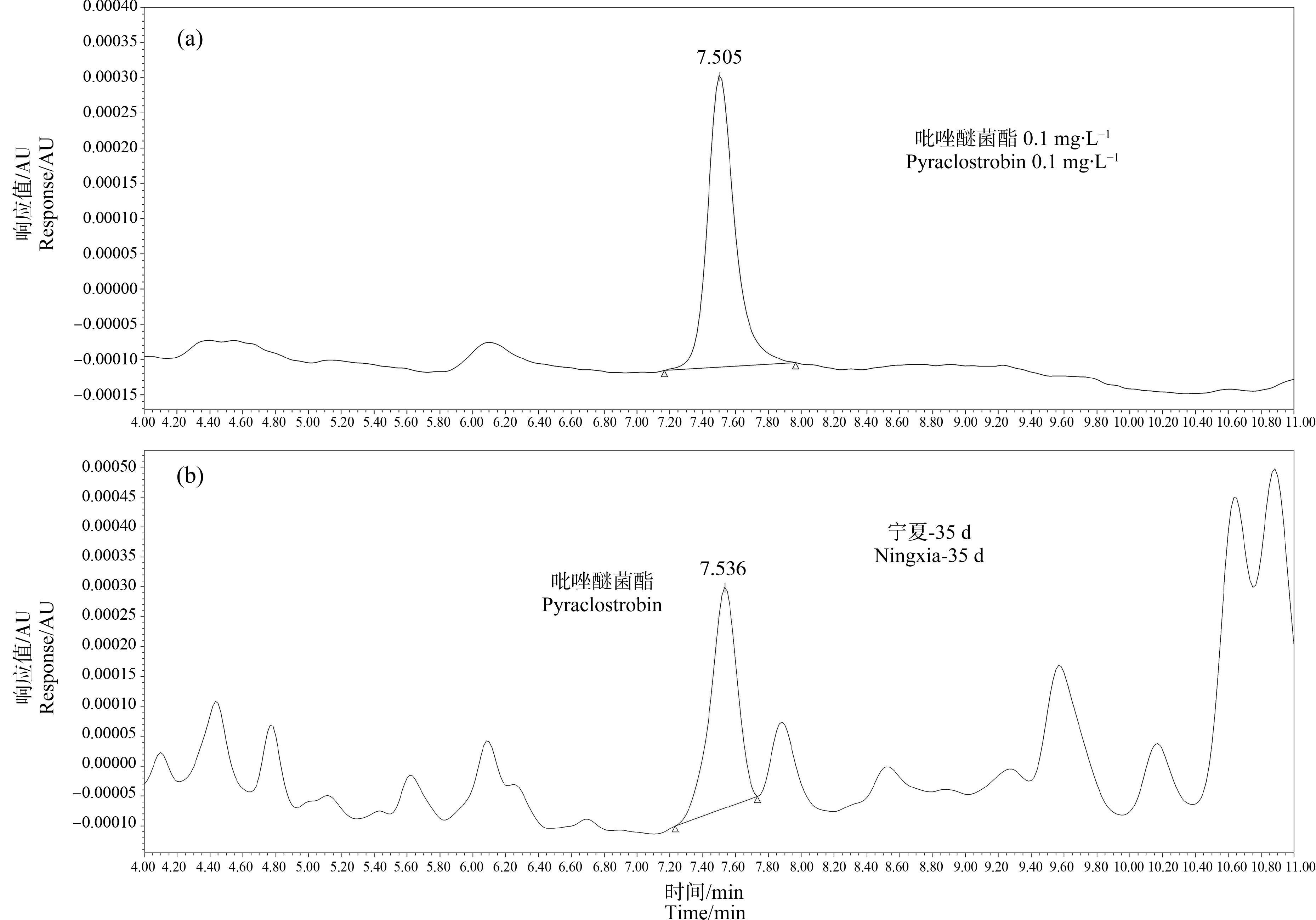
图1 吡唑醚菌酯标物(a)及苹果样品(b)中吡唑醚菌酯色谱图Fig. 1 Chromatogram of pyraclostrobin in reference materials (a) and in apple (b)

图2 克菌丹标物(a)及苹果样品(b)中克菌丹色谱图Fig. 2 Chromatogram of captan in reference materials (a) and in apple (b)
2.4 最终残留试验
采集末次施药后21 d和28 d的苹果,作为最终残留试验检测样品,测定苹果中吡唑醚菌酯、克菌丹的残留量,结果如表3所示。由表3可知,9个试验点施药21 d后,吡唑醚菊酯、克菌丹的残留量分别为<0.010~0.14 mg·kg-1、<0.010~0.24 mg·kg-1;施药28 d后,吡唑醚菊酯、克菌丹的残留量分别为<0.010~0.16 mg·kg-1、<0.010~0.28 mg·kg-1。9个试验地苹果中吡唑醚菌酯、克菌丹的最终残留量最大值分别为0.16 mg·kg-1和0.28 mg·kg-1,而我国《食品 安全国家标准 食品中农药最大残留限量》(GB 2763—2019)[23]规定吡唑醚菌酯、克菌丹在苹果上的最大残留限量分别为0.5 mg·kg-1和15 mg·kg-1,说明吡唑醚菌酯、克菌丹的最终残留量均未超出最大残留限量。
2.5 吡唑醚菌酯、克菌丹膳食风险评估
吡唑醚菌酯、克菌丹的ADI值分别为0.03 mg·kg-1和0.1 mg·kg-1(以体质量计),在我国登记作物情况如表4所示。
根据吡唑醚菌酯和克菌丹在我国不同作物中的登记情况,结合参考限量及我国居民人均膳食结构进行膳食风险评估,结果如表5所示,结果表明,普通人群吡唑醚菌酯、克菌丹的NEDI分别是1.162 mg和2.075 mg,分别占日允许摄入量的61.5%和32.9%,均<100%,表明吡唑醚菌酯、克菌丹对一般人群健康均不会产生不可接受的风险。
综上所述,本研究表明,在选定的色谱条件下,吡唑醚菌酯、克菌丹在质量浓度0.01~2.0 mg·L-1范围内具有良好的线性关系,线性相关系数(r)分别为0.9994和0.9969;添加水平为0.01~1.0 mg·kg-1时,苹果中吡唑醚菌酯、克菌丹的回收率及相对标准偏差均符合《农作物中农药残留试验准则》(NY/T 788—2018)[21]中对检测方法正确度和精密度的要求。
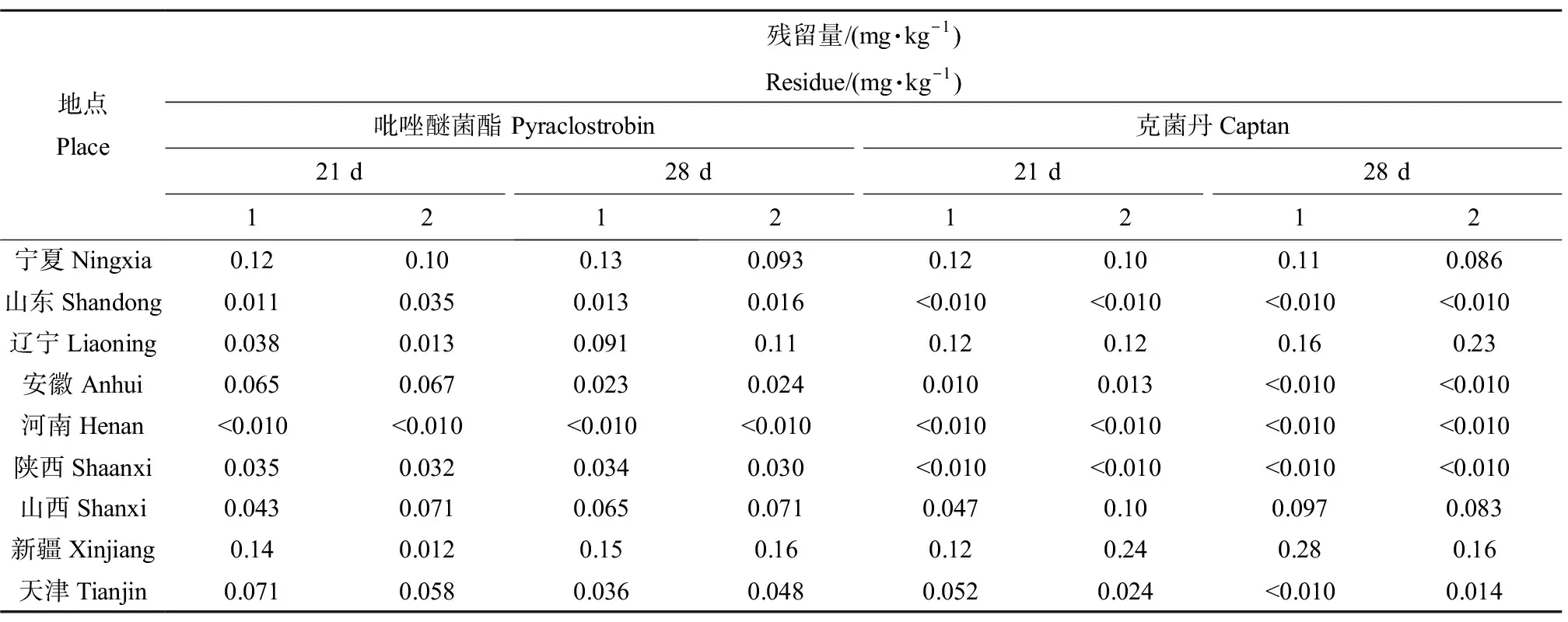
表3 苹果中吡唑醚菌酯、克菌丹最终残留量Table 3 Final residue of pyraclostrobin and captan in apple

表4 吡唑醚菌酯、克菌丹在我国登记作物情况Table 4 The registered crops applied with pyraclostrobin and captan in China
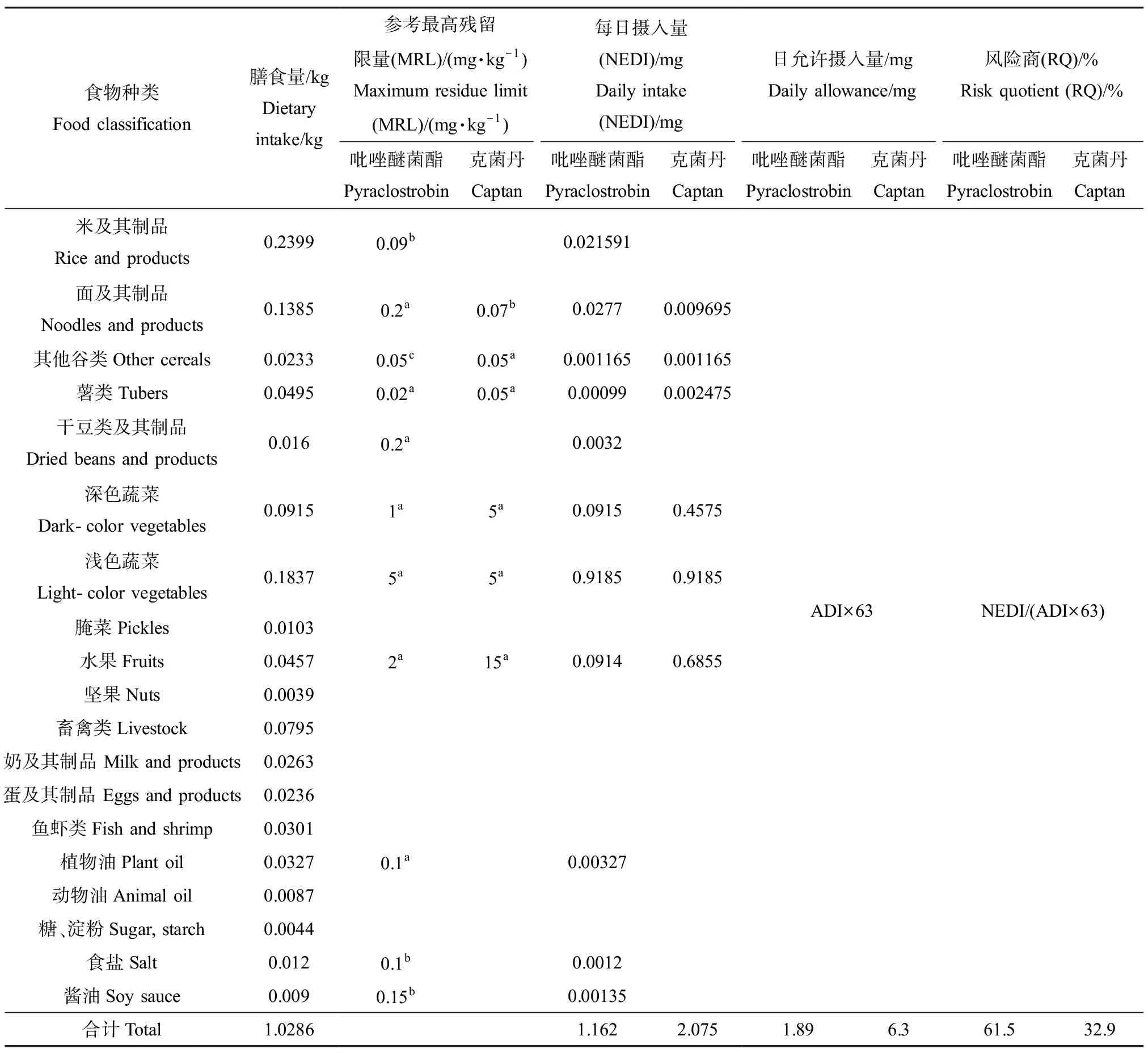
表5 吡唑醚菌酯、克菌丹膳食风险评估Table 5 Dietary risk assessment of pyraclostrobin and captan
消解动态试验表明,随着采样间隔时间的延长,吡唑醚菌酯、克菌丹的残留量呈降低趋势,消解率呈增加趋势;吡唑醚菌酯较克菌丹在苹果中消解更慢,消解周期更长,说明吡唑醚菌酯较稳定。
最终残留结果表明,9个试验地苹果中吡唑醚菌酯、克菌丹的最终残留量最大值分别为0.16 mg·kg-1和0.28 mg·kg-1,均未超出MRL值。结合吡唑醚菌酯、克菌丹在苹果上残留试验数据,建议40%吡唑醚菌酯·克菌丹悬浮剂用于防治苹果斑点落叶时,以1 000倍液的施药剂量在苹果上施药3次后,安全间隔期21 d。
参照国际食品法典农药残留委员会(CCPR)农药风险分析原则和粮农组织/世界卫生组织农药残留联合专家会议(JMPR)风险评估方法,结合我国农药登记情况和我国居民的人均膳食结构,普通人群吡唑醚菌酯、克菌丹的NEDI分别是1.162 mg和2.075 mg,分别占日允许摄入量的61.5%和32.9%,均<100%,表明吡唑醚菌酯、克菌丹对一般人群健康均不会产生不可接受的风险。

