纳米银消费品中银的总迁移量分析
刘迎春,王振国,王卓
1. 北京化工大学化学学院,化工资源有效利用国家重点实验室,北京 100029 2. 中国标准化研究院,北京 100191
银作为一种古老的抗菌材料很早就被人类熟知并利用,如用含有银丝的纱布包扎伤口、用银器来存放食物防止腐败等[1-3]。纳米银(Ag NPs)是粒径在纳米尺度(1~100 nm)的银颗粒。与普通的银材料相比,纳米银具有更高的比表面积和更多的活性位点,因此具有更好的抗菌活性[4-5]。纳米银抗菌机制包括破坏细菌细胞壁、抑制DNA复制、抑制呼吸酶作用和产生活性氧等[6-9]。如今,纳米银被广泛研究和应用于食品包装、纺织品等各类消费品中。根据美国、欧盟等的相关机构发布的纳米技术消费产品数据库,在所有已知成分的纳米消费品当中,银的占比最高[10-11]。在纺织品和食品包装中纳米银的应用已有较多报道,如Mahdi等[12]将纳米银颗粒掺入到聚氯乙烯基质中制成抗菌的食品包装。该包装对微生物(大肠杆菌和金黄色葡萄球菌)的生长具有明显抑制作用,显著延长了食物的保质期。Dastjerdi等[13]将银纳米颗粒沉积在涤纶树脂纺织物表面。织物的抗菌测试结果表明在纳米银颗粒含量低至10 μg·g-1时,对金黄色葡萄球菌的抑菌率依然可达99%。
随着纳米银消费品的广泛使用,纳米银带来的安全问题也逐渐引起了人们的关注[14-16]。添加在消费品中的纳米银颗粒会在不同的使用环境中释放,给人体和环境带来潜在的安全隐患。Choi等[17]研究了市售3类婴儿奶包装制品(奶瓶、奶嘴和奶袋)中纳米银颗粒的释放情况。测试结果表明,大多数释放的银以Ag+的形式存在,最高迁移水平为2.25 ng·mL-1。Wagener等[18]研究了含纳米银嵌入和涂层的纺织纤维在模拟汗液中的银释放问题,在浸泡24 h后,释放的银浓度在1.7~21.9 μg·g-1之间,浓度的差异可能来源于功能化的类型及纺织品中银的起始形式。Rogers等[19]调查了22种可商购的胶态银喷雾产品。所有产品中的总银浓度在0.54~960 μg·mL-1之间变化,且都在悬浮液中存在银纳米粒子。但是测量值与产品标注值存在高度差异。Mackevica等[20]研究了商用成人和儿童用牙刷中银纳米颗粒的释放。最大总银释放量为每把牙刷10.2 ng。与儿童牙刷相比,成人牙刷通常释放更多的银。这些产品中释放的银可以通过吸入、口服和皮肤渗透等多种暴露方式进入人体,也可以通过多种迁移转化在生态环境中积累,给人体和环境造成安全隐患[21-24]。纳米银颗粒已经被证明会对各种生物体细胞、系统、微生物以及植物等产生毒性[25-26]。纳米银尺寸小,具有极大的比表面积,能够透过生物膜上的孔隙和细胞的胞吞作用进入细胞以及线粒体、细胞核等细胞器内,并与蛋白质核酸等生物大分子发生结合,影响细胞的功能。Moradi-Sardareh等[27]的研究表明,在一定范围内(≥0.25 μg·g-1),不同浓度的纳米银颗粒都具有在Balb/C小鼠的不同组织中诱导毒性的潜力。浓度高于0.25 μg·g-1的纳米银颗粒会导致肝脏、脾、脑、心脏、肺、肾脏和睾丸组织的病理变化;并会导致精子的质量和数量以及血脑屏障的通透性发生变化。最低浓度为0.25 μg·g-1的纳米银颗粒显著改变了血清和肝组织的氧化应激水平。除了可以对哺乳动物产生毒性外,纳米银颗粒还会引起潜在的生态风险。在洗涤后从纺织品中释放的银主要流入废水处理厂,当废水处理不充分时,一定浓度的纳米银将会直接排放到水中,对水生生物以及下游受水的农田造成影响。除此之外,那些没有脱落的纳米银最终会随着消费品沉积到垃圾填埋场中,在经一系列转化之后可能生成毒性较低的的AgCl和Ag2S。从纳米银颗粒中释放的Ag+也会与环境中存在的带负电荷物质相互作用,延长其保留时间,从而增加其毒性[28]。
目前我国纳米消费品市场发展迅速,我国科研工作者已经开展了关于此方面的研究[29-31],但总体关于消费品的安全性研究较少。为科学准确评估纳米银释放给人体和环境带来的潜在风险,亟待对含银消费品中银迁移情况进行分析。本文以我国消费者可接触到的含纳米银的食品包装和纺织品为研究对象,分析其在不同环境模拟液中的银总迁移量,希望为纳米银消费品的相关安全评估提供研究基础数据。
1 材料与方法(Materials and methods)
1.1 材料
根据国内纳米银消费品市场现状,选择了食品包装和纺织品进行银的迁移测试。具体包括口罩、袜子、内衣、储奶袋、奶瓶(各2种)以及保鲜盒、银母粒共12种样品进行测试(表1)。银母粒以聚丙烯塑料为纳米银的载体,可与各种原料切片进行共混。根据各种塑料制品、纤维制品的使用方法进行加工,形成含纳米银的各种成品。所有样品都通过线上平台购得。其他主要试剂及来源:超纯水(哇哈哈,中国)、乙酸(分析纯,北京化工厂,中国)、正己烷(分析纯,北京化工厂,中国)、硝酸(MOS级,北京化学试剂研究所,中国)、乳酸(分析纯,Innochem,中国)、奶粉(Friso,荷兰)、无水碳酸钠(分析纯,北京化工厂,中国)、L-盐酸组氨酸一水物(分析纯,Acros,中国)、二水合磷酸氢二钠(分析纯,北京化工厂,中国)、十二水合磷酸二氢钠(分析纯,北京化工厂,中国)、氯化钠(分析纯,北京化工厂,中国)和氢氧化钠(分析纯,北京化工厂,中国)。主要测试仪器:电感耦合等离子体质谱仪(ICP-MS)(iCAP Q, Thermo, Waltham, USA)、电子天平(ME104,梅特勒-托利多国际贸易有限公司,上海,中国)、电热板(EH45A Plus,北京莱伯泰科,中国)和马弗炉(SX-G,天津中环电炉,中国)。
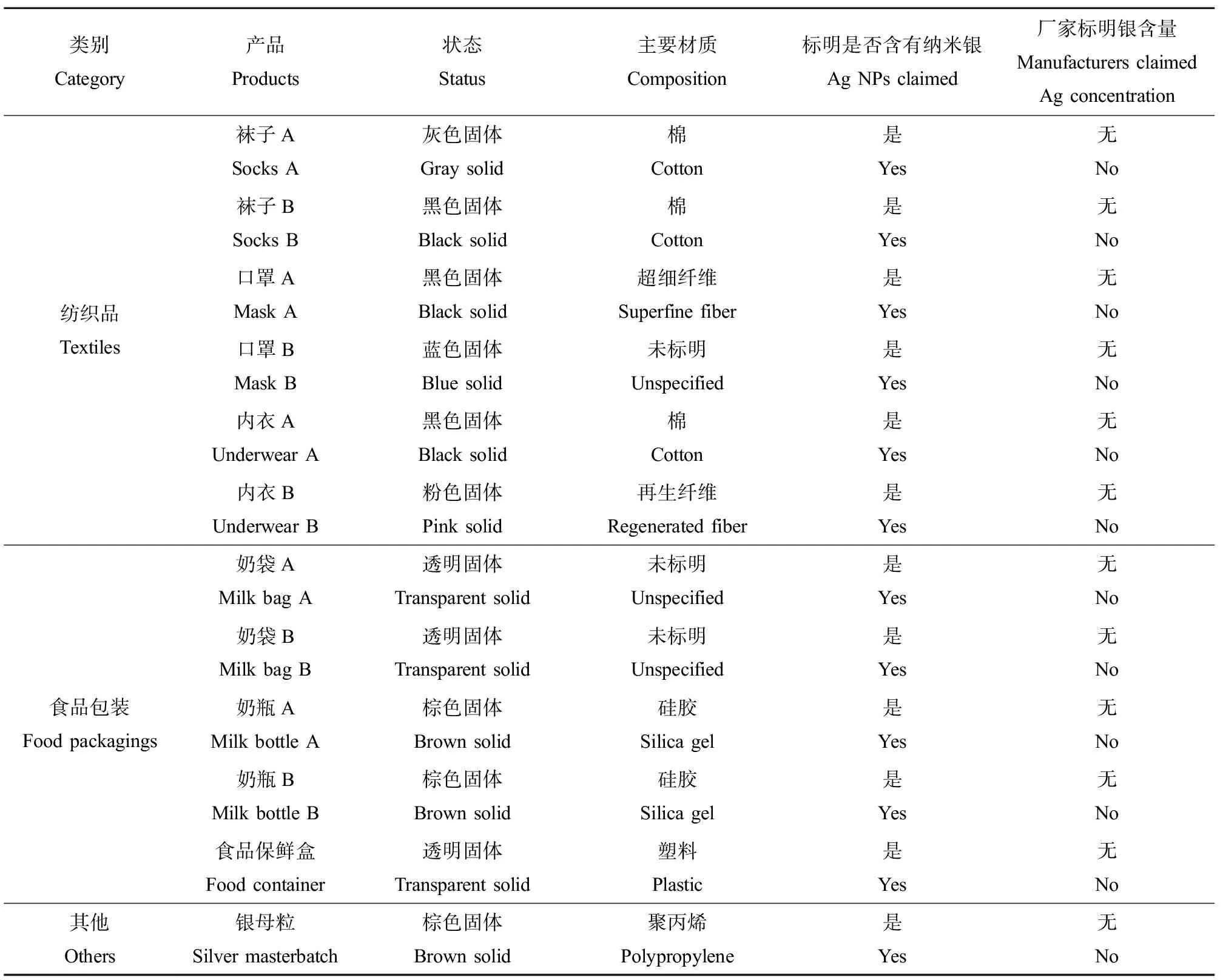
表1 纳米银(Ag NPs)消费品相关信息Table 1 Information of Ag nanoparticles (Ag NPs)-containing consumer products
1.2 银总迁移量浸出和测试方法1.2.1 浸泡试验条件
对于保鲜盒,参考国家标准《食品接触材料及制品迁移试验通则》(GB 31604.1—2015)[32],选择蒸馏水、4%醋酸溶液和正己烷为模拟液,分别模拟中性、酸性和油性食物环境。对于奶瓶和奶袋,选取奶粉溶液作为模拟液。对于纺织品类消费品,在使用中会被人体皮肤分泌的汗液浸渍,因此选择人工汗液作为模拟液对3类纺织品(袜子、口罩和内衣)进行银的迁移测试。大多数人的汗液为酸性,pH在5.5左右,但有少部分人的汗液为碱性,pH可达8.0。参考Kulthong等[33]和Yan等[34]的研究方法,采用表2所示的4种汗液模拟液。
将所有的样品用去离子水冲洗后自然晾干,裁剪为1 cm×1 cm的正方形块。每12 g样品全浸入100 mL模拟液,常温密封避光保存[35]。其中,所有食品包装样品在加入模拟液后70 ℃加热2 h,然后常温密封避光保存。在浸泡后的第1、3、7、15、21和30天取样,每次取样后补充同体积的浸泡液。
1.2.2 总银含量的测定
对于所有固体样品,先采用干法灰化消解,再通过ICP-MS测银总含量。具体操作如下:称取约0.5 g样品于坩埚中,于500 ℃马弗炉中灰化6 h,取出至室温,加入5 mL硝酸,置于180 ℃电热板上消解至无明显反应现象且剩余溶液<2 mL,取下冷却至室温,用超纯水定容至10 mL,用ICP-MS分析银含量。每个样品进行5次重复处理。不同样品加标回收率为82.6%~103.4%。
1.2.3 银总迁移量的测定
所有模拟汗液浸泡液样品、水浸泡样品和4%醋酸溶液浸泡样品直接上机测试。奶粉溶液浸泡混合物样品中加入1.5 mL硝酸,振荡后移至烧杯中,重复3次,置于180 ℃电热板上反应,至无明显反应现象且剩余液<2 mL,取下冷却至室温后,用超纯水定容至10 mL后上机测试。对于正己烷浸泡样品,将正己烷自然挥发干后,加入2 mL硝酸80 ℃加热10 min,使样品完全溶于酸中,转移至烧杯中,加入1 mL硝酸振荡后转移至烧杯,重复3次,置于180 ℃电热板上反应,至无明显反应现象且剩余溶液<2 mL,取下冷却至室温后,用超纯水定容至10 mL,用ICP-MS分析银含量。每个样品进行5次重复处理。
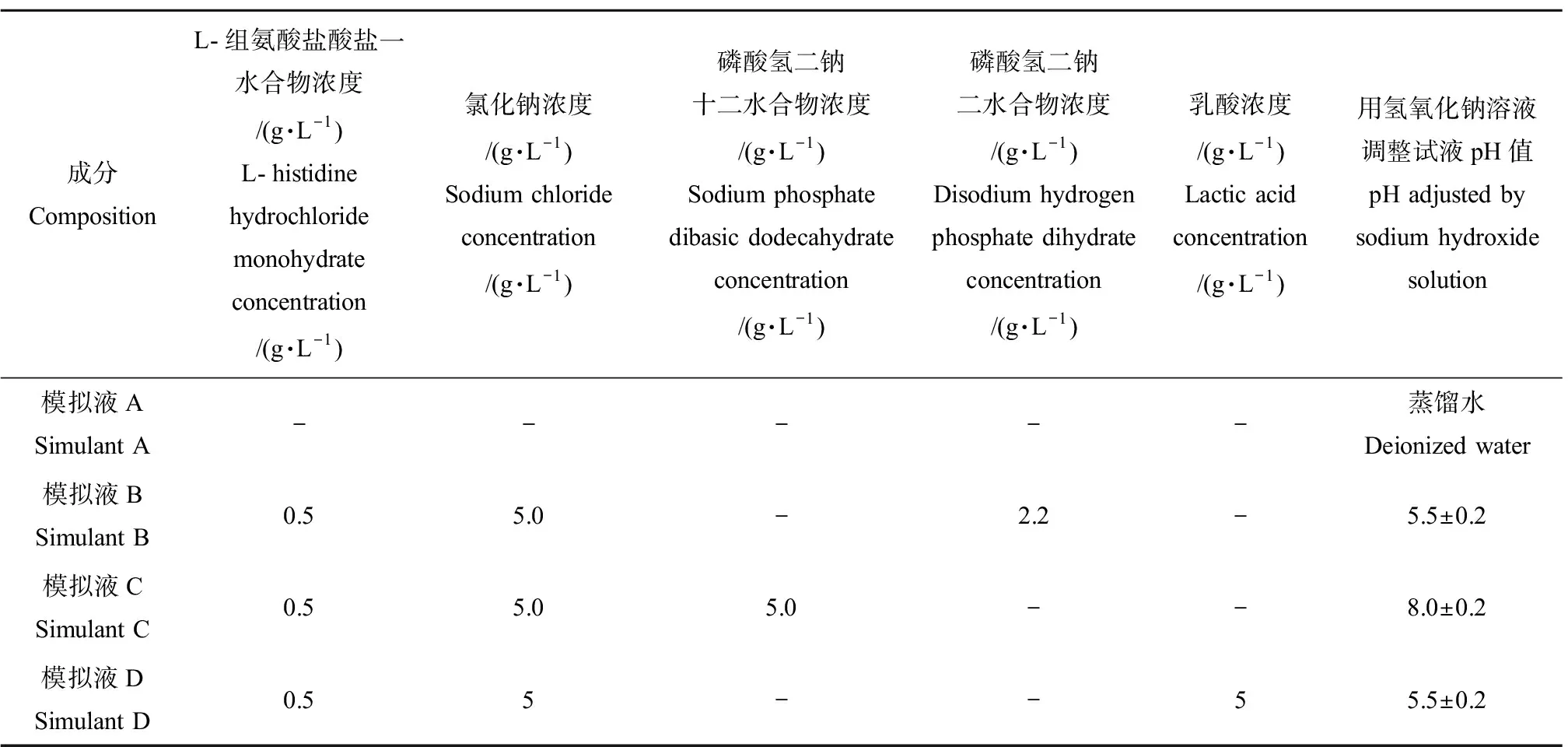
表2 模拟汗液成分表Table 2 Composition of simulated sweat
2 结果(Results)
2.1 银总含量分析
如图1所示,选取的6种纺织品中都含有银,范围在0.1~20 μg·g-1之间。同类产品不同品牌间的含量差别较大。银含量最高为口罩B,达到了19.77 μg·g-1。而内衣B的银含量最低,仅为0.12 μg·g-1。
同样,在所有的食品包装样本中均检测到了银(图2)。其中银母粒作为加工原料,其银含量高达到23.34 μg·g-1。保鲜盒的银含量也达到8 μg·g-1。但4个奶制品包装中(奶瓶A和B,奶袋A和B)的银含量都较低,其中有3个都在1 μg·g-1以下。
2.2 银总迁移量分析
对于选取的2个品种的口罩(口罩A和口罩B),在不同浸泡液中的银的总迁移量都与浸泡时间呈正相关(图3)。图3中总迁移量为模拟液中的银的浓度。在浸泡1 d后口罩A和口罩B在模拟液A、D中总迁移量要明显高于模拟液B、C。随后各自的总迁移量以不同的速率增加。对于口罩A,在浸泡30 d中每个时间点(第1、3、7、15、21和30天)模拟液A、D中的银总迁移量都要高于模拟液B、C。口罩B在前5个时间点各浸泡液银含量变化与口罩A相似。但在浸泡21~30 d时,口罩B在模拟液C中的银含量迅速增加,在第30天时超过了模拟液D。从总的银迁移程度看,口罩A和口罩B的银总迁移量差别较大。口罩B在浸泡的第1天后4种模拟液中的银浓度都高于0.1 μg·mL-1,口罩A在浸泡30 d后的最大量也未超过0.1 μg·mL-1,而口罩B在30 d后的最大总迁移量达到了1.7 μg·mL-1。不同品牌间总迁移量的巨大差异可能是源于初始银含量的不同。由图1可知,由于口罩B的初始银含量较高,所迁移出的银也较多。模拟液对于每一种口罩总迁移量以及迁移速率的影响是较为复杂的,这还可能取决于不同的口罩材料在不同模拟液中的溶解度不同。
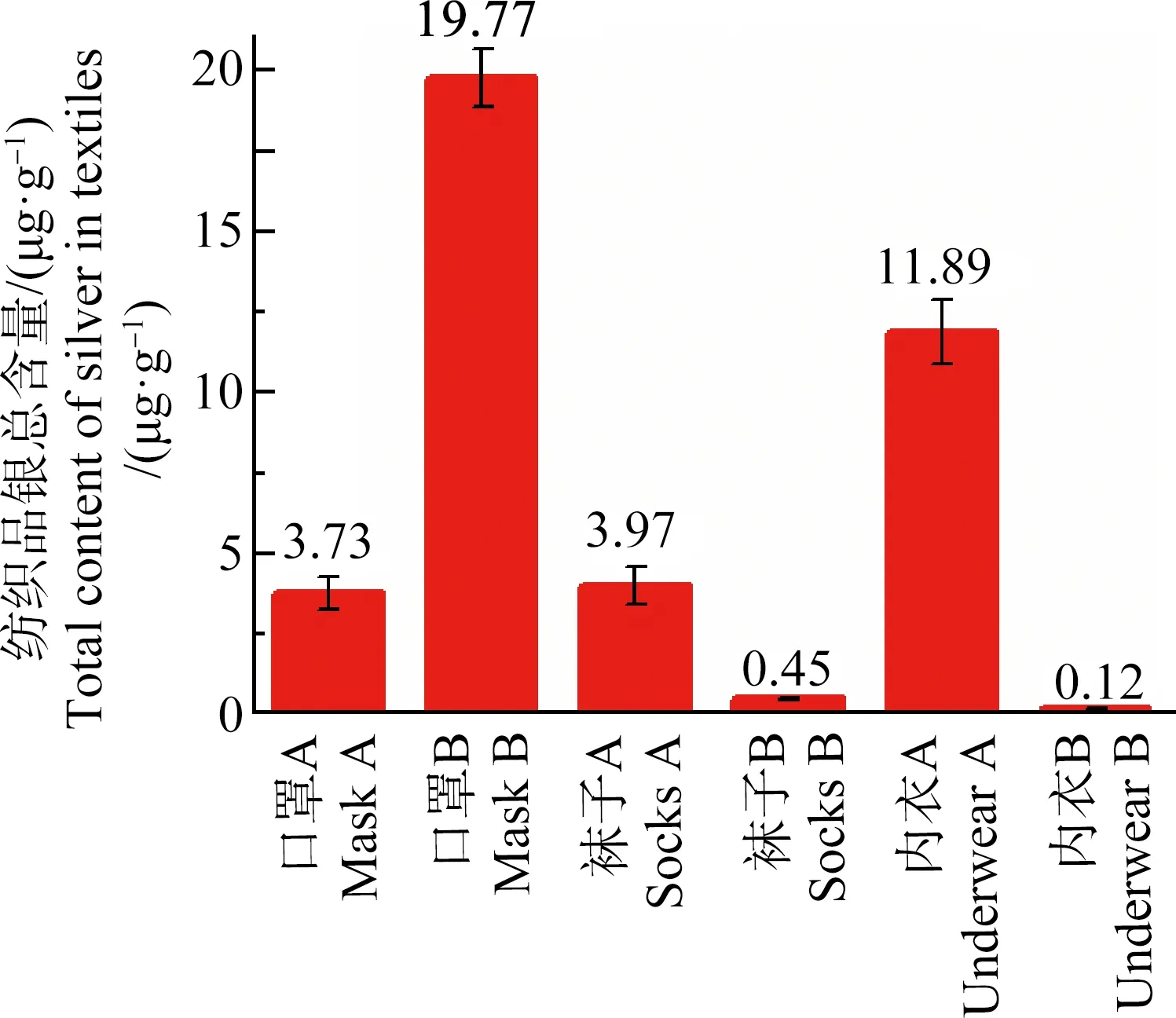
图1 6种纳米银纺织品中银总含量(n=5)Fig. 1 Total silver content in 6 kinds of Ag NPs-containing textiles (n=5)
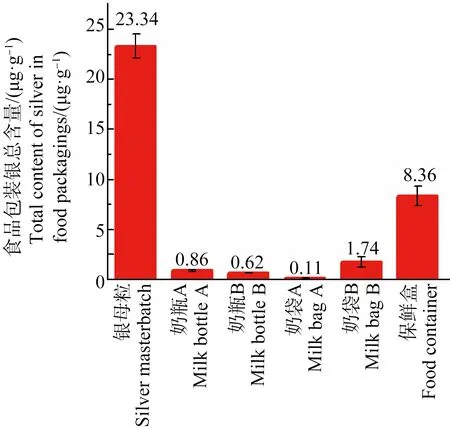
图2 5种纳米银食品包装及银母粒中银总含量(n=5)Fig. 2 Total silver content in 5 kinds of Ag NPs-containing food packagings and silver masterbatch (n=5)
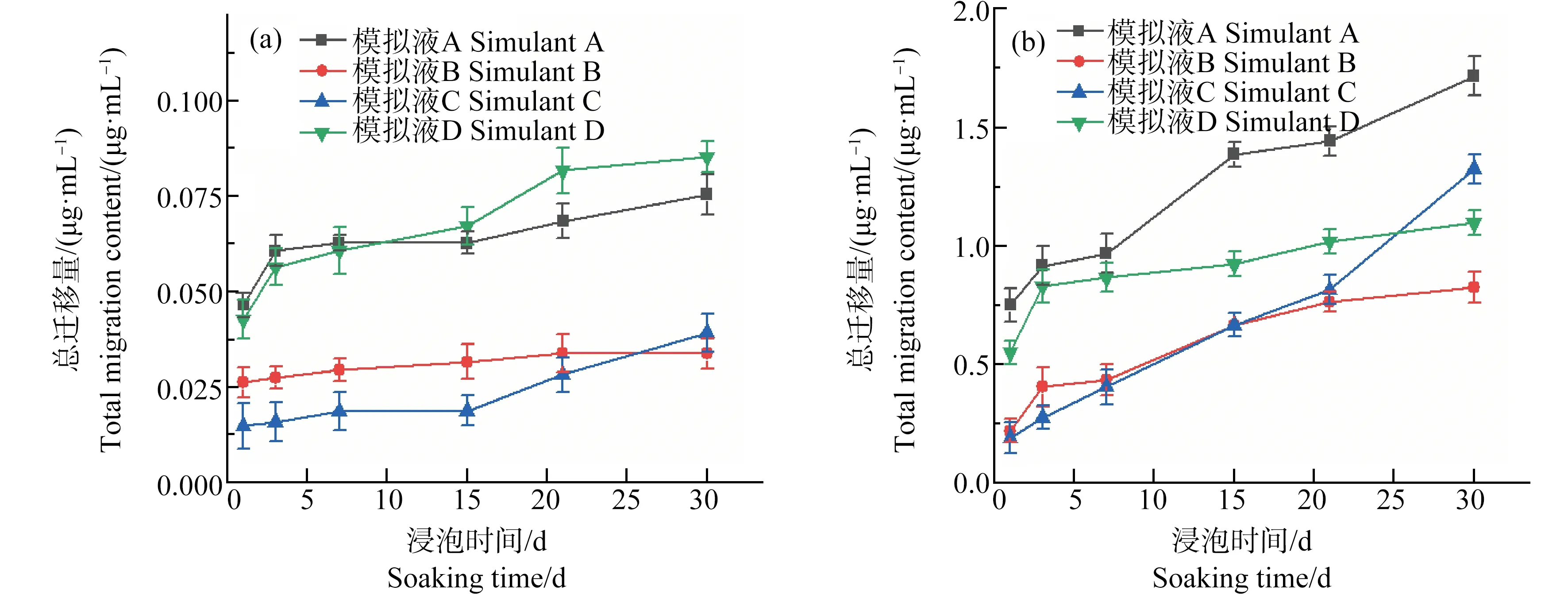
图3 纳米银口罩的银总迁移量(n=5)注:(a)口罩A;(b)口罩B。Fig. 3 The total migration content of silver from masks (n=5)Note: (a) Mask A; (b) Mask B.
对于2种不同的袜子(袜子A和袜子B),总迁移量差别显著(图4)。袜子A的银初始含量远高于袜子B,经过模拟汗液浸泡后迁移的银也远高于袜子B。2种袜子都在酸性模拟液中取得了最大总迁移量。值得注意的是,袜子B的整体总迁移量偏低,且在去离子水和碱性模拟液中的迁移的银的量都低于ICP-MS的检测限。这可能和袜子B的初始银含量低以及生产工艺有关。对于袜子A,在浸泡的前21 d内,模拟液A、B和C中银的量增长缓慢。但模拟液D中银的量在前7 d内增长缓慢,随后迅速增长。对于袜子B的模拟液B,与袜子A相反,在前7 d内迅速增长,随后增长缓慢。迁移速率的差别可能来源于生产工艺的不同。纳米银作为抗菌添加剂可以通过浸渍、涂覆的形式存在于这些纺织品的表面。同样也可以在生产过程中与纤维、棉和麻等纺织品原材料共混,存在于产品的内部。当纺织品接触浸泡液之后,存在于表面的纳米银首先开始脱落,随着浸泡时间的增加,存在于材料内部的纳米银也可能会逐渐释放。而且,不同材料在各种模拟液中的溶解度差异也会导致实际的迁移行为差异。总的结论是原料中银的含量直接影响了最终银的总迁移量。生产加工工艺和模拟液性质的差别,可能是导致样品在不同时间段银离子的溶出速率不同的原因。
在2种内衣在4种汗液浸泡液中的银含量都低于检测限,说明这2种内衣材料与纳米银结合力较强,不易脱落。
4种奶制品包装(奶瓶A、奶瓶B、奶袋A和奶袋B)在奶粉溶液中的银总迁移量各有差异。奶瓶A的总迁移量达到0.55 μg·mL-1,奶瓶B的总迁移量达到0.3 μg·mL-1,奶袋的总迁移量要低于奶瓶(图5)。这4类奶制品包装的银总迁移量在浸泡的前15 d内增长缓慢,从15 d后开始迅速增加。奶瓶A较为明显,后15 d的银总迁移量约是前15 d的10倍。可能的原因是长时间的浸泡使得材料内部的纳米银也开始脱落,造成银总迁移量迅速增加。奶瓶和奶袋在去离子水浸泡后,都没有检测到银的迁移。同样,保鲜盒浸泡在水和酸性浸泡液中都没有检测到银,在油性模拟液中的银最大总迁移量约为2 μg·mL-1。这是由于正己烷对于高分子聚合物的溶胀效应[35]。
通过迁移曲线,发现有部分样品的银总迁移量在浸泡30 d时呈现显著的增长趋势。因此,我们延长浸泡时间,在浸泡第100天取样检测,计算其最大银总迁移量(图6)。结果表明,和第30天相比,在100 d时的总迁移量没有明显变化。所有样品在浸泡30 d后的总迁移量已基本达到饱和。
为了比较不同材料对于纳米银的结合能力,我
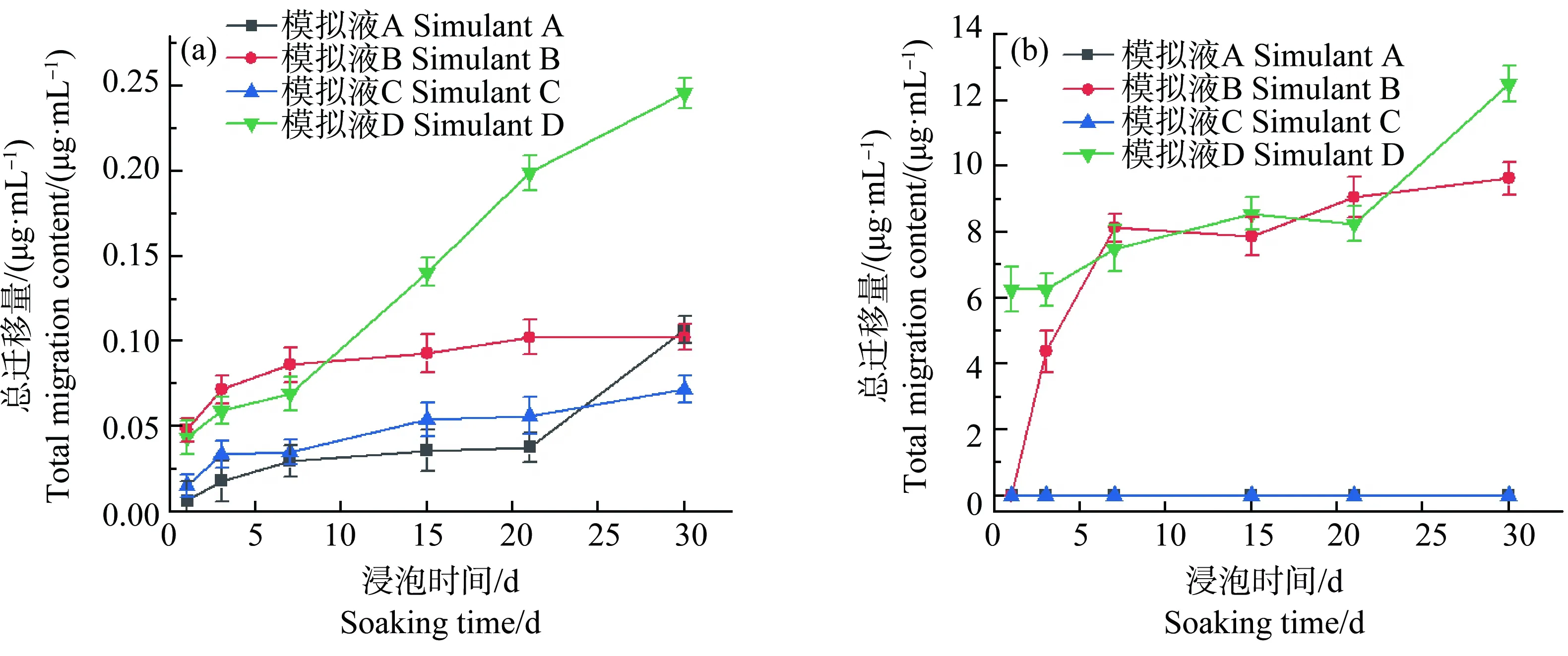
图4 纳米银袜子的银总迁移量(n=5)注:(a)袜子A;(b)袜子B。Fig. 4 The total migration content of silver from socks (n=5)Note: (a) Socks A; (b) Socks B.
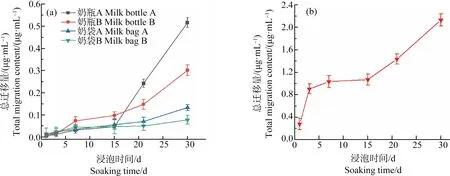
图5 奶制品包装在奶粉溶液中的银总迁移量(n=5)(a)和保鲜盒在油性模拟液中的银总迁移量(n=5)(b)Fig. 5 The total migration content of silver from dairy packagings in milk powder solution (n=5) (a) and from food container in oily simulant (n=5) (b)
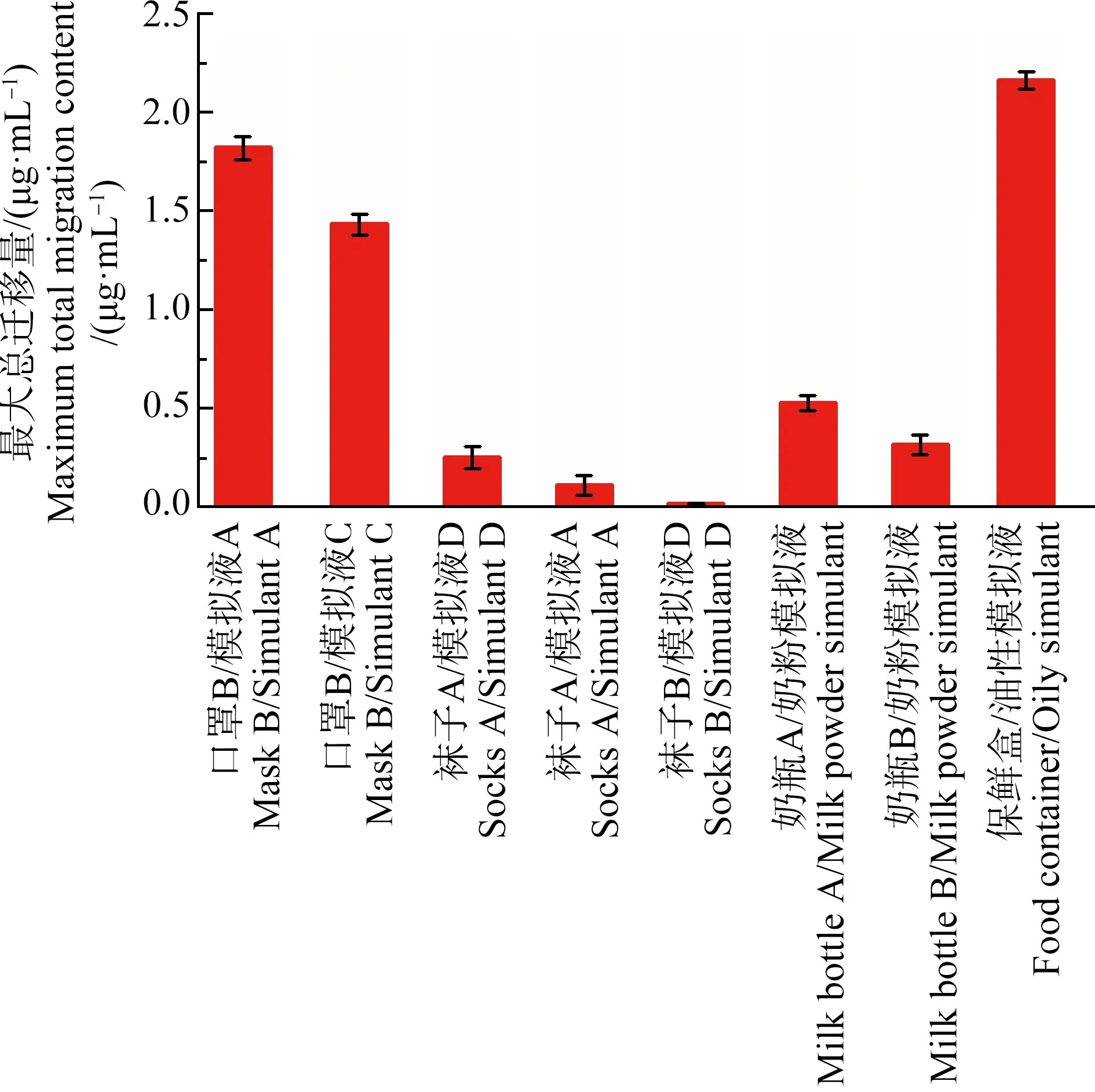
图6 部分样品最大银总迁移量(n=5)Fig. 6 Maximum migration content of silver from some samples (n=5)
们计算了所有产品的最大总迁移率(图7)。口罩A、口罩B,袜子A、袜子B以及奶袋B的银总迁移率都<10%,说明纳米银与这些材料本身的结合程度较强,在浸泡30 d后只有不到10%的银脱离。但是3种奶制品包装的最大总迁移率都超过了50%,奶袋A的总迁移率达到了70%。表明了纳米银与奶袋A原材料间具有较弱的相互作用。
3 讨论(Discussion)
本研究选取了11种含有纳米银的消费品,包括口罩、袜子、内衣、保鲜盒、奶瓶和奶袋,它们的总银含量为0.12~19.8 μg·g-1。材料本身的银含量以及在模拟液中的不同溶解度导致了总迁移量的不同。银的总迁移量与浸泡时间存在明显的正相关。长时间的浸泡使纳米粒子更加充分地向溶液中扩散。达到平衡状态后,溶液中的银浓度趋于稳定。所选的11种材料在达平衡后的最大银迁移率可达70%。不同材料间银的迁移行为差异较大,根据先前的报道,材料本身银含量和纳米银的添加方式在对于银的迁移起决定性作用[18,36]。
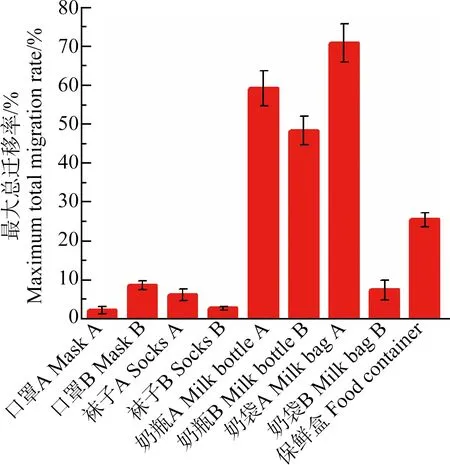
图7 9种纳米银消费品的最大银总迁移率(n=5)Fig. 7 Maximum migration rate of silver from 9 kinds of Ag NPs-containing consumer products (n=5)
消费品中释放的银主要通过呼吸道、消化道和皮肤进入人体。呼吸进入人体的纳米银颗粒,根据尺寸不同会沉积在不同位置。纳米尺寸的颗粒多沉积在支气管和肺泡,会造成更大的危险[37]。Quadros和Marr[38]测试了3种纳米银相关喷雾在正常使用期间产生气雾中的银的排放。3种喷雾液相中银的总浓度在12.5~27.5 μg·mL-1之间。每次喷雾操作会释放出0.24~0.56 ng的银。建立的暴露模型表明,对于70 kg的成年人来说,每天最多有69 ng的银可能会沉积在呼吸道中。虽然该剂量比美国环境保护局(US EPA)建议的银的口服参考剂量0.005 mg·(kg·d)-1要低。但是随着纳米银产品越来越多的使用,使用多种产品产生的累加作用也应该引起人们的关注。本文中测试的食品包装在经不同食物模拟液浸泡后会释放纳米银。这些纳米银会伴随不同的食物介质进入消化道。小粒径的纳米颗粒可跨越胃肠道粘膜,进入粘膜下层组织,经淋巴和血液循环转运对人体产生损伤。除了呼吸道和消化道,皮肤暴露也是纳米颗粒进入人体的重要途径。皮肤是人体的天然屏障,对于外界的损害有着较强的防御作用。虽然纳米颗粒通常难以穿过完整的表皮层,但是当皮肤病变或者受损时,纳米颗粒便有很大可能经皮肤渗透,进入人体[39]。正如本文前述所示,纳米银纺织品会在汗液的浸泡下释放银。已经有报道表明,从纺织品中释放的纳米银可以穿过表皮层进入真皮层[40]。在这项研究中,纳米银会在汗液的浸渍下从纺织品中脱落并渗透进入皮肤。真皮和表皮中的银浓度分别为0.33 μg·cm-2和0.07 μg·cm-2。这表明释放的银能够穿透皮肤的主要屏障——角质层。除此之外,用于实验的不同皮肤中的银含量差异巨大。原因之一可能是皮肤中的毛发含量不同,因为毛囊也可作为固体颗粒渗透的重要途径。除了对人体造成潜在的危害外,这些消费品在除浸泡外的其他使用环境中,如磨损[41]、洗涤[42]和光照[43]下均会释放纳米银,给生态环境带来一定的风险。这些纳米银会随着生活废水进入废水处理厂,最终排入到环境中。在水生环境中,不同的理化参数(有机物含量、配体浓度、pH和离子强度)会影响纳米银的转化,最终可能转化为AgCl和Ag2S等不同的银化合物[44]。Farkas等[45]的研究表明,含纳米银的洗衣机会在使用过程中释放平均粒径为10 nm、浓度为11 μg·L-1的纳米银。当天然淡水细菌群落暴露于纳米洗涤流出物中时,细菌丰度降低超过50%,表明在洗衣机平均释放浓度下,细菌群落对纳米洗涤水非常敏感。Cleveland等[46]观察了纳米银消费品在60 d实验期内的迁移情况。这些消费产品在60 d内浸出的银占总银量的82%~99%。大量释放的银会被河口的生物区、沉积物、沙子和生物膜吸收,使其在草虾、蜗牛、草茎和树叶等的暴露量不断增加。
为了对纳米银的人体暴露剂量进行评估分析,参考Nazarenko等[47]建立的对于化妆品中纳米材料的吸入暴露评估方法,通过公式(1)可以计算人体通过呼吸对纳米颗粒的摄入量:
ID=fnano×cinh×Qinh×Tcontact/Bw
(1)
式中:ID表示吸入颗粒的剂量(ng·kg-1),fnano代表吸入介质中的纳米材料的质量分数,cinh代表空气中纳米颗粒的浓度(ng·L-1),Qinh代表特定情境下的吸入流量(L·min-1),Tcontact代表每次接触的时间(min),Bw代表体质量(kg)。但在实际评估过程中,cinh通常难以确定。因此,纳米银消费品的暴露剂量分析及它们给人体和环境带来的安全隐患等问题还处于研究的初级阶段,缺少必要的标准和分析流程,亟待进一步的规范和研究。本研究内容是对目前市场上种类较多的纳米银消费品中的纳米银溶出量进行了分析,初步探讨了细胞毒性,后续还需建立更系统完善的评价体系,包括针对不同消费品的材质工艺及暴露途径,建立不同的实验方法和生物安全性评价模型等相关内容,纳米银消费品的安全性分析和系统评价方法的建立还有较大的提升空间。

