IL-10RA基因突变致婴儿型克罗恩病1例
潘思蕊,韩齐,周峻
婴儿型炎症性肠病(infantile onset - inflammatory bowel disease, IO-IBD)指发病年龄<1岁的慢性炎症性肠道疾病,分为婴儿型克罗恩病与婴儿型溃疡性结肠炎。全世界儿童IBD发病率约(2.5~11.4)/10万,IO-IBD的发病率极低,仅占儿童IBD的1%,出生后3个月的发病只有0.25%[1-2]。现报道我院收治1例IO-IBD患者的资料,希望对临床医生的诊疗有所提示。
1 病例资料
患儿,女,47 d,因“间断发热2周”入院。患儿两周前无明显诱因下出现发热,热峰39.3 ℃。有咳嗽无咳痰,解黄色稀糊便3~4次/d,小便可。至当地医院就诊,查WBC 30×109/L,胸部X线示右侧肺炎。予抗感染(药物不详)治疗2 d未见好转;后更换“美罗培南、万古霉素”治疗,体温平稳1周后,再次出现发热,热峰39 ℃,遂转至我院。查CRP 27 mg/L,WBC 23.01×109/L,ESR 96 mm/h,ALT 357.0 U/L,AST 136.0 U/L。拟“脓毒血症、支气管肺炎、肝功能损害”收治入院。既往史:新生儿期双侧足底藓。家族史:父母体健,非近亲婚配,否认家族性遗传病。查体:体温38 ℃,脉搏150次/min,呼吸33次/min,体重4.5 kg。神清,精神可,呼吸稍快。双肺呼吸音粗,可闻及散在痰鸣音。两侧面部可见红色湿疹,无渗液。口唇无发绀,咽部充血,口腔黏膜可见疱疹。腹平软,无压痛反跳痛,肝脾肋下未及。截石位:肛周9点位置黏膜略凸起,无破溃。入院后予美罗培南、夫西地酸钠、阿拓莫兰、美能治疗,住院第5天,复查CRP 43 mg /L,WBC 21.38×109/L;CT示右上肺少许淡絮影,右肺中叶胸膜下片絮影。治疗效果不佳改用利奈唑胺,考虑真菌感染可能,行G/GM实验检查未见异常。第6天患儿由黄色糊状便转稀水便4~6次/d,行粪便轮状病毒检测未见异常。予培菲康、蒙脱石散治疗,腹泻症状未见好转。第7天停用美罗培南改头孢他啶。复查生化AST 52.0 U/L、ALT 41.0 U/L,肝功能恢复。第10天查HB 73 g/L,CRP 44 mg/L,WBC 15.84×109/L,考虑患儿抵抗力差,予静注人免疫球蛋白(2.5 g×3 d)支持治疗。第16天查PLT 29×109/L,CRP 75 mg/L,WBC 13.45×109/L,HB 75 g/L,予血小板、1单位红细胞悬液输注。第18天完善骨穿:属感染骨髓象。血培养示表皮葡萄球菌生长,予美罗培南剂量上调。
治疗期间患儿由普通奶粉更换为水解奶粉喂养,腹泻无改善。住院第15天禁食后体温平稳,大便次数减少。第22天开放喂养,再次出现发热、白细胞及CRP升高、大便次数由<10次/d增加至15~23次/d。再次予以禁食后病情好转,考虑炎症性肠病可能。予以口服低剂量甲强龙(1 mg·kg-1·d-1)。第39天行肠镜检查:直肠、升结肠黏膜可见充血水肿,数枚小溃疡无融合;乙状结肠、降结肠黏膜散在糜烂;横结肠黏膜充血水肿,见数枚大溃疡,溃疡周边乳头状隆起,触之易出血;回肠末端见散在小溃疡。病理示:直、结肠肠黏膜固有膜内可见多量淋巴细胞、浆细胞、嗜酸性粒细胞浸润,部分上皮及腺体破坏,可见隐窝积脓,未见肉芽肿形成,符合Crohn病改变。与患儿家长沟通后行基因检测,结果见图2。第47天加用口服美沙拉嗪60 mg tid。第56天患儿出现肛周脓肿,肛瘘,予伤口引流换药护理,好转中(图1)。第63天停用抗生素,甲强龙改为泼尼松5 mg qd口服,大便性质好转,次数5~7次/d,无腹泻、便血、发热等,复查WBC 11.3×109/L、CRP 9 mg/L、PCT 0.251 ng/mL。家长要求出院,嘱口服美沙拉嗪 60 mg bid、反应停 8 mg qd。后期电话随访,患儿出院后2周行保护性回肠末端单腔造瘘术,等待干细胞移植配型移植,继续随访中。
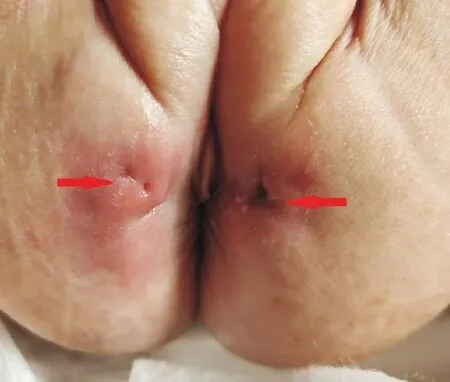
图1 患儿会阴外观 患儿肛周3、9点可见两侧瘘口

图2 患儿及其父母的IL-10RA基因Sanger测序结果(箭头示突变位点) A:患儿突变位点c.251C>T;B:患儿父亲突变位点c.251C>T (p.T84I);C:患儿突变位点c.537G>A;D:患儿母亲突变位点c.537G>A (p.T179T)
2 讨论
IBD的病因目前尚不清楚,遗传因素是IBD发病的关键原因之一[1,3-5]。约有200个基因位点已被确定与IBD相关[6]。自从2009年Glocker等首次报道了IL-10的基因突变以来,有许多研究陆续报道了IL10、IL10RA或IL10RB的突变及其与IBD的联系[1,7-10]。其中IO-IBD主要以IL-10RA基因突变为主[11-13]。本研究采用高通量基因测序筛查出患儿存在IL-10RA基因c.251C>T错义突变(编码区第251号核苷酸由胞嘧啶变异为胸腺嘧啶)导致氨基酸改变 p.T84I(第84号氨基酸由苏氨酸变异为异亮氨酸),及c.537G>A同义突变(编码区第537号核苷酸由鸟嘌呤变异为腺嘌呤)导致氨基酸改变 p.T179T(第179号氨基酸由苏氨酸变异为苏氨酸)。根据美国医学遗传学和基因组学学会(ACMG)指南定义两个位点均为可能致病性变异,且等位基因频率极低(0.00010)[14]。经Sanger测序验证表明,患儿父亲携带c.251C>T (p.T84I)杂合变异、患儿母亲携带c.537G>A (p.T179T)杂合变异。患儿属于IL-10RA基因的c.251C>T、c.537G>A的复合杂合突变。在东亚国家的患者中发现c.C301T (p.R101W)和c.G537A (p.T179T)突变是最常见的变异,而有关c.251C>T位点突变造成的炎症性肠病尚未有报道[15-16]。c.251C>T、c.537G>A 在炎症性肠病上属常染色体隐性性遗传,患儿父母均为单基因杂合变异,无临床表现。本例患儿经过两个月的诊治最终得以确诊。
IO-IBD因其病程短、临床表现复杂而诊断困难。Zheng等分析了全球139例IL-10、IL-10RA或IL-10RB突变的IBD病例的表型,研究表明,大多数IL-10信号缺陷患者发病年龄极早,为6个月,典型表现为肛周病变,最常见的肠外表现为口腔溃疡和皮疹[9,15]。本例患儿,47 d,最初因“肺炎、脓毒血症”入院,考虑病因为感染。但经各种抗生素治疗未见明显好转。治疗1周后出现腹泻且症状不断加重,予以止泻、更换奶粉无效。后期出现肛周脓肿、肛瘘的症状。经禁食后腹泻、发热、血象逐渐稳定,再次开放饮食,情况恶化,结合肠镜及基因检查最终得以确诊。回顾分析,本例患儿最初可考虑IBD的可能。新生儿期的足癣、面部的反复湿疹、肛周的黏膜凸起、较低的血红蛋白浓度等肠外表现及抗感染效果不佳未引起我们足够的重视,且CT结果、血象指标、血培养结果均支持感染诊断,将我们的治疗重点偏离。分析造成诊断困难的原因:①临床病例罕见,对此病的诊断、鉴别诊断、治疗方式认识不到位;②IO-IBD起病初期的临床表现不典型,肠外的症状复杂;③被部分指标误导,治疗重点偏离。我们得到的教训是:当遇到不明原因的发热、迁延性腹泻、抗感染治疗无效,或存在皮肤病变、肛周病变、贫血等(之一)症状的婴儿,应考虑IO-IBD的可能,可行肠镜及基因检测辅助诊断。
目前有关基因突变导致的IO-IBD尚无有效的治愈药物,只能通过免疫抑制剂等对症治疗进行延缓病情[9,15,17]。在我国,抗肿瘤坏死因子-α(抗TNF-α)药物,英夫利昔单抗(IFX)和阿达木单抗(ADA)已被批准用于治疗儿童IBD,IFX是目前最常用的生物制剂[18]。有文献报道早期可积极行外科干预,旷置病变肠段利于炎症控制[19]。但干预时机、手术指征尚无统一认识。同时有研究表明造血干细胞移植可达到持续性的临床缓解[9,15,20],未来这两种治疗方式研究是我们工作的重点。
总而言之,IO-IBD是罕见免疫缺陷性炎症性肠病,多以肠外表现为首发症状。随着国内外IBD患儿病例的增加,儿科临床医生应当提高对此病的认识,尽早发现,改善病情。

