富血小板纤维蛋白联合Bio-oss治疗Ⅱ度根分叉病变的效果分析
陈佳锐 陈邦俊 郑相淮
牙周炎患者的病情较重时,易累及患者下颌第一磨牙的根分叉区病变,出现附着丧失、牙齿松动移位等症状。骨破坏深度不同,根分叉区结构复杂,临床一般采用牙周植骨术—翻瓣术治疗,可消除牙周袋和增加牙周附着,但无法达到牙周组织的再生,而影响临床疗效。有富血小板纤维蛋白(PRF)做成可吸收生物屏障膜,可吸收骨材料(Bio-oss)可为牙周组织恢复提供稳定的支架,两者联合可能会促进患者牙齿病变区牙骨和牙组织的生长,增加牙槽骨密度[1]。基于此,本研究探讨PRF联合Bio-oss治疗Ⅱ度根分叉病变患者的临床效果,现将研究结果报道如下。
1 资料与方法
1.1 一般资料
选择2016年3月-2019年5月在笔者所在医院诊治的60例下颌第一磨牙Ⅱ度根分叉患者。纳入标准:(1)牙周炎患者,诊断为下颌第一磨牙Ⅱ度根分叉病变,标准参考《锥形束CT对离体上颌磨牙根分叉病变诊断的准确性评价》[2];(2)按试验要求完成1个月的牙齿基础治疗;(3)根分叉区牙齿无破损。排除标准:(1)患者处于妊娠期或者哺乳期;(2)依从性较差,不能按时复诊;(3)有根管治疗史。按奇偶数分组法分为联合组(n=30)和对照组(n=30),每组治疗30颗牙。其中联合组男17例,女13例,年龄30~58岁,平均(41.20±10.24)岁;发病时间0.5~3年,平均(2.21±0.55)年。对照组男14例,女16例,年龄28~56岁,平均(40.34±10.21)岁;发病时间 0.8~3.3年,平均(2.43±0.57)年。两组一般资料比较差异无统计学意义(P>0.05),具有可比性。本研究经医院伦理委员会批准,患者了解试验内容后签署知情同意书。
1.2 方法
手术前进行去牙菌斑、牙结石等基础治疗,消除牙周炎导致的牙龈充血、肿大。医生指导患者在术前术后如何正确减少牙菌斑,讲解手术的重要性和目的,预期效果和可能存在的风险。术后可口服抗生素避免细菌感染。
PRF的制备:抽取患者静脉全血于无抗凝剂离心管进行离心,3 000 r/min,12 min,离心后血液分为三层,中间层为PRF,用无菌镊子夹出备用。
对照组选择翻瓣术手术方法治疗。用酒精消毒口腔的黏膜和口周的皮肤,铺无菌巾,使用局部浸润麻醉方法进行麻醉,切开牙槽骨黏膜-膜瓣,暴露病变区,清除病变区的肉芽组织和牙结石,缝合牙龈瓣。术后在伤口放塞治剂防止术区损伤。
联合组选择富血小板纤维蛋白与Bio-oss治疗术。术前方法同对照组,术中行龈沟内切口,尽可能保留牙龈组织,将龈瓣内侧的炎性肉芽组织刮除干净,将根面平整露出新鲜牙骨质,并用EDTA冲洗根面。取PRF膜剪碎,用血液与Bio-oss调成糊状,填充牙根骨缺损区,压得与牙槽骨高度相同,再用剩下的PRF膜覆盖在填充的位置,缝合伤口。
两组随访1年。
1.3 观察指标及疗效判定标准
记录两组临床疗效,牙周指标、牙槽骨密度。(1)临床疗效,根据术后1年回访情况判:显效,经检查显示探诊深度、牙龈情况、牙槽骨密度恢复正常;好转,经检查显示探诊深度、牙龈情况、牙槽骨密度恢复情况达正常的50% ;无效,经检查显示探诊深度、牙龈情况、牙槽骨密度的恢复情况低于正常的50% 。总有效率=(显效+好转)/总例数×100% 。(2)牙周指标:测定患者术前、术后1年探诊深度(牙周袋袋底至龈缘的距离)、牙龈退缩(龈缘至釉牙骨质界)、临床附着丧失(上皮冠方至釉牙骨质的距离)。(3)牙槽骨密度测定:用锥形束CT(型号:PLX3000A)测定患者术前、术后1年牙槽骨密度。
1.4 统计学处理
2 结果
2.1 两组临床疗效对比
联合组治疗总有效率(96.67% )高于对照组(83.33% ),差异有统计学意义(P<0.05),见表1。
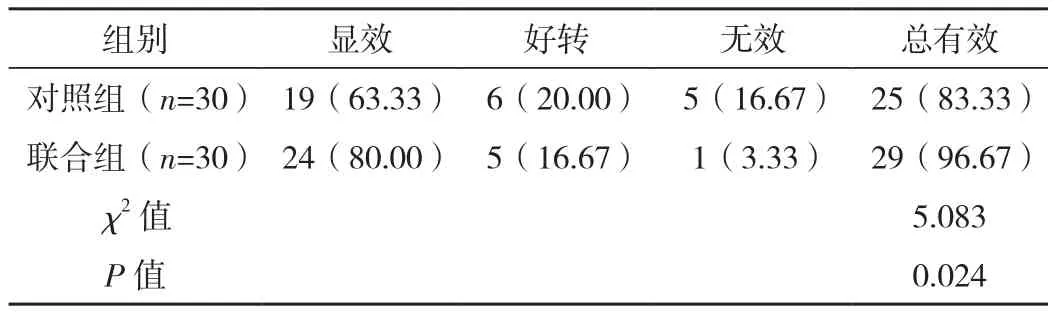
表1 两组临床疗效对比 例(% )
2.2 两组牙周指标对比
术后1年,联合组探诊深度、牙龈退缩、临床附着丧失均低于对照组,差异均有统计学意义(P<0.05),见表2。
表2 两组牙周指标对比 [mm,(±s)]

表2 两组牙周指标对比 [mm,(±s)]
*与同组术前比较,P<0.05。
术前 术后1年 术前 术后1年 术前 术后1年对照组(n=30) 5.55±0.61 2.75±0.41* 0.73±0.12 1.49±0.41* 5.78±1.31 4.38±0.86*联合组(n=30) 5.45±0.58 2.44±0.37* 0.78±0.16 1.28±0.32* 5.65±1.25 3.82±0.61*t值 0.651 3.074 -1.369 2.212 0.393 2.909 P值 0.518 0.003 0.177 0.031 0.696 0.005组别 探诊深度 牙龈退缩 临床附着丧失
2.3 两组手术前后牙槽骨密度对比
术前,对照组和联合组牙槽骨密度分别为(601.37±136.39)、(608.42±140.15)g/cm2,差异无统计学意义(t=-0.197,P=0.844);术后1年,对照组和联合组牙槽骨密度分别为(711.54±111.45)、(762.63±12.28)g/cm2。联合组术后1年的牙槽骨密度高于对照组,差异有统计学意义(t=-2.496,P=0.019)。
3 讨论
口腔牙菌斑、颌创伤一般是牙周炎患者根分叉病变的发病原因,临床手术治疗常用牙龈刮治消除牙齿和牙龈的牙菌斑、牙结石,再通过翻瓣术修复因牙周炎导致的牙槽骨缺损,但其只能使牙周袋变浅,不能再生牙周组织,恢复牙周的正常功能。因此,寻找使牙周功能恢复的治疗方法具有重大的意义。随着口腔材料科学的发展,富含血小板的纤维蛋白联合Bio-oss可促进牙软组织和硬组织的生长[3],将其应用于Ⅱ度根分叉病变的患者,可能会促进患者牙周组织和根分叉区骨的生长,因此,研究分析含富含血小板纤维蛋白与Biooss治疗Ⅱ度根分叉病变的临床效果。
将PRF放在牙龈瓣和根面之间,避免牙龈组织(如牙龈上皮细胞、结缔组织)先附着根面,为牙周成纤细胞生长提供足够的时间和空间。PRF中含大量的细胞因子、生长因子、循环干细胞、白细胞和血小板,诱导牙周组织的再生,同时在PRF下填充Bio-oss作为支撑材料,增加牙槽骨的密度,降低牙齿松动的风险,PRF中的生长因子可促进损伤组织再生,诱导未分化的牙槽骨细胞向成骨细胞转化[4-5]。
本研究中,联合组治疗总有效率为96.67% ,高于对照组的83.33% ,差异有统计学意义(P<0.05),表明PRF联合Bio-oss可有效提高Ⅱ度根分叉病变的临床疗效,可能是因为:通过自体血液分离出来的PRF中含大量纤维蛋白,纤维蛋白能形成纤维蛋白网络结构,网络结构中又含有大量的血小板和干细胞,可刺激诱导牙周软组织的分化再生,促进牙骨质的再生。PRF与Bio-oss骨粉混合,增加了牙槽骨的密度,从而恢复患者牙齿的正常功能。这与沈敏华等[6]研究相符,支持本研究。
探诊深度是测定龈袋与牙周袋的深度,测定值降低代表牙周炎在恢复;牙龈退缩小、临床附着丧失小代表牙龈功能更好。本研究中,联合组术后探诊深度、牙龈退缩、临床附着丧失均低于对照组(P<0.05),表明PRF联合Bio-oss可有效改善患者牙周指标,可能是因为:自体血液分离出的富血小板纤维蛋白通过释放出生长因子和转化因子,刺激牙周组织中牙周膜成纤维细胞分化成牙周膜细胞,而PFR放在牙根与牙龈瓣之间,阻止快速生长的牙龈上皮过早地向骨缺损部位移动,使牙周膜可附着牙根裸露面[7-9],从而降低探诊深度,牙龈退缩,增加临床附着。
牙槽骨密度增加代表牙骨组织在增生成熟。本研究中,联合组术后牙槽骨密度高于对照组(P<0.05)。表明应用PRF联合Bio-oss治疗Ⅱ度根分叉病变,可有效提高患者的牙槽骨密度。可能是因为:PRF可作为屏障阻挡牙龈向根面迁移,将PRF与Bio-oss混合填入牙槽骨缺损部位,PRF中含有大量的生长因子和纤维蛋白等物质,Bio-oss可为牙周组织恢复提供稳定的支架,纤维蛋白在骨缺损部位形成稳定的网状结构,可增加干细胞与生长因子的接触面积,可加快干细胞分化成成骨细胞[10-12],形成成骨,并促进牙龈成纤维细胞的迁移。
综上所述,应用富血小板纤维蛋白与Bio-oss治疗Ⅱ度根分叉病变,可有效提高临床疗效,改善患者的牙周指标,提高其牙槽骨的密度。

