体外模拟子宫微环境诱导大鼠胎盘间充质干细胞分化为子宫内膜上皮细胞模型建立
邸 曼 张千峰 王晶晶 杨弘睚 王晓红*
1.空军军医大学第二附属医院(西安,710038);2.空军军医大学第一附属医院
子宫内膜受卵巢激素调节具有增殖活性和周期性更新的特性[1]。子宫内膜的来源与骨髓干细胞及内膜中残留的胚胎干细胞有关[2]。胎盘间充质干细胞(PMSCs)具备高自我更新和多向分化能力。子宫内膜损伤可出现大量的瘢痕化,导致子宫供血不足影响胚胎着床[3]。随着干细胞技术发展,临床上开始使用干细胞诱导分化,修复子宫内膜。本研究以体外模拟子宫微环境,诱导大鼠PMSCs分化为子宫内膜上皮细胞,为修复子宫内膜提供基础。
1 材料与方法
1.1 实验材料
2月龄SD大鼠,体重150~180g,购自南京君科生物工程有限公司。DMEM培养基(美国HyClone公司),兔抗大鼠波形蛋白抗体、小鼠抗大鼠角蛋白抗体(美国Gibco公司),兔抗大鼠CK7、CK18、CK19、EMA抗体均购自上海钰博生物科技有限公司。
1.2 方法
1.2.1大鼠PMSCs原代培养及传代将雌、雄大鼠合笼,取孕13.5d的SD雌鼠安乐处死,分离胎盘并置于混合酶内消化,用DMEM培养液制成悬液,置培养箱传代。
1.2.2细胞生长曲线测定取PMSCs制备单细胞悬液并调整浓度为2×104/ml,接种到24孔板并培养,绘制14d生长曲线。
1.2.3子宫内膜诱导培养液的制备取正常未孕雌鼠,全麻,在无菌条件取双侧子宫,加入DMEM培养基,离心取上清,-20℃保存。
1.2.4大鼠PMSCs体外诱导分化子宫内膜细胞取大鼠第3代PMSCs加入消化酶,细胞变类圆形终止消化,制成浓度为1×106/ml细胞悬液并接种于培养皿,加入子宫内膜诱导培养液,培养19d,对照组以DMEM培养基培养。当大多数扁平梭形细胞变圆时终止消化。
1.2.5免疫荧光化学法检测细胞中波形蛋白和角蛋白表达取大鼠第3代PMSCs分为实验组和对照组,实验组以1×10-7mol/Lβ-雌二醇及20%子宫内膜诱导培养液培养,对照组以牛血清培养。镜下观察细胞的形态和增殖。以多聚甲醛固定,免疫荧光化学法检测波形蛋白和角蛋白。
1.2.6RT-PCR检查CK7、CK18、CK19、EMAmRNA表达分组同1.2.5。采用RT-PCR检测CK7、CK18、CK19、EMA mRNA表达,以GAPDH为内参。反应条件:94℃反应1min,55℃反应1min,72℃反应1min,35个循环,72℃延长5min。
1.2.7Westernblot检测波形蛋白和角蛋白表达量分组同1.2.5。每组加细胞裂解液提取总蛋白,以Western blot检测波形蛋白和角蛋白,以β-actin为内参。
1.3 统计学处理
2 结果
2.1 大鼠PMSCs形态
自接种至培养瓶时,原代细胞多呈现悬浮圆形;接种7d,倒置显微镜下可见细胞贴壁生长,圆形细胞开始延伸,变成为梭形或不规则形,轮廓清晰,部分细胞呈圆形;培养14d,细胞几乎铺满瓶,细胞漩涡状排列,均为长梭形,可传代。
2.2 细胞生长曲线
细胞数量呈现增长趋势,与培养天数相关。
2.3 大鼠PMSCs分化为宫内膜上皮细胞的形态特征、角蛋白及波形蛋白表达
诱导14d,细胞呈基质细胞改变排列杂乱,核不明显呈梭形或扁平;部分细胞多角形排列成团,核较圆而大,呈现出上皮细胞改变。用胰酶消化时间差法去除基质细胞,加入胰酶1min时,扁平的梭形细胞开始回缩;再消化10min可见扁平梭形细胞基本变圆,多角形细胞仍处于贴壁状态。经过上述消化过程,培养皿内大部分为多角形的上皮细胞,仍混有部分基质细胞;培养2~3d,重复上述消化步骤得到高纯度上皮细胞,上皮细胞排列成团、核圆而大。细胞免疫荧光显示,实验组大部分细胞呈绿色荧光,即为角蛋白表达;对照组仅胞核为蓝色荧光,说明PMSCs表达波形蛋白但不表达角蛋白,诱导后的细胞角蛋白阳性,即呈现上皮细胞改变。见图1(2485页)和图2(2485页)。
2.4 CK7、CK18、CK19、EMA mRNA表达比较
实验组CK7、CK18、CK19、EMA mRNA表达均高于对照组(P<0.05)。见表1。
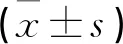
表1 各组CK7、CK18、CK19、EMAmRNA相对表达量比较
2.5 波形蛋白和角蛋白的表达比较
实验组波形蛋白表达(0.32±0.16)低于对照组(0.88±0.31),角蛋白表达(2.91±1.07)高于对照组(1.04±0.01)(t=7.230、3.495,P=0.005、0.040)。
3 讨论
PMSCs具有分化为成骨细胞、子宫内膜上皮细胞等多种类型细胞潜能[15]。基底层是子宫内膜的重要组成部分,与月经周期、功能层更新、脱落及再生等生理功能紧密相关[4]。因而子宫内膜受到损伤可影响生殖能力[5]。
在人和大鼠的子宫内膜微环境中,PMSCs可分化为子宫内膜上皮细胞[6]。如本文结果显示,取孕13.5d的SD大鼠胎盘分离得到PMSCs,自接种至培养瓶时,原代细胞多呈现悬浮圆形;接种7d镜下可见细胞贴瓶壁生长,圆形细胞开始延伸,变成为梭形或不规则形;培养14d后细胞几乎铺满瓶,呈漩涡状的长梭形细胞。加入子宫内膜诱导培养液诱导分化,当大多数细胞变圆排列成团时,提示PMSCs分化为子宫内膜上皮细胞。子宫内膜上皮细胞具有良好的修复功能,可促进受损的子宫内膜妊娠。如有研究表明[7],采用机械法制备宫腔粘连大鼠模型,与模型组相比,股静脉注射脐带间充质干细胞外泌体大鼠的炎症显著消退,胶原纤维组织消减,子宫内膜基本恢复正常,修复损伤子宫内膜并成功妊娠;人源骨髓间质充质干细胞迁移到受损的子宫内膜血管,通过旁分泌分子诱导内膜周围的细胞增殖,提高内膜的抗炎功能,促进子宫内膜增殖[8]。本研究通过制备子宫内膜诱导条件培养液,模拟子宫内膜微环境,诱导PMSCs分化为子宫内膜上皮细胞,使用子宫内膜诱导培养液及1×10-7mol/Lβ-雌二醇培养,分化为子宫内膜上皮细胞。与文献报道一致[9]。
细胞角蛋白可有效维持上皮细胞的形态完整性[10]。波形蛋白可维持细胞器和细胞核之间的特定空间。本研究显示,实验组PMSCs细胞的波形蛋白表达降低,角蛋白表达增高,进一步证实诱导后PMSCs成功向子宫内膜上皮细胞分化。与文献报道一致[11]。另外本研究结果显示,实验组CK7、CK18、CK19与EMA等表达均高于对照组,说明实验组模拟子宫微环境成功诱导了PMSCs分化为子宫内膜上皮细胞。与文献报道一致[12]。
综上,在内源性间质干细胞和外源性因素作用下(如子宫内膜诱导培养液与雌激素),PMSCs可分化为子宫内膜上皮细胞,为不孕患者使用PMSCs治疗提供一定理论依据。

