五味子乙素对帕金森病小鼠中脑黑质氧化应激及神经营养因子的影响
贾 璐 , 樊慧杰 , 王 青 , 李彦青 , 郭敏芳 , 肖保国 , 柴 智 , 马存根,
(1. 山西中医药大学多发性硬化益气活血重点研究室 神经生物学研究中心 , 山西 晋中 030619 ; 2. 山西大同大学脑科学研究所 , 山西 大同 037009 ; 3. 复旦大学华山医院神经病学研究所 ,上海 静安 200025)
帕金森病(Parkinson's disease,PD)是一种好发于中老年人群的神经退行性疾病,由于中脑黑质多巴胺(Dopamine,DA)能神经元丢失,患者出现静止性震颤、运动迟缓、肌肉僵直、步态异常等临床症状。有学者预计,PD的全球流行率将在2040年翻倍,成为增长速度最快的神经退行性疾病[1]。目前,PD的发病机制尚未完全解析,但越来越多的研究表明,氧化应激是驱动DA能神经元丢失的关键因素。当机体氧化与抗氧化功能失调时,大量蓄积的活性氧(Reactive oxygen species,ROS)会对脑细胞造成氧化损伤,致使DA能神经元坏死[2]。神经营养因子是神经细胞的有效调节因子,在神经系统发育过程中可促进神经元的生存与再生,与DA合成和维持DA能神经元的功能密切相关[3]。因此,氧化应激、神经营养因子可能是PD病理干预的重要靶点。
近年来,一些中药及其有效成分对PD的防治作用日益明朗[4-5]。五味子乙素(Schisandrin B,Sch B)是从中药五味子中分离提取的一种活性物质,具有抗氧化、抗炎、抗肿瘤等药理活性。多项研究表明,Sch B对神经元具有保护作用[6-7],但目前尚无围绕Sch B对PD小鼠脑组织氧化应激水平和神经营养因子表达影响的报道。基于此,本试验采用1-甲基-4-苯基-1,2,3,6-四氢吡啶(1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine,MPTP)诱导的PD小鼠作为模型动物,通过检测Sch B对PD小鼠脑部超氧化物歧化酶(Superoxide dismutase,SOD)和过氧化氢酶(Catalase,CAT)活性、还原型谷胱甘肽(Glutathione,GSH)和丙二醛(Malondialdehyde,MDA)含量,以及脑源性神经营养因子(Brain-derived neurotrophic factor,BDNF)和大脑多巴胺神经营养因子(Cerebral dopaminergic neurotrophic factor,CDNF)水平的影响,探究Sch B作为PD治疗药物的潜能。
1 材料与方法
1.1 主要试剂 Sch B,购自成都曼斯特生物科技有限公司;MPTP,购自美国Sigma公司;酪氨酸羟化酶(Tyrosine hydroxylase,TH)、Alexa Fluor 594标记山羊抗兔IgG二抗抗体,均购自英国Abcam公司;SOD、CAT、MDA及GSH试剂盒,均购自南京建成生物工程研究所;BDNF ELISA试剂盒(检测范围:25~800 pg/mL,批内变异系数与批间变异系数分别小于10%和15%)和CDNF ELISA试剂盒(检测范围:31.25~1 000 pg/mL,批内变异系数与批间变异系数分别小于10%和15%),均购自上海酶联生物科技有限公司。
1.2 主要仪器 冰冻切片机(CM 1950)、倒置荧光显微镜(DM40008/DFC450C),德国LEICA公司;全波长酶标仪(Spectramax 384 plus),美国Molecular Devices公司。
1.3 实验动物 30只8~10周龄雄性C57BL/6小鼠(体重20~25 g),购自北京维通利华实验动物有限公司,许可证号:SCXK(京)2016—0006。实验动物在室温(23±1) ℃,相对湿度40%~60%标准动物饲养室内适应性饲喂1周。
1.4 试验方法
1.4.1 分组与造模 将小鼠随机分成正常组、模型组和Sch B组,每组10只。灭菌生理盐水溶解MPTP后腹腔注射制备PD小鼠模型,第1天注射剂量为15 mg/(kg·bw),第2天为20 mg/(kg·bw),第3~7天均为30 mg/(kg·bw),每次注射间隔24 h。
1.4.2 药物治疗 从造模第1天起,Sch B组按照每天80 mg/(kg·bw)剂量灌胃,模型组和正常组小鼠予以等体积0.5%羧甲基纤维素钠灌胃,灌胃持续10 d。
1.4.3 旷场分析 末次灌胃24 h后采用旷场分析系统(Smart 3.0软件)检测小鼠自主行为。同时将4只小鼠分别放入4个敞箱底面中央,记录连续5 min内小鼠的活动情况,获得小鼠活动总距离、平均速度、休息时间和运动轨迹。每只小鼠测试3次取平均值,每次间隔10 min以上。试验在安静环境下进行,每次测试完毕用酒精清除气味,避免干扰。
1.4.4 样本制备 用10%水合氯醛(0.2 mL/只)腹腔注射麻醉小鼠后,推注生理盐水(20 mL/只)进行心脏灌注。每组取5只小鼠进行4%多聚甲醛(20 mL/只)固定,分离脑组织经脱水、OCT包埋后进行低温切片(厚度为10 μm),用于免疫荧光染色。各组其余5只小鼠冰上取中脑黑质,用于氧化应激指标及神经营养因子检测。
1.4.5 免疫荧光染色检测黑质TH 将脑切片于PBS中浸泡15 min,TH抗体经PBS稀释(1∶600)后4 ℃孵育过夜,次日PBS洗涤(5 min/次×3次),加入二抗室温孵育2 h,PBS洗涤(5 min/次×3次)。50%甘油封片,荧光显微镜下观察、拍照(100倍)。采用Image J软件分析荧光强度。
1.4.6 SOD、CAT、GSH、MDA检测 中脑黑质称重,按照质量∶体积=1∶9加入生理盐水,用组织匀浆器在冰上充分研磨制备10%脑组织匀浆液,5 000 r/min离心10 min后取上清,按照试剂盒说明书测定各组小鼠SOD、CAT活性及GSH、MDA含量。
1.4.7 ELISA检测BDNF、CDNF含量 用样品稀释液稀释1.4.6中获得的脑组织匀浆上清,取50 μL加入酶标包被板中,并加入酶标试剂100 μL,37 ℃温育60 min,洗涤后加入显色试剂避光显色15 min,随后加入终止液终止反应,450 nm波长测量各孔吸光度(OD值)。
1.5 统计分析 采用GraphPad Prism 5. 0软件进行数据分析,计量资料以平均值±标准误表示,多组间比较采用单因素方差分析,两两比较使用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 Sch B对PD小鼠行为学影响 旷场试验结果如图1所示,与正常组相比,模型组小鼠活动总距离和平均速度显著减少(P<0.01),休息时间明显增加(P<0.05),活动路线简单,且在敞箱中央区域活动减少。与模型组比较,Sch B干预后小鼠活动总距离和平均速度显著增加(P<0.01),休息时间明显缩短(P<0.05),活动路线复杂多变,进入敞箱中央区域活动增加。

图1 各组小鼠活动距离、平均速度、休息时间和自主活动路线比较Fig.1 Comparison of the total distance,mean speed,resting time and route of autonomous movement of mice in each groupA:各组小鼠活动总距离; B:各组小鼠平均速度; C:各组小鼠休息时间; D:各组小鼠自主活动路线与模型组相比,*:P<0.05,**:P<0.01; 下同A:Total distance of mice in each group; B:Mean speed of mice in each group; C:Resting time of mice in each group; D:Route of autonomous movement of mice in each groupCompared with the model group,*:P<0.05,**:P<0.01. The same as below
2.2 Sch B对PD小鼠黑质TH阳性神经元影响 免疫荧光染色结果如图2所示,与正常组相比,模型组小鼠中脑黑质区TH荧光强度明显减弱(P<0.01)。与模型组相比,Sch B组TH荧光强度显著增强(P<0.01)。

图2 各组小鼠黑质TH荧光强度比较Fig.2 Comparison of fluorescence intensity of TH in substantia nigra of mice in each groupA:正常组; B:模型组; C:五味子乙素组; D:各组小鼠TH荧光强度比较A:Normal group; B:Model group; C:Sch B group; D:Fluorescence intensity of TH of mice in each group
2.3 Sch B对PD小鼠黑质SOD、CAT活性及GSH、MDA水平影响 结果如图3所示,与正常组相比,模型组小鼠SOD、CAT活性及GSH含量下降(P<0.05,P<0.01,P<0.01),MDA含量升高(P<0.01);与模型组相比,Sch B组小鼠SOD、CAT活性及GSH水平上升(P<0.05,P<0.05,P<0.01),MDA含量下降(P<0.01)。
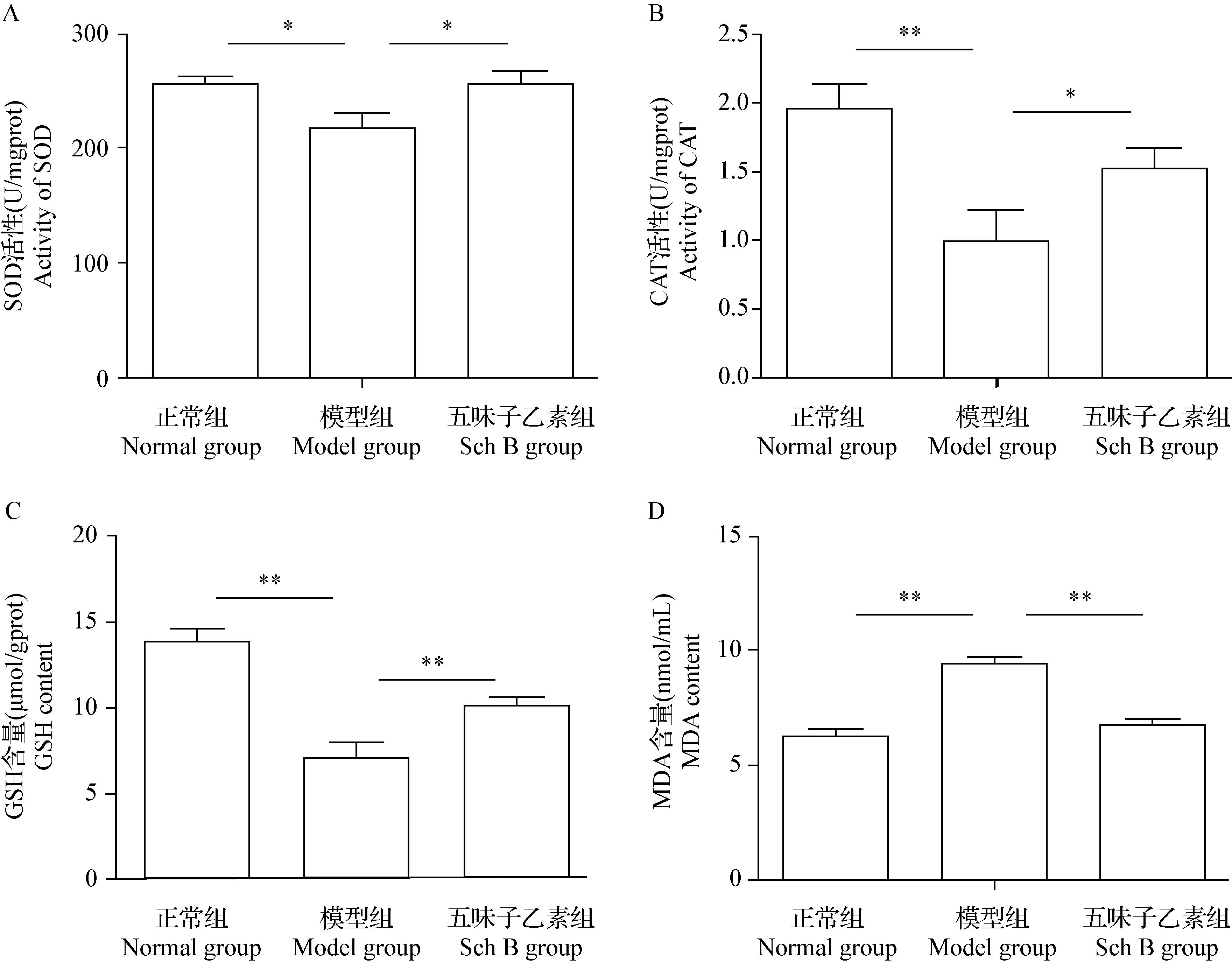
图3 各组小鼠黑质SOD、CAT活性和GSH、MDA含量比较Fig.3 Comparison of activity of SOD,CAT and content of GSH,MDA in substantia nigra of mice in each groupA:各组小鼠SOD活性; B:各组小鼠CAT活性; C:各组小鼠GSH含量; D:各组小鼠MDA含量A:SOD activity of mice in each group; B:CAT activity of mice in each group;C:GSH content of mice in each group; D:MDA content of mice in each group
2.4 Sch B对PD小鼠黑质BDNF和CDNF水平影响 ELISA结果如图4所示,与正常组相比,模型组小鼠脑组织中BDNF和CNDF的表达均显著降低(P<0.01,P<0.05);与模型组相比,Sch B组小鼠BDNF和CNDF水平显著升高(P<0.01)。
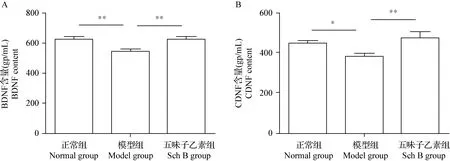
图4 各组小鼠黑质中BDNF和CDNF水平比较Fig.4 Comparison of content of BDNF and CDNF in substantia nigra of mice in each groupA:各组小鼠BDNF含量; B:各组小鼠CDNF含量A:BDNF content of mice in each group; B:CDNF content of mice in each group
3 讨论
PD是一种全球发病率仅次于阿尔兹海默病的中枢神经退行性疾病,临床上主要表现为运动功能障碍。Sch B是从中药五味子中提取出的一种有效成分,属于联苯环辛二烯衍生物,可通过多种生物学活性发挥神经保护作用。例如,Sch B可通过抗氧化作用缓解阿尔兹海默病模型小鼠的认知功能障碍[6,8];在6-OHDA诱导的PD小鼠体内,Sch B能够通过下调miR-34a保护黑质DA能神经元[9]。本试验利用MPTP建立了PD小鼠模型,并通过行为学观察和TH免疫荧光染色对模型进行了评估。TH作为一种DA合成限速酶,其含量会随着PD小鼠DA能神经元退行性丢失而减少[10]。本试验发现,造模后小鼠在新异环境中的自主行为和探究行为均显著下降,且黑质区TH 荧光强度明显减弱,说明小鼠出现了PD的运动功能障碍相关症状及DA能神经元丢失,提示PD小鼠模型制备成功;而Sch B干预可以保护MPTP诱导的PD小鼠黑质DA能神经元,并改善其运动功能。
尽管PD的病因还未完全解析,但氧化应激是公认的与PD发病密切相关的重要因素。氧化应激发生于细胞的氧化还原活性失调之时,ROS的产生超过了机体的清除能力从而大量蓄积,导致神经细胞受到氧化损伤,功能和结构的完整性被破坏而死亡。氧化应激是PD初始阶段的一个重要特征,来自PD早期患者的临床数据显示,在大量DA能神经元丢失之前,机体的氧化应激水平已经升高,提示过量ROS的产生是DA能神经元死亡的潜在致病因素,而非进行性神经退行变性的继发应答[11]。SOD和GSH是体内自由基的有效清除剂,SOD的活性和GSH的含量可作为衡量机体抗氧化能力的重要指标;CAT能够清除体内过氧化氢,其酶促活性为机体提供了抗氧化防御机理;MDA作为脂质过氧化产物,其含量反映了机体受氧化损伤的程度。本试验结果显示,MPTP诱导的PD小鼠脑组织中SOD、CAT活性和GSH含量显著下降,MDA含量明显上升,说明PD小鼠脑内发生了氧化应激,导致氧化产物积累。而Sch B干预则明显提高了SOD、CAT活性和GSH含量,并有效减少了MDA产生,提示Sch B能够提高PD小鼠脑内抗氧化能力,减少脂质过氧化发生,从而缓解氧化应激对DA能神经元的损伤。
神经营养因子是对中枢和外周神经元的发育、增殖、存活和再生具有促进作用的一类生长因子。在PD患者和模型动物体内,多种神经营养因子的减少提示它们与PD的发生发展密切相关[3,12-13]。BDNF是脑中含量最多的一种神经营养因子,已被证明可以促进发育中的中脑DA能神经元存活,并保护纯培养的中脑DA能神经元免受1-甲基-4-苯基吡啶离子(1-methyl-4-phenylpyridinium,MPP+)的毒性作用[14]。将BDNF注入大鼠黑质可部分逆转PD大鼠DA能神经元的丢失,多种药物对PD模型动物的保护作用也均与调节BDNF表达有关[15-16]。CDNF是近年来发现的一种神经营养因子,在6-OHDA诱导的PD大鼠模型中,CDNF可改善PD的运动功能障碍,增强神经干细胞向损伤纹状体的增殖和迁移,并有效保护中脑DA能神经元[17-18];在MPTP诱导的PD小鼠模型中,同样观察到CDNF对损伤的黑质纹状体系统具有神经保护和神经修复作用[19]。本试验检测到PD小鼠脑内BDNF和CDNF显著下调,而Sch B可以有效上调BDNF和CDNF含量,提示Sch B可以促进神经营养因子分泌,在一定程度上改善PD小鼠脑内的神经营养状态,从而促进DA能神经元存活。目前,人类已经开启了神经营养因子干预PD的前期临床研究,促进神经营养因子表达有望成为治疗PD的新策略[20]。
综上所述,Sch B对MPTP诱导的PD小鼠具有神经保护作用,这可能是通过提高脑内抗氧化能力、改善神经营养状态实现的,但其中涉及的具体分子机制还有待进一步研究。

