影响大肠杆菌定植动物肠道的相关因素
曹婷婷 , 王少林
(中国农业大学动物医学院 , 北京 海淀 100193)
哺乳动物出生后几乎立即产生一个存在于胃肠道新的微生物生态系统。哺乳动物胃肠道中定植的菌群面临着来自宿主和竞争微生物的巨大挑战,其中包括肠道蠕动排出内容物,宿主细胞和竞争菌群产生的抗微生物剂,以及肠道菌群的营养竞争,从而导致肠道产生定植抗性[1]。大肠杆菌均可在适宜条件下定植于哺乳动物肠道内,通常被认为是第1个在动物和人类肠道定居的细菌,并且终生存活于体内。然而,目前关于大肠杆菌如何定植肠道的机制尚不完全清楚。因此,了解大肠杆菌在哺乳动物肠道内定植的相关因素,以及定植抗性产生的原因及影响因素,可及时采取应对措施,从而保障人类健康。
1 肠道菌群的构成
微生物在动物宿主肠道内形成复杂的生态系统,其基因比人类基因组多150倍以上,而且这些微生物比人类宿主具有更大的代谢能力[2]。与人体其他器官(例如皮肤、阴道和耳朵)相比,人类肠道尤其是大肠,在体内具有最多的微生物群。肠道中丰富的微生物群落中有数万种细菌,这些细菌属于数百种不同的物种。然而,从食道到直肠的整个生命周期中,微生物分布都存在动态变化[3]。肠道菌群的组成和肠道的完整性屏障功能对于宿主的健康非常重要。不仅在于肠道菌群形成黏膜屏障,而且也参与食物消化,刺激免疫功能。同时,它们被视为与人类疾病相关(包括癌症)的内在环境因素。
1.1 分类与分布
人体消化道由胃、小肠和大肠3个器官组成,大多数人类微生物组研究的重点为大肠的微生物群[4]。每个人肠道中估计有150~400种物种组成,这些菌种中大多数属于厚壁菌、拟杆菌、放线菌和变形杆菌(图1)。这些分类单元中每个分类的相对比例在个体之间,甚至个人内部之间都存在显著差异[5-7]。硬毛菌门主要是由革兰阳性菌组成(如艰难梭菌)。拟杆菌门主要包括拟杆菌、黄杆菌和鞘脂杆菌。放线菌为对胃肠道有益的革兰阳性菌(如双歧杆菌),常用于益生菌制剂。变形杆菌为革兰阴性菌,最显著的是肠杆菌科(如大肠杆菌和肺炎克雷伯菌)。
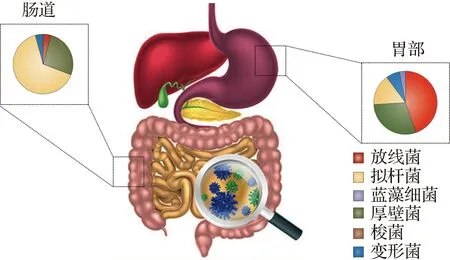
图1 人体胃部和肠道主要微生物组成根据文献[8]绘制
1.2 肠道菌群的功能作用 肠道菌群具有3个主要功能:代谢、营养和保护性。哺乳动物肠道具有大量的共生微生物,这远远超过寄生宿主的数量。肠道菌群可产生短链脂肪酸和维生素,从而确保宿主健康和代谢功能,同时还可参与肠上皮细胞生长、繁殖和分化。大肠杆菌作为哺乳动物胃肠道中主要的兼性厌氧菌,与肠道中其他厌氧菌具有共生关系。厌氧菌可降解复杂的多糖,为大肠杆菌提供单糖和二糖。大肠杆菌可通过清除氧气制造厌氧环境。微生物群落的组成反应了宿主和微生物的共同进化关系,从而达到平衡、互利的状态。
胃肠道的微生物群正在成为控制动物机体健康和疾病的主要因素,其在宿主体内的基本功能证明其重要性。这些功能主要包括将难消化的食物成分发酵成可吸收的代谢物,机体必需维生素的合成,有毒化合物的消除,病原体的竞争,肠道屏障作用的增强以及免疫系统的刺激和调节[9]。这些功能大部分是相互关联的,并且与宿主生理学紧密相关。健康的肠道微生物群在维持免疫稳态方面起着至关重要的作用。
2 大肠杆菌的特性
大肠杆菌为革兰阴性杆菌,是哺乳动物胃肠道中的主要兼性厌氧菌。通常情况下大肠杆菌在盲肠和结肠黏液层中以无害的方式持续存在(图2)[10]。由于大肠杆菌的生长方式和表型的广泛性,是研究对不同生长条件和生态位适应性的最合适的生物模型。在早期人体肠道内存在共生性和致病性大肠杆菌,也有极大的可能性存在耐药性大肠杆菌。大肠杆菌主要定植于人类和其他哺乳动物的肠道内,并可通过粪便和废水处理排放到环境中。大肠杆菌菌株几乎可对所有主要类别抗生素产生耐药性,包括产广谱β-内酰胺酶(ESBL)、对氨基糖苷类、氟喹诺酮类、多黏菌素和磺胺甲基异噁唑/甲氧苄啶耐药[11]。

图2 动物肠道内大肠杆菌的特性
大肠杆菌可定植于人体的各个位置,定植的优先部位是肠道,尤其是大肠和盲肠。共生菌位于肠道的黏液层,大肠杆菌将其作为代谢的营养物质来源,从而生长繁殖。大肠杆菌惊人的新陈代谢和调控能力促进了其在不同生态环境中的定植,包括环境和食物。然而,随着大肠杆菌菌株进化,一部分致病性菌株可以引起不同的疾病现象。
3 定植抗性
肠道菌群是一个复杂的微生物生态系统,并且受到众多环境因素影响,例如:出生方式、母乳、营养、抗生素和外界压力等。细菌定植是指各种微生物(细菌、真菌等)从不同环境进入其寄生或共生宿主,并能在一定部位(如胃肠道)定居和不断生长、繁殖后代[12-13]。而肠道作为一个复杂的微生物菌群载体,其影响定植的因素较为复杂。
从细菌的角度,成功定植于肠道是一项艰巨的任务。细菌通过自然环境(水源)进入动物机体,经食道、胃,通过肠道内找到合适的生长位置,获得营养开始菌群的复制。当入侵菌群复制到足够数量后才能抵抗肠道蠕动,以此避免被肠道清除。在此过程中,侵入的菌群必须不断与已建立的肠道微生物群落竞争并争夺其生态位和营养,并应对宿主菌群产生的免疫反应。因此,定植抗性在幼年动物肠道微生物群发育和保护动物肠道免受病原体侵袭中起着重要作用。
3.1 定植抗性的产生 在肠道中,为防止外源病原微生物入侵,定植抗性可能是资源竞争、空间排斥或共生微生物直接抑制的结果,也可能是宿主因素介导[14]。二十世纪五六十年代,有研究发现,经链霉素处理的小鼠增加了对致病性肠道沙门菌和共生大肠杆菌的易感性,从而提出了“定植抗性”。动物健康机能过程中,在没有抗生素暴露条件下,肠道微生物群可以通过病原微生物来抑制定植和过度生长。这种现象称为“抗定植化”,与肠道稳定而多样的微生物群串联在一起,并控制着炎症的发生,其涉及与黏膜免疫系统和微生物群之间的特定相互作用[15]。当肠道平衡系统中所有生态位被肠道菌群占据时,就会发生定植抗性。
3.2 定植抗性的影响因素 细菌物种对肠道定植能力取决于其利用有限营养物质的能力。对大肠杆菌而言,病原菌的抗性产生是由营养物质介导的。肠道内源性菌群在定植抗性中起着不可或缺的作用,而抗生素的使用也可影响肠道菌群的定植抗性。在抗生素治疗期间,具有药物抗性的肠杆菌可以在动物体内定植[16]。因此,影响定植抗性的主要因素为微生物群繁殖的抑制产物的消耗,抗生素的使用和肠道营养物质的利用[15,17-19]。
3.2.1 肠道微生物—微生物—宿主间的相互作用 肠道菌群在正常肠道功能和维持宿主健康中起着重要作用。肠道宿主菌对外源性入侵病原体的生长具有抑制作用,这种肠道微生物—微生物之间的相互作用是定植抗性的关键组成部分。肠道菌群具有多种可利用生态位,其中一种微生物代谢副产物可能成为另一种微生物的生长底物。肠道微生物通过对营养的消耗,从而抑制其他菌群的定植。肠道内微生物群的代谢活动可抑制入侵病原体的生长和致病基因的表达。短链脂肪酸(Short chain fatty acid,SCFA)为致病性肠杆菌科致病基因表达的抑制剂,同时SCFA的产生还可导致肠道局部pH的降低,从而抑制大肠杆菌在体内的复制速度。肠道内微生物群的代谢活动同时减少了肠腔内O2含量,这种厌氧环境可限制大部分病原体毒力的产生[20]。
然而,人们对宿主微生物群如何与哺乳动物互作以建立互利关系知之甚少。有研究表明,肠道菌群可通过上皮细胞来影响肠道功能[21]。例如,管腔内微生物群影响胃肠道生物活性肽的释放,并有助于调节胃肠道内分泌细胞和上皮结构。Toll样受体(TLR)和核苷酸结合寡聚化样受体(NOD)是关键的宿主受体。这些受体位于特定的宿主细胞器内和细胞质内,从而识别肠道微生物及其产物。TLR/NOD分别对病原体启动宿主防御和炎症的反应至关重要。肠道固有层特定的T细胞对建立和维持定植抗性具有重要意义。有研究表明,小鼠肠道内微生物群似乎可以促进Th17细胞活化,这与定植抗性的增加有关[22]。
3.2.2 肠道对大肠杆菌营养限制作用 肠道定植的重要环境因素是饮食的性质。由于食物中的脂肪酸和简单碳水化合物在通过小肠过程中会被吸收和消耗,因此结肠细菌生态系统的可持续性通过复杂多糖的发酵来延续,而复杂多糖是菌群到达结肠的主要碳源[14]。肠道中拟杆菌属能够分解来自饮食和宿主的多糖物质,它通过表达诸如糖基转移酶、糖苷水解酶和多糖裂解酶来进行代谢。拟杆菌属具有1个可编码260多种水解酶的基因组,远远超过人类基因组编码的数量。肠道菌群对脂质代谢、蛋白质代谢和维生素代谢均会产生影响。拟杆菌可通过上调脂酶的表达来提高脂水解的效率;肠壁细胞壁上的集中氨基酸转运蛋白可促进氨基酸从肠腔进入细菌[23]。
微生物菌群在肠道定植的营养物质主要来源于肠道脱落的上皮细胞、膳食纤维和黏膜多糖,而大肠杆菌主要利用单糖和低聚糖(糊精)。为了成功在肠道中定植,大肠杆菌必须竞争限制营养素,一次可利用多种糖,且对营养素的需求灵活,这依赖于肠道内糖原的储存。肠道营养素的竞争方式主要为:通过利用肠道共生菌不需要的营养素;菌体自身加快繁殖生长;与厌氧菌发生共生关系,释放其优选的糖类。与厌氧菌相比,大肠杆菌不能分泌细胞外多糖水解酶,因为不能降解膳食纤维衍生物和黏蛋白衍生的寡糖和多糖,因此提出“Restaurant”假说,肠道共生大肠杆菌可在肠道定居生长,猜测其利用分解厌氧菌(可降解多糖)提供单糖、二糖和麦芽糖糊精[24]。
3.2.3 抗生素的使用 抗生素的使用,主要用于预防和治疗各种细菌感染。但近年来,各项研究表明,使用抗生素对正常肠道菌群的生态环境产生短期和长期的影响[3]。健康肠道菌群对抗病原体的主要特性之一是引起竞争排斥的能力,而抗生素可能会导致竞争性排斥机制的破坏,从而导致抗生素治疗后感染其他病原菌。药代动力学主要研究药物在动物机体代谢过程,这有助于了解其对肠道微生物的影响。理论上,药物只有通过口服直接作用于肠道,才能改变肠道微生物群,但是全身给药也能间接到达肠道。考虑肠道对抗生素的吸收也至关重要,包括肠道黏膜结构的完整性,抗生素的特性以及对药物的转运机制。被肠道容易吸收的抗生素会导致肠腔内的最终浓度低,从而会减少对肠道微生物群的影响[25]。
目前用于研究大肠杆菌定植肠道的动物模型具有一定的局限性。而小鼠由于其体态大小,较短的传代时间和遗传特征,常作为研究肠道菌群动物模型。然而,常规饲养的成年小鼠通常对大肠杆菌具有定植抗性[26]。链霉素可抑制兼性厌氧菌生长,常用于清除定植动物模型的定植抗性[27-28]。经链霉素处理的小鼠肠道模型,由于药物打乱肠道正常菌群,这有利于其他致病菌或耐药菌株的定植。除了改变正常肠道微生物多样性外,广谱抗生素的使用也引起了人们的关注,主要是通过水平基因转移传播耐药菌株的现象。已有研究表明,人类肠道微生物进行水平转移的可能性比其他环境高25倍[29]。
4 展望
近年来,关于肠道菌群定植的研究一直备受关注,但很少有关于探究大肠杆菌在动物肠道定植因素的报道。本文系统阐述了哺乳动物肠道内微生物环境及菌群特征,以及对肠道菌群的定植抗性产生及影响因素,为未来定植抗性疗法提供理论依据。肠道早期对定植菌接触会影响动物的消化、生长和发育,这对动物养殖生产性能产生极大的影响。通过提高饲养管理水平,益生菌的补充以及粪菌移植等方法来改良动物肠道环境,增强其肠道免疫机能,这都是切实可行的解决方案。

