新型鸭呼肠孤病毒山东株的分离鉴定及致病性分析
马 芹 , 许明清 , 汪建华 , 赵 杰 , 张中波 , 石艳红 , 李玉峰 , 张秀美
(1. 山东和康源生物育种股份有限公司 , 山东 济南 250102 ; 2.山东省农业科学院家禽研究所 , 山东 济南 250031 ;3. 山东省农业科学院畜牧兽医研究所 , 山东 济南 250100)
新型鸭呼肠孤病毒(Novel duck reovirus,NDRV)感染最早发生在我国南方地区,北方较少报道[1-3],自2015年开始,北方樱桃谷鸭的NDRV检出率明显增高[4-5]。近2年,NDRV在山东地区的樱桃谷鸭中广泛流行,主要引起雏鸭精神沉郁、食欲废绝,消瘦,跗关节肿胀、腿软等一些特征性的症状[6-8],料肉比明显升高,剖检可见脾脏出血、坏死,机体免疫力下降,进而继发感染导致较高的死亡率[9];同时关节肿胀、瘸腿现象较为严重,造成了较高的淘汰率,给养殖带来了巨大困扰。近日,山东菏泽樱桃谷部分鸭出现脾脏坏死、瘸腿症状,本课题组通过对8个鸭养殖区进行调研,了解到腿病主要发生于6~8周龄的雏鸭,并且发病鸭大多表现脾脏异常,据此初步怀疑与新型鸭呼肠孤病毒有关。本试验从病死鸭中采集肝脏、脾脏,进行病原的分离鉴定、纯化培养及致病性分析,探究新型鸭呼肠孤病毒是否为引发脾脏坏死、瘸腿症状的原因,以期为该病的综合防控提供科学依据。
1 材料与方法
1.1 病料 山东菏泽地区商品肉鸭养殖场10日龄发病鸭。
1.2 试验用鸡胚、动物、细胞 7日龄SPF鸡胚,购自山东斯帕法斯公司;1日龄商品鸭、35周龄健康樱桃谷种鸭,均购自山东和康源生物育种股份有限公司;Vero细胞由本实验室提供。
1.3 主要仪器与试剂 PCR仪,购自伯乐生命医学产品有限公司;凝胶成像系统,购自北京赛智创业科技有限公司。RNA提取试剂盒,购自爱思进生物技术有限公司;RT-PCR反应试剂盒,购自南京诺唯赞生物科技有限公司。
1.4 方法
1.4.1 病料处理 无菌采集发病鸭的肝脏和脾脏,剪碎后按1∶3比例加入无菌PBS溶液,充分研磨制备组织悬液,反复冻融3次后8 000 r/min离心10 min,取上清液用于病毒核酸的提取,具体提取步骤参考试剂盒内说明书。
1.4.2 病原鉴定 根据GenBank 中登录的新型鸭呼肠孤病毒S1基因序列,利用Primer 5软件设计特异性鉴定引物,上游引物为5′-ACCTCAGGATATCGCTGAAACT-3′,下游引物为5′-CTCCATCCCTGCAGCACATGTAAAG-3′。RT-PCR扩增体系:2×Mix 12.5 μL,One-step Mix 1.25 μL,上游引物1 μL,下游引物1 μL,病毒RNA 2 μL,ddH2O 7.25 μL。扩增程序:50 ℃ 30 min,94 ℃ 5 min,95 ℃ 30 s,54 ℃ 30 s,72 ℃ 1 min 20 s,72 ℃ 8 min,扩增结束后在凝胶成像系统下进行观察,胶回收后连接转化并进行测序分析。
1.4.3 病毒的分离培养 将1.4.1制备的组织悬液经0.22 μm滤器过滤后,接种于7日龄SPF鸡胚尿囊腔,接种量为0.2 mL/只,胚体放置于37 ℃温箱内培养,每天观察胚体情况,弃去24 h内死亡鸡胚,收取24~144 h内死亡鸡胚的尿囊液及胚体,研磨后进行无菌试验验证和新型鸭呼肠孤病毒检测,同时检测是否具有鸭瘟病毒、坦布苏病毒、副黏病毒、鸭肝炎病毒、细小病毒等混合感染。分离毒在鸡胚传代稳定后,将收取的病毒液接种于Vero细胞,观察该病毒对Vero细胞的适应性。
1.4.4 动物回归试验 为探究该病毒对雏鸭的致病性,将80只1日龄樱桃谷鸭平均分成2个组,攻毒组颈部皮下注射病毒液0.5 mL/只(105.0ELD50/0.1 mL),对照组颈部皮下注射同等剂量无菌PBS溶液,每天观察鸭只精神状态和死亡情况。于攻毒前和攻毒后第10天分别进行称重,比较体重变化情况;同时于攻毒后第5、7天和第10天进行剖检,每次每组剖检10只,观察脏器变化情况;剩余鸭只继续饲养至8周,观察腿病发生情况。
2 结果
2.1 病原鉴定 通过PCR扩增得到1 300 bp的特异性条带(图1),与新型鸭呼肠孤病毒S1基因扩增片段大小相符。经测序和同源性分析,可知分离病毒株与新型鸭呼肠孤病毒代表毒株(TH11、091等代表毒株)同源性为94%~96%,与北京鸭呼肠孤病毒[4](KT861593)同源性为96.8%,与鹅呼肠孤病毒(Goose orthoreovirus,GRV)同源性为95%,与番鸭呼肠孤病毒(Muscovy duck reovirus,MDRV)同源性为49%~50%,与禽呼肠孤病毒(Avian orthoreovirus,ARV)同源性为44%~48%,利用MEGA软件建立进化树分析可知,分离病毒株与新型呼肠孤病毒和鹅源呼肠孤病毒亲缘关系较近,与MDRV、ARV处于不同分支(图2),因此确定该分离病毒株为新型鸭呼肠孤病毒,毒株命名为HZDRV。
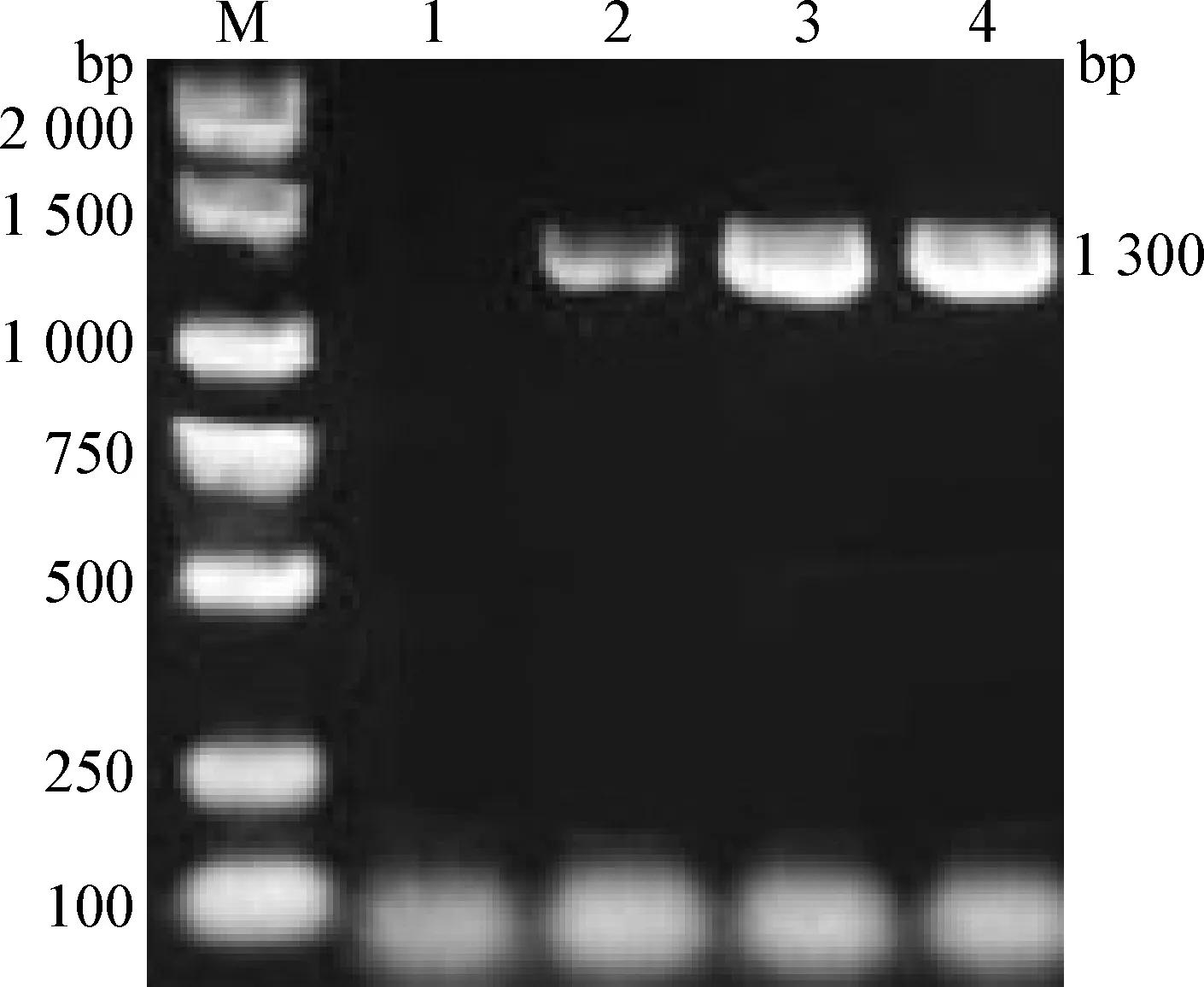
图1 S1基因的PCR扩增Fig.1 PCR amplification of S1 geneM:Marker; 1:阴性对照; 2:阳性对照; 3:肝脏; 4:脾脏M:Marker; 1:Negative control; 2:Positive control; 3:Liver; 4:Spleen

图2 不同毒株S1基因序列的同源性分析Fig.2 Homology analysis of S1 gene sequences from different strains▲:本试验分离株▲:The strain isolated in this experiment
2.2 病毒的分离培养 组织悬液接种7日龄SPF鸡胚后,可导致胚体在72~96 h内集中死亡,胚体呈现水肿、严重出血(图3)。收取尿囊液和胚体进行RT-PCR扩增,结果显示,新型鸭呼肠孤病毒扩增阳性,鸭瘟病毒、坦布苏病毒、副黏病毒、鸭肝炎病毒、细小病毒扩增阴性(图4),细菌检测阴性。病毒液接种Vero细胞后,细胞圆缩脱落,传至第5代时,观察到细胞拉网空泡化(图5),因此该病毒在鸡胚和Vero细胞上均可增殖。

图3 NDRV分离毒株感染鸡胚病变Fig.3 Lesion of chick embryo infected with NDRV isolate 1:正常胚体; 2~3:死胚胚体1:Normal embryo body; 2-3:Dead embryo body

图4 RT-PCR检测结果Fig.4 RT-PCR detection resultM:Marker; 1:阳性对照; 2:阴性对照; 3:新型鸭呼肠孤病毒;4:细小病毒; 5:鸭肝炎病毒; 6:副黏病毒;7:坦布苏病毒; 8:鸭瘟病毒M:Marker; 1:Positive control; 2:Negative control; 3:Novel duck reovirus; 4:Parvovirus; 5:Duck hepatitis virus; 6:Paramyxovirus; 7:Tambus virus; 8:Duck plague virus
2.3 动物回归试验 雏鸭致病性试验结果显示:1日龄雏鸭攻毒后第5天死亡1只,剖检可见脾脏坏死,但尚未形成炎性膜;攻毒后第7天未出现雏鸭死亡,但剖检时可见坏死灶和炎性膜。攻毒后第10天仍未出现雏鸭死亡,但剖检发现脾脏坏死比例为10/10,对照组为0/10。称重结果显示,攻毒组平均体重为390 g,对照组平均体重为538 g,攻毒组体重明显低于对照组,两组相差38%。观察至第8周,攻毒组有5只出现瘸腿,瘸腿比例5/10,跗关节无明显变化,剖检可见膝关节及附近的肌肉有大量干酪样物、部分鸭股骨头坏死,结果见图6;对照组无腿病发生。

图5 病毒在Vero细胞上增殖Fig.5 Virus multiplication in Vero cellsA:对照; B:24 h; C:40 h; D:48 hA:Control; B:24 h; C:40 h; D:48 h
3 讨论
本试验从发生脾脏坏死的病死鸭中分离出病毒株,并用RT-PCR扩增、测序分析确认为新型鸭呼肠孤病毒,随后将分离到的病毒株接种于1日龄樱桃谷雏鸭,通过剖检观察到脾脏坏死、变硬,还观察到肝脏有坏死灶,证明新型鸭呼肠孤病毒可导致雏鸭的脾脏和肝脏坏死。据刘伟等[2]报道,感染鸭还可观察到心肌出血、肾脏和法氏囊出血,但在本试验中未观察到相应症状,可能是不同分离毒株在致病机理方面有所差异。攻毒鸭观察至第8周,50%左右的鸭出现瘸腿症状,主要剖检症状为肌腱肌肉处有大量黏液或干酪样物,与养殖现场第6~8周出现的腿病症状吻合,通过实验室的分离鉴定,在肌腱中分离到NDRV。鸭发生瘸腿的因素有很多,如鸭呼肠孤病毒、葡萄球菌、鸭沙门菌、链球菌感染及外伤等。葡萄球菌感染多发生在中鸭和成鸭,引起跗关节和趾关节肿胀变形,剖检观察到关节腔内有白色或淡黄色脓性分泌物或干酪样物,肌腱也肿胀变形。笼舍的金属尖锐处或地面的突出粗糙会造成鸭的外部伤口,若饲养环境处理不当,会继而引发细菌感染,严重者会引起瘸腿。所以对于腿部疾病病例,需要临床和实验室诊断技术相结合的方式进行鉴别诊断。目前,我国尚未研发出新型鸭呼肠孤病毒疫苗,根据现场情况,疫苗研制更加迫切,特别是活疫苗的研制和开发[10-11],会给前期腿病防控带来新曙光。雏鸭脾脏坏死的防控可侧重母源抗体的保护,目前母源抗体或卵黄抗体对雏鸭的保护尚不明确,需要进一步研究。

