轻链、重链沉积病患者血液和尿液补体活化产物的研究
张 园 范 芸 梁丹丹 梁少姗 徐 峰 曾彩虹
引 言
单克隆免疫球蛋白沉积病(monoclonal immunoglobin deposition disease,MIDD)临床罕见,包括轻链沉积病(light chain deposition disease,LCDD)、重链沉积病(heavy chain deposition disease,HCDD)和轻重链沉积病(light and heavy chain deposition disease,LHCDD),其特征为异常单克隆免疫球蛋白沉积在肾小球和(或)肾小管内。研究发现[1-5],一部分LCDD(0~33%)、HCDD(尤其是γ1和γ3-HCDD,33%~68%)及LHCDD患者血清C3水平降低,并且伴有肾组织C3和IgG的线性沉积,提示患者体内存在补体途径激活,但目前尚无关于局部及循环补体系统在MIDD中临床意义的研究。
补体途径包括三种:经典途径(classical pathway,CP)、替代途径(alternative pathway,AP)和凝集素途径(lectin pathway,LP)。现有研究认为,LCDD的补体激活途径为AP[5],而HCDD为CP和AP[2,4,6-7]。因此本研究中分别检测了CP相关分子C1q、AP相关分子Bb、LP相关分子MBL,以及三种通路的共同产物C3a,C5a和sC5b9在血浆及尿液上清中的水平,以评估三种途径在LCDD和HCDD中的激活程度及它们与临床病理参数的相关性。LHCDD患者因不同比例单克隆轻链和重链同时沉积,患者数量少且个体差异大,未纳入本研究。
对象与方法
研究对象2011年1月至2018年12月在国家肾脏疾病临床医学中心行自体肾活检患者。共纳入LCDD患者42例,HCDD患者14例,标本库中随机抽取健康对照者10例。纳入患者的诊断标准参照文献[5,8]。
由东部战区总医院伦理委员会(2019NZKYKS-004-01)批准,并遵守赫尔辛基宣言。本研究为回顾性研究,受试者本人不需要为本实验接受任何有创性检查,免除签署患者知情同意。
方法本研究使用血浆代替血清,以避免血清中的凝血酶和纤溶酶等蛋白酶直接切割C3和C5引起C3a和C5a的混杂性升高[9]。
补体相关因子测定:采用商业酶联免疫吸附法(ELISA)试剂盒检测C1q、Bb、MBL、C3a、C5a和sC5b9在血浆及尿液上清中的水平。血浆C1q、尿上清Bb、C3a、C5a和sC5b9试剂盒购自美国Quidel公司,MBL试剂盒购自丹麦BioPorto Diagnostics公司,尿上清C1q试剂盒购自中国Uscn Life Science公司。所有步骤均严格按照说明书进行。
血清免疫固定电泳试剂盒(Beckman,USA),使用全自动电泳仪(Helena Laboratories,USA)检测。血清游离轻链检测试剂盒(Binding Site,UK),使用IMMAGE 800全自动特定蛋白分析仪(Beckman,USA)检测。
肾脏组织病理学冰冻组织免疫荧光直接法观察C1q、Bb、MBL、C3a、C5a和sC5b9(Abcam,UK)在肾组织的沉积部位、强度和分布特点。肾小球系膜区面积比例:对LCDD组及HCDD组的PAS染色组织切片观察至少5个完整肾小球,排除新月体、节段性及球性硬化的肾小球,摄取40×10放大倍数下的肾小球照片,在Image pro plus 6.0图像分析软件中分别勾画各个系膜区面积及球袢面积,求此两者比例。并取5个肾小球平均值(图1)。
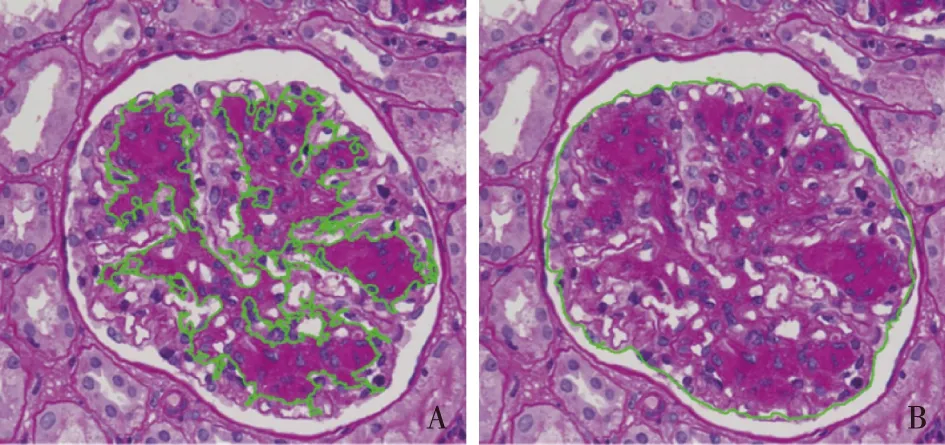
图1 重链沉积病的肾小球结节面积比例计算示意图(Image pro plus 6.0软件工作画面截图)A:绿线勾画每个结节区面积(PAS,×400);B:绿线勾画出球袢面积(PAS,×400);用结节区总面枳除以肾小球总面枳得到结节面积比例
统计学分析所有数据均使用《SPSS 25.0》(SPSS Inc. Chicago,IL)进行分析。正态分布数据采用方差分析(ANOVA)和独立样本t检验比较数据间差异;非正态分布资料的组间比较采用Kruskal Wallis H检验、Mann-Whitney U检验。数据以中位值(范围)或比值或(mean± SD)或百分比(%)表示,P<0.05为差异有统计学意义。
结 果
一般资料3组一般临床资料见表1。LCDD组血白蛋白水平39.3±6.4 g/L明显高于HCDD组30.0±6.2 g/L(P<0.05); HCDD组血C3水平低于LCDD组[0.67(0.30,1.00)g/Lvs0.82(0.52,1.67)g/L(P<0.05)],并表现为低C3血症比例更高。LCDD组和HCDD组相比,性别分布、年龄、24h尿蛋白定量及血红蛋白均无统计学差异(P>0.05)。
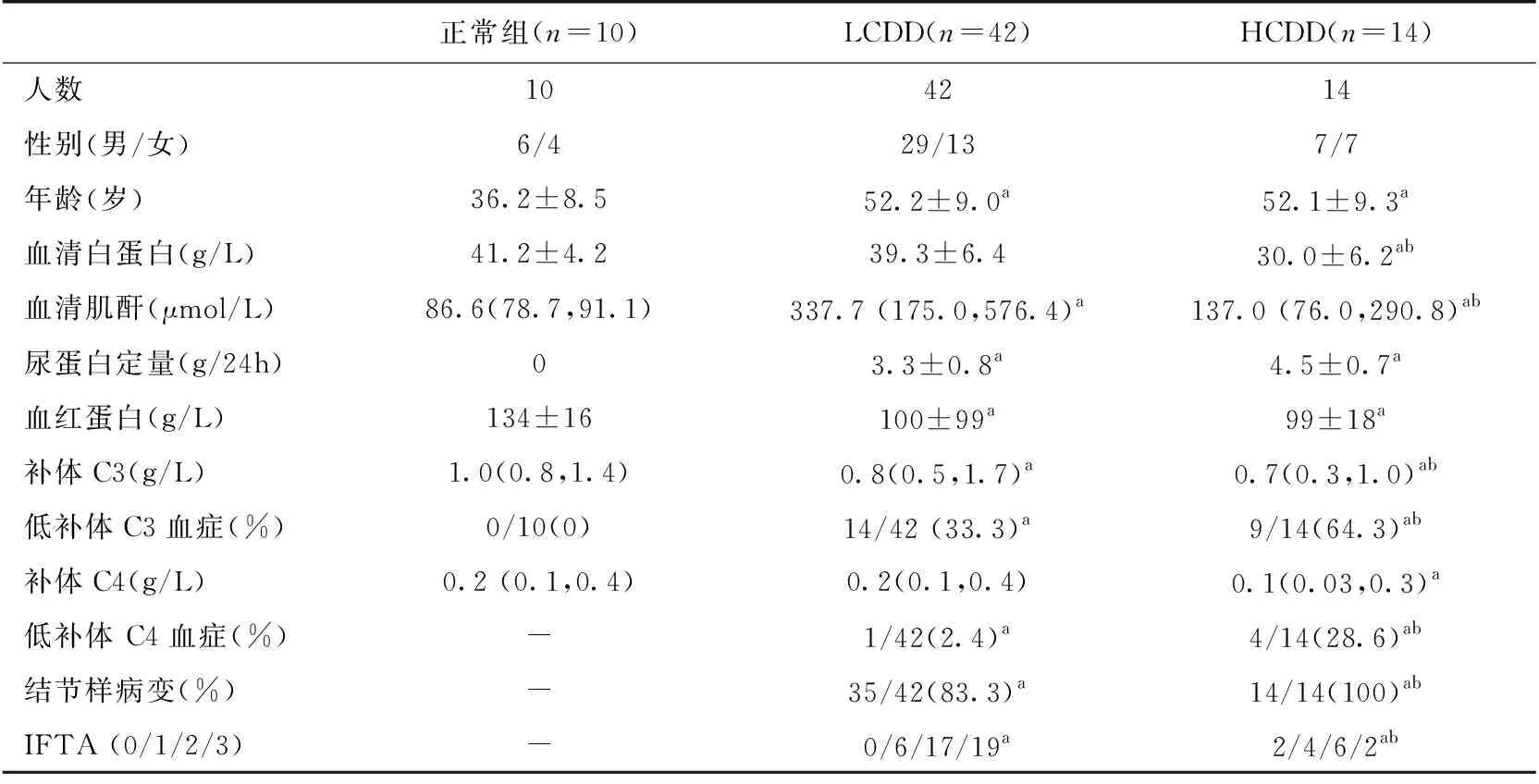
表1 正常组、LCDD组和HCDD组的临床资料
血浆补体因子水平HCDD组的C1q水平明显低于正常组[21.34(0.26,44.00)μg/mlvs62.45(3.45,489.67)μg/ml(P<0.05)], 及LCDD组[21.34(0.26,44.00)μg/mlvs63.06(6.32,566.66)μg/ml(P<0.05)](图2)。

图2 正常组及LCDD组和HCDD组患者的血浆补体成分水平LCDD:轻链沉积病;HCDD:重链沉积病
尿液上清补体因子水平我们将尿液上清补体成分用尿肌酐标准化以校正稀释的影响[10]。HCDD组C1q、Bb、C3a、C5a和sC5b9水平较LCDD组明显升高(P<0.05)(图3)。

图3 正常组及LCDD组和HCDD组患者的尿液上清补体成分水平LCDD:轻链沉积病;HCDD:重链沉积病
补体因子与临床及病理参数的关系分析血浆及尿液上清补体因子水平与血清肌酐(SCr)、白蛋白、免疫球蛋白、血红蛋白、轻链κ和λ、24h尿蛋白定量、IFTA和结节面积比例等临床病理参数的相关性。在血浆补体因子中,C1q与HCDD的SCr水平呈负相关(r=-0.537,P=0.048),sC5b9与HCDD的24h尿蛋白定量呈正相关(r=0.688,P=0.007)。在尿液上清补体因子中,C1q、Bb、C3a、C5a以及sC5b9与HCDD的24小时尿蛋白定量呈正相关。尿C3a、C5a以及sC5b9与LCDD的24小时尿蛋白定量呈正相关(表2)。
定量比较两组系膜结节面积比例,HCDD组(n=14)患者系膜增生程度明显高于LCDD组(n=42)(63.2%±7.8%vs26.4%±6.4%,P<0.05),但是系膜面积比例与各补体及其他临床病理指标均不相关。
补体因子在肾组织的分布LCDD组肾小球补体免疫荧光呈弱阳性(±)。在HCDD 组,C1q、Bb、C3a、C5a及sC5b9主要分布于肾小球结节区、包曼囊壁及肾小管基底膜,C1q、Bb和sC5b9荧光强度较强(++)而C3a和C5a强度较弱(+),MBL的荧光染色为阴性(图4)。
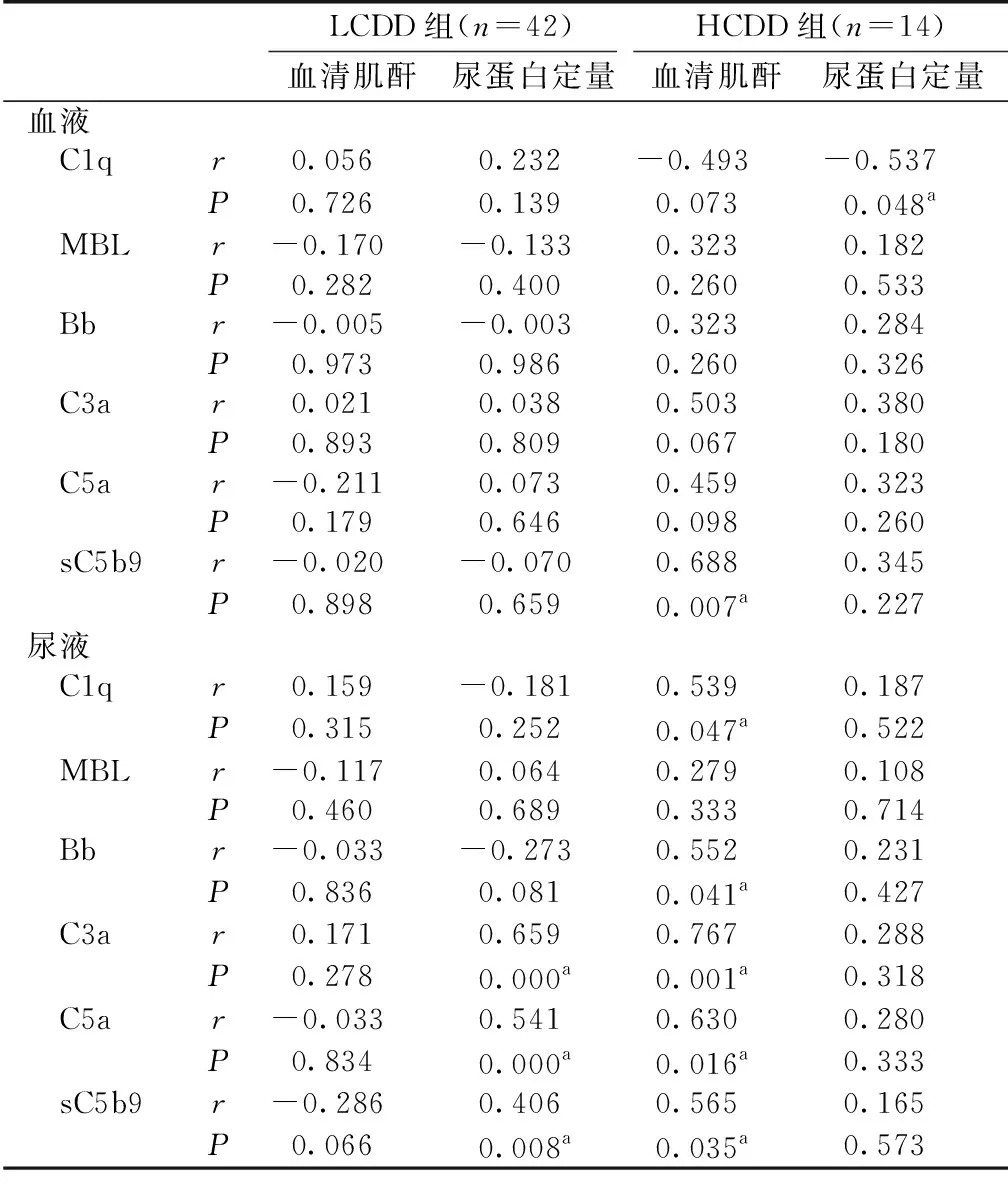
表2 补体因子与临床参数的相关性

图4 LCDD组与HCDD组患者肾组织补体因子免疫荧光染色结果(IF,×400)LCDD:轻链沉积病;HCDD:重链沉积病;A、B、C、G、H和I:LCDD组肾小球补体免疫荧光呈弱阳性;D、E、J、K和L:HCDD组肾小球及肾小管补体免疫荧光主要分布于肾小球结节区、包曼囊壁及肾小管基膜;F:HCDD组肾小球及肾小管MBL免疫荧光呈阴性
讨 论
本研究测定了三组血浆和尿液上清中的6种补体含量,表明在肾组织中,LCDD组存在补体AP及LP的激活,而HCDD组中补体三种途径均被激活;在循环中,LCDD组补体途径未被激活,而HCDD组中存在补体AP及CP的激活。结合补体因子与临床指标的相关性分析,说明LCDD及HCDD患者体内存在补体活化,且补体活化程度与SCr及蛋白尿严重程度相关。
HCDD患者肾组织可见C1q和C3的沉积,尿C1q增加;血补体C3下降,C1q降低,提示补体CP在肾脏局部及循环中均被激活,这与文献报道一致[1]。在循环中,HCDD患者血C1q水平比正常组明显下降,这与活动性狼疮患者相似,但后者是因为抗C1q抗体的存在而降低[11]。本研究中14例HCDD患者并未伴有明显肝脏疾病,排除了补体合成不足的原因,血C1q下降考虑补体CP被异常重链激活后大量C1q沉积在肾脏以及肾小球基膜受损后血C1q从尿液漏出所致。另外,由于抗C1q抗体也存在于健康受试者中[12],本研究并未测定患者抗C1q抗体滴度,亦不能完全排除患者抗C1q抗体的存在。本研究及既往LCDD患者[5]肾组织免疫荧光染色可偶见C1q和C3的沉积,C3下降。已知轻链不具有激活补体CP的能力。猜测可能通过间接机制抑制补体调节蛋白(如H因子等),导致补体AP的激活[5]。
HCDD患者血C1q水平与SCr呈负相关,而尿C1q水平与尿蛋白定量呈正相关。已知MIDD患者初始的肌酐水平与预后相关[5],蛋白尿是终末期肾病(ESRD)的重要预测因子。因此,血C1q和尿C1q水平的动态变化可能能够作为反应HCDD患者疾病状态的指标。有证据表明C1q结合能力不一定与补体活性水平相关,而且单独的C1q结合不足以实现补体激活[13]。因此,C1q的激活能力不仅仅因为IgG亚型的不同而有明确的差异,本研究因条件有限,尚不能针对个体的C1q激活能力在分子结构方面进一步研究。
Bb沉积于肾组织且尿Bb与尿蛋白定量呈正相关,提示补体AP在肾脏局部发挥了致病作用。补体AP在HCDD患者中可能通过以下机制发挥致病作用:第一,补体CP受到触发,继而嗜中性粒细胞的激活和产生[14]及血清备解素[15]将补体AP激活;第二,γ1包含C3的结合部分并激活补体AP[13];第三,非选择性蛋白尿可与其他血清蛋白一起穿过肾小球滤过屏障,并进一步通过肾小管上皮细胞激活补体AP[16]。因此,尿Bb水平可能可作为反映HCDD患者疾病状态的指标。
尿C3a和C5a可以通过与相应的受体结合并激活下游炎症信号通路,也可以未降解的形式引起持续的肾损伤[17-18]。肾小球补体激活的最终产物膜攻击复合物(membrane attack complex,MAC)即sC5b9的存在为补体激活的完整性提供了证据。尿sC5b9可直接攻击细胞表面或补体片段激活补体受体及其下游信号而对宿主组织产生有害作用[19]。因此,尿sC5b9可作为免疫损伤严重程度的指标。本研究中,LCDD和HCDD患者的24h尿蛋白定量无统计学差异,而尿补体成分水平差异有统计学意义,反映了HCDD患者肾脏局部总的补体激活程度较LCDD更为明显。同时,患者尿液中的C3酰胺化,导致补体激活级联反应[20]。综上所述,异常轻链/重链模拟了补体活化的调节因子的作用,导致了补体系统的活化。
除补体系统激活外,系膜细胞表型转变被认为是HCDD可能的分子机制[21]。在γ3-HCDD治疗过程中补体C3水平可恢复正常[4],因此血清补体水平可能作为某些HCDD患者疾病活动程度的标志。
本研究因缺乏患者骨髓血标本,尚不能对个体M蛋白的基因结构与补体活化的相关性进一步讨论,我们将在今后的研究中进一步完善。
本研究阐明了循环及局部补体激活在HCDD和LCDD患者中的临床意义,未来补体水平是否能对临床监测及建立个性化治疗提供帮助,有待多个中心收集病例进行更深入研究。

