急性肾损伤与体外器官功能支持的交互作用
董建华 综述 葛永纯 审校
肾脏是维持机体内稳态的重要器官,也是危重症患者最易受累的器官之一。急性肾损伤(AKI)通过远隔器官效应影响其他器官功能,在多器官功能障碍综合征(MODS)的发生和进展中发挥重要作用。器官功能支持是器官功能障碍治疗的关键技术手段,肾脏替代治疗(RRT)常规用于肾脏功能支持,组合式胆红素吸附应用于肝功能支持,体外膜肺氧合(ECMO)和体外二氧化碳清除(ECCO2R)应用于循环和肺功能支持,以此为基础的组合式多器官功能支持已用于MODS救治中。本文将以AKI和RRT为基础,对体外器官功能支持中原生器官间、原生器官与人工器官间的交互作用进行综述。
肾脏与其他器官的交互作用
AKI是由多种病因导致,且临床结局复杂的异质性疾病。危重症患者中AKI的发生率为57.3%,以AKI 3期(30.0%)和1期(18.4%)为主,AKI 2期(8.9%)较少,13.5%患者需要RRT[1]。MODS是器官损伤、炎症激活和远隔器官效应相互作用的结果,常表现为多个器官相继或同时发生功能障碍,肾脏、肺、心脏和中枢神经系统等重要脏器功能障碍发生率相近[2-3]。脓毒症和急性呼吸窘迫综合征(ARDS)常影响远隔器官功能,进而发展为MODS,该过程与初始损伤器官无关。远隔器官之间的这种相互作用被称为器官交互,其中包含复杂的生物学信号传导以及不同器官间的信号反馈调节。器官交互作用在维持机体内环境稳态中起重要作用。因此,当一个器官或多个器官的病理状态达到一定严重程度时,就可能会导致其他器官功能障碍。病理性器官交互作用是导致器官间负性作用恶性循环的基础,可加速各器官功能障碍的进展。该过程的病理生理机制复杂,涉及细胞内和细胞外作用、生物化学传导及氧化应激反应等[4]。
涉及肾脏的器官交互作用有心肾综合征、肺肾综合征、肝肾综合征、脑肾综合征和肠肾综合征等(图1)。脓毒症引起的AKI和MODS是器官交互作用的典型表现。病原体相关分子模式和损伤相关分子模式是参与脓毒症导致肾小管上皮细胞损伤的重要分子机制。脓毒症时,部分炎症因子可被肾小球滤过进入包囊和肾小管,其中脂多糖通过TLR-4Y受体作用于肾小管上皮细胞。管周毛细血管血流缓慢,有利于激活的白细胞迁移和释放炎症因子,亦可氧化应激损伤肾小管上皮细胞刷状缘[5]。47.5%脓毒症患者合并AKI,而早期改善心、肺和肾脏功能有利于改善脓毒症患者预后[6]。
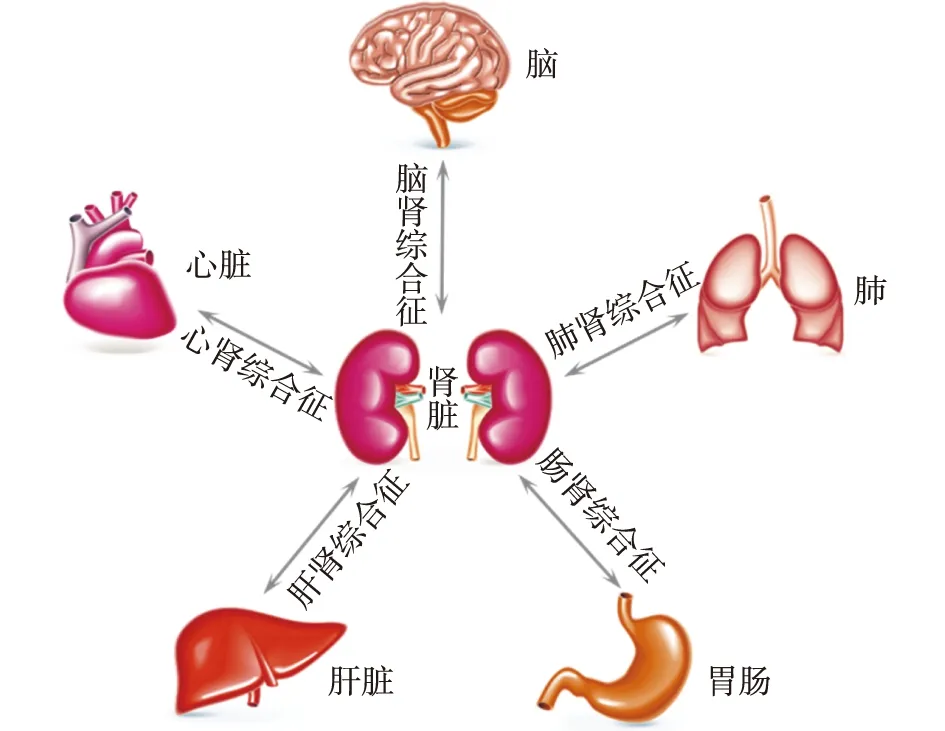
图1 涉及肾脏的器官交互作用
AKI可导致其他器官功能损伤,也可以是其他器官功能障碍的继发结果。无论肾脏是首发损伤器官,还是作为远隔器官受累,AKI均是重症患者死亡的独立危险因素。器官损伤的严重程度与重症患者死亡独立相关,AKI需要RRT时,死亡率高达50%[7]。理论上,通过早期识别AKI潜在风险,预防AKI发生,阻断AKI进展,或可同时改善其他器官功能,甚至影响疾病最终结局。
体外器官功能支持与肾脏的器官交互作用
2017年,Ranieri等[8]首次提出体外器官功能支持治疗(ECOS)的概念,即通过引出体内血液,建立体外血液循环,经特定装置和技术处理,实现器官功能支持治疗。ECOS区别于传统的机械通气和单一心脏支持(如心室辅助装置和人工心脏),更强调通过体外血液循环实现多器官功能支持,更准确地反映危重疾病的多系统受累的实质。
RRT是最早发展起来的ECOS模式,已常规用于肾脏支持治疗30余年, 其优势包括:稳定的血流动力学,连续精确的调控容量、酸碱和电解质,连续清除循环中氮质代谢产物和炎症介质等。因此,该技术已推广至危重症救治领域,其概念也逐渐被连续性血液净化(CBP)所替代[9]。随着技术和材料的发展,ECOS已有长足进步,静脉-静脉体外膜肺氧合(VV-ECMO)和ECCO2R用于肺功能支持,静脉-动脉体外膜肺氧合(VA-ECMO)用于循环和气体交换支持,分子吸附再循环系统(MARS)、连续性血浆滤过吸附系统(CPFA)、组合式连续性静脉-静脉血液滤过(CVVH)-胆红素吸附系统用于肝功能支持,CBP概念也逐渐发展成为ECOS,成为MODS危重症患者的核心救治技术。(图2)此外,其他血液净化治疗模式同样具有器官功能支持的作用,这些模式包括血浆置换和血液灌流等。尽管如此,ECOS与肾脏的交互作用却知之甚少。

图2 体外器官功能支持治疗示意图RRT:肾脏替代治疗;ECMO:体外膜肺氧合;VV-ECMO:静脉-静脉体外膜肺氧合;VA-ECMO:静脉-动脉体外膜肺氧合;ECCO2R:体外二氧化碳清除;CVVH:连续性静脉-静脉血液滤过;CVVHD:连续性静脉-静脉血液透析;CVVHDF:连续性静脉-静脉血液透析滤过
ECMO治疗期间AKI发生率高达74%,其中60%AKI患者需要RRT,而3个月生存率仅17%,且RRT治疗时间越长,死亡风险越高[10]。无泵体外肺辅助(iLA)治疗期间AKI发生率为71%,其中34.4%AKI患者需要RRT,28d生存率仅19%[11]。ECMO和iLA治疗期间AKI高发病率,是多种因素综合作用的结果。长时间低氧血症、高碳酸血症,血流动力学不稳定,器官低灌注、缺血再灌注损伤、血管活性药物、肾毒性药物等均是发生AKI的相关因素。体外呼吸功能支持可迅速纠正低氧血症和CO2碳潴留,循环功能支持可改善各器官血流灌注,有利于肾脏功能恢复,然而,若患者存在糖尿病、高血压病、慢性肾脏病、肾血管疾病等基础疾病,肾功能可能无法逆转。
ECOS虽可早期改善肾功能,但长期治疗后肾功能仍会逐渐下降。脓毒症、溶血、非搏动性血流均是体外器官功能支持过程中发生AKI的风险因素。VA-ECMO患者发生医院获得性感染的比例高达64%,以呼吸机相关肺炎(55%)、血流感染(18%)和导管感染(10%)为主。ECMO患者脓毒症的发生风险随着ICU住院时间延长而增加,并与导管数量、宿主免疫功能下降有关,而脓毒症增加AKI发生风险[12]。体外器官功能支持治疗过程中,血液通过离心泵或滚动泵负压抽吸,暴露于空气-液体界面,与非内皮细胞管路表面接触,易致溶血。心肺转流术后,血清游离血红蛋白增加、一氧化氮生物利用度降低,可能是急性肾小管损伤的机制,表现为尿NAG明显升高,而血清游离血红蛋白与尿NAG呈正相关[13]。VA-ECMO和左心室辅助装置(LVAD)为非搏动性连续血流,内皮细胞功能完整性发生改变,进而加速内皮细胞水肿,激活肾素-血管紧张素-醛固酮系统(RAAS),引起全身血管收缩,肾脏灌注减少,导致肾功能下降,病理表现为肾脏小叶间动脉血管壁增厚和间质炎性细胞浸润[14]。
RRT与多器官功能支持
RRT是临床最常用的器官功能支持疗法,也是严重AKI的唯一有效支持治疗模式。10%~15% ICU患者需要RRT治疗,但RRT的确切治疗时机和治疗剂量,目前尚存在争议,仍缺乏实践标准。RRT除常规应用于尿毒症、酸碱失衡、电解质紊乱等治疗外,还可用于炎症介质清除、高碳酸血症(联合ECCO2R)和高胆红素血症(联合胆红素吸附)。
脓毒症是免疫炎症反应动态失衡所致,在病原微生物感染机体后引起细胞因子的级联反应,体液中迅速产生大量的细胞因子。ECMO治疗期间亦可出现炎症风暴,血清肿瘤坏死因子α(TNF-α)和白细胞介素(IL)8在ECMO治疗2h内迅速升高,且明显高于肺和肠组织表达,其主要来源于肥大细胞脱颗粒,细胞内存储的细胞因子释放;而血清IL-6和IL-1β分别在ECMO治疗4h和6h后升高,其主要原因为血膜反应[15]。高水平IL-10是ARDS+VV-ECMO和心源性休克+VA-ECMO患者死亡风险的预测指标。理论上,多种CBP技术(高容量血液滤过、血浆吸附、血液灌流、高截留量透析等)对脓毒症、ARDS患者均有治疗获益,无论其是否同时联合ECMO,是否合并AKI。
血液净化能够清除炎症介质和细胞因子,降低单核巨噬细胞活性,并促使循环中促凋亡因子失活。Oxiris®细胞因子吸附器因其具有磺化聚丙烯腈层和聚乙烯亚胺层,既可吸附内毒素、清除炎症因子,又可支持肾功能,2017年欧洲批准其用于脓毒症AKI患者救治。一项法国的前瞻性研究[16],观察了Oxiris®治疗脓毒症休克患者的临床疗效,结果显示Oxiris®治疗组去甲肾上腺素用量减少,平均动脉压升高,血乳酸水平下降,预计住院死亡率下降。多粘菌素B固定化编织纤维柱(PMX)可吸附内毒素,临床用于治疗脓毒症休克。一项多中心、随机对照试验中应用PMX治疗内毒素≥0.6 EU/ml的脓毒症休克患者,28d死亡率与对照组无差异[17]。然而,事后分析显示将内毒素负荷限定在一定范围内(0.6~0.9 EU/ml),PMX可以带来临床获益,平均动脉压升高,缩短呼吸机天数,28d和90d死亡率明显降低[18]。在炎症风暴期间,血液净化技术清除大量细胞因子,消除抗炎细胞因子和抑炎细胞因子的峰值,以减轻组织器官损伤,有助于机体重建免疫稳态,为原发病治疗争取时间。然而,血液净化治疗过程中微量元素丢失,抗生素和儿茶酚胺等药物清除增加,可能会抵消RRT治疗临床获益。因此,细胞因子清除仍面临一系列问题需要解决。患者的选择标准和血液净化治疗的介入时机、治疗持续时间仍存在争议,常规使用可否临床获益,以及使用何种细胞因子作为疗效评价的生物学标志物,目前临床证据仍不足,需进一步研究明确。
肺保护性通气策略用于ARDS治疗,可避免机械通气导致的肺损伤和对循环功能的抑制,但会引起CO2潴留。ECCO2R是继ECMO后的又一款体外呼吸支持技术,它通过弥散作用清除CO2,低血流量即可排除大量CO2,可降低氧浓度和呼吸道压力,避免氧中毒和气压伤。ECCO2R联合RRT用于治疗ARDS合并AKI患者,血流量在370~450 ml/min,潮气量从6 ml/kg降至4 ml/kg后,分钟通气量和平台压下降,膜氧合器CO2清除可达83±20 ml/min,72h后吸入氧浓度下调,而氧合指数保持不变,在维持正常RRT治疗的同时强化了肺保护性通气[19]。另一项研究发现ECCO2R联合RRT较单纯RRT治疗需要机械通气的ARDS合并AKI患者,可显著降低血清IL-6的水平[20]。ECCO2R联合RRT治疗是否能改善ARDS合并AKI患者的预后,仍需进一步前瞻性研究证实。
目前临床多采用CPFA和组合式CVVH-胆红素吸附系统作为肝肾功能联合支持治疗技术。两种治疗模式均引入了血液滤过和血浆吸附技术,提高了蛋白结合毒素(胆红素)以及炎症介质、细胞因子的清除效率,同时加强了水溶性毒素的清除。不同于CPFA模式,东部战区总医院国家肾脏疾病临床医学研究中心建立的组合式CVVH-胆红素吸附系统采用血浆成分分离器分离血浆,血浆先血滤器实现水溶性毒素清除,再通过吸附柱实现中大分子和蛋白结合毒素的清除,避免了其他蛋白和非蛋白成分与吸附柱接触,降低吸附柱饱和速度;CVVH组合在血浆回路可减少体外血液循环量,减少凝血发生风险;血细胞仅与血浆成分分离器接触,避免了细胞活化和补体活化的风险(图2)。组合式CVVH-胆红素吸附系统对胆红素的清除率达28.7±13.1 ml/min,治疗8h后仍保持在9.3±4.1 ml/min水平,单次治疗蛋白结合毒素下降率>50%,而且多次治疗无明显衰减现象,总体清除率方面均优于MARS、Prometheus等传统肝功能支持系统[21]。
ECMO与RRT的器官交互作用
50%~65%的ECMO患者治疗期间需要RRT,原因包括降低容量超负荷(43%)、预防容量超负荷(16%)、AKI(35%)和电解质紊乱(4%),主要治疗模式为CVVH和缓慢连续性超滤[22]。一项回顾性研究[23]入组200例接受ECMO治疗的ICU患者,其中120例患者因AKI需要RRT,结果显示ECMO联合RRT者3月生存率明显低于非RRT患者(17%vs31%)。而另一项回顾性研究[24]入组135例接受ECMO治疗的患者,分为非AKI组、AKI不需行RRT组和AKI需要RRT组,在校正混杂因素后,发现接受RRT与患者死亡无关。ECMO联合RRT对患者预后的影响,亦需要前瞻性研究进一步明确。
RRT与ECMO的交互作用还体现在管路连接方式、血流动力学、抗凝、容量负荷及药物代谢动力学等。RRT与ECMO连接方式主要有三种方式:独立于ECMO回路的RRT血管通路,RRT机器与ECMO连接,血滤器连接于ECMO血流通路[25](图3)。RRT与ECMO独立运行的优点是ECMO和RRT间血流动力学影响小,缺点是需要额外留置深静脉双腔导管,需要更大剂量的抗凝剂。滤器连接于ECMO血流通路时超滤量监测误差大,且滤器凝血不易察觉,临床已很少应用。RRT机器与ECMO连接应用更为广泛,RRT最安全的位置是连接在氧合器前后,氧合器可以作为气泡捕捉器,最大限度降低肺部气体栓塞风险。但氧合器与泵间最高压力为150~350 mmHg,可能会影响RRT回路功能,导致频繁压力报警。目前临床多采用RRT流出管路连接至替代静脉通路,延长血液流出管路降低压力,或部分夹闭透析液流出管路维持血液与透析液压力平衡,但均不能切实解决压力报警问题。
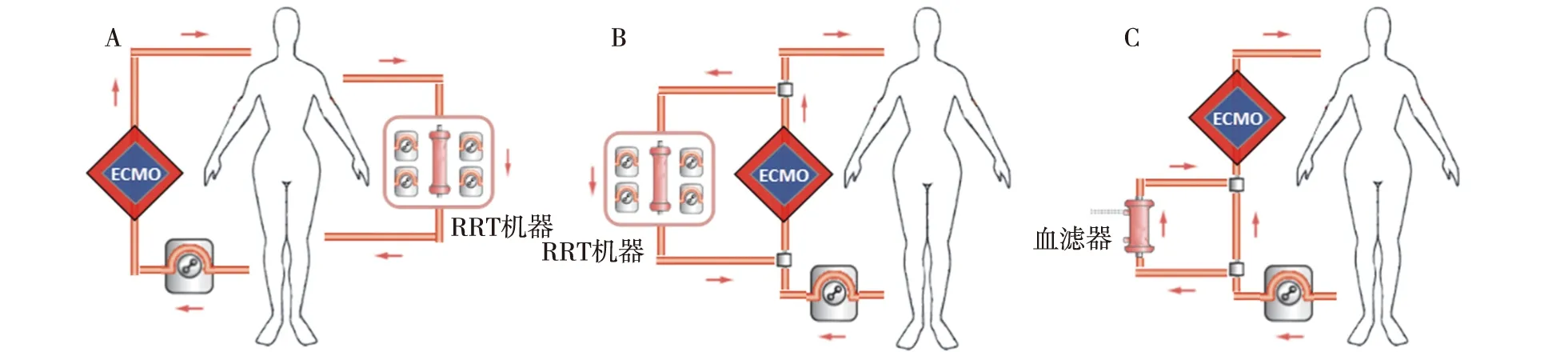
图3 肾脏替代治疗(RRT)与体外膜肺氧合(ECMO)连接模式示意图A:RRT机器与ECMO独立运行;B:RRT机器与ECMO连接;C:血滤器连接于ECMO血流通路
ECMO治疗期间需要全身抗凝,通常不需要再对RRT回路进行额外抗凝。ECMO管路均应用肝素涂层技术,严重出血情况下可暂停全身抗凝。但是RRT滤器和管路易形成血栓,血栓脱落促进氧合器堵塞,导致肺栓塞或动脉栓塞。RRT局部抗凝剂可选用枸橼酸,延长滤器使用时间,减少出血事件[26]。
ECMO治疗期间需要高血流量(4~5 L/min),以避免导管贴壁,易发生容量超负荷,液体超负荷会导致ECMO治疗时间延长。严重ARDS患者在治疗早期实现容量负平衡,可有效改善临床预后[27]。RRT可有效控制容量负荷,改善心肺功能和临床预后,而单纯超滤在解决容量负荷的同时,可避免营养物质丢失和药物清除,能否替代RRT作为首选治疗方式,仍需后续探讨。
小结:以RRT为基础的多器官功能支持治疗,可清除细胞因子、炎症介质和毒素,减轻组织器官损伤,有助于机体重建免疫稳态,为原发病治疗和器官功能恢复争取了时间。临床应重视器官功能支持治疗过程中原生器官与人工器官,及人工器官间的交互作用,目前仍有很多问题亟待研究解决。随着生物医学和机械工程学的发展,我们期待多器官功能支持集成平台应用于危重症患者救治。

