促红细胞生成素治疗新生儿缺氧缺血性脑病研究进展
李 娟
(天津市武清区人民医院儿科,天津 301700)
围产期窒息、脑室内出血和中风是常见的新生儿脑损伤的原因,以缺氧缺血为最常见的损伤途径。新生儿缺氧缺血性脑病(hypoxic-ischemic encephalopathy,HIE)是临床常见、多发的新生儿科疾病之一,也是导致新生儿致残及致死的主要原因。促红细胞生成素(erythropoietin,EPO)具有减轻缺氧缺血对神经系统损伤的作用。本文对EPO作为围产期脑损伤潜在治疗方法进行文献复习并做一总结。回顾了EPO治疗新生儿缺氧缺血性脑病(HIE)的相关临床试验,对大剂量促红细胞生成素的潜在风险和益处进行了探讨和分析。同时也对EPO的表达、信号转导途径及神经保护机制进行了总结。根据大量研究结果,笔者认为使用大剂量EPO作为一种新生儿缺氧缺血性脑病治疗方法安全,且疗效较为确切,EPO对缺氧缺血新生儿脑神经具有保护作用。
新生儿缺氧缺血性脑病(hypoxic-ischemic encephalopathy,HIE)是临床常见、多发的新生儿科疾病之一,也是导致新生儿致残及致死的主要原因[1]。近年来随着新生儿医学的进步显著改善了患儿的预后,尤其是对极早产婴儿。然而在改善脑损伤新生儿的神经发育结局方面,尚未取得长足进展。低温治疗对足月新生儿轻、中度脑损伤有一定的疗效,但在缺氧缺血严重或持续的情况下无疗效。同时,低温也被禁止用于早产儿,当缺氧缺血发生时,低温并不能改善此类患儿的预后。为了减少新生儿脑损伤,需要一种神经保护药物,此类药物能够保护患儿神经系统,同时不影响患儿的远期发育。动物研究认为,促红细胞生成素(EPO)作为治疗各种脑损伤相关疾病是有效且安全的。近年来的相关研究报道也认为,促红细胞生成素(EPO)可明显改善新生儿缺氧缺血性脑病患儿的预后,提高患儿神经功能。
1 新生儿缺氧缺血性脑病病理生理机制
新生儿缺氧缺血性脑病是一种脑损伤疾病,主要发病原因为围生期缺氧、窒息导致患儿脑血流减少[2]。新生儿缺氧缺血性脑病的主要发生可能与以下因素有关[3]:①新生儿脑室周围组织缺乏血脑屏障,胎儿发生宫内感染后致病菌产生内毒素、细胞因子等可进入脑组织并促使小胶质细胞产生相应的炎性细胞因子,如白介素-6、肿瘤坏死因子-α、白细胞介素-1等,上述物质能够直接作用于大脑内皮组织并造成相应损伤;②早产儿具有并未发育成熟的脑血管,脑室管膜存在解剖缺陷,为致病菌及内毒素等入侵创造有利条件;③机体发生缺氧缺血后组织性纤维蛋白酶活化物将增强蛋白酶活性从而产生蛋白水解产物,后者将结合小胶质细胞表面受体并产生炎性因子;④脑白质损伤时机体将表现出全身炎性反应综合征,由于新生儿具有并未发育成熟的血脑屏障,炎性细胞因子将通过其进入脑组织并对脑血管系统产生相应影响。
新生儿缺氧缺血性脑病的危险因素包括早产、缺氧、宫内感染、高体温等。据相关资料统计[4],新生儿缺氧缺血性脑病患儿后遗症发生率高达14%左右,因此提示一旦发生新生儿缺氧缺血性脑病且未及时治疗者将对其今后生活质量造成严重影响,对家庭、社会也将造成相应负担。因此提示,临床明确新生儿缺氧缺血性脑病的有效治疗方法具有重要的研究价值。
2 EPO与新生儿缺氧缺血性脑病
2.1EPO治疗新生儿缺氧缺血性脑病相关临床研究:目前关于亚低温(32℃~34℃)治疗新生儿缺氧缺血性脑病的临床研究已发表[5-7],研究普遍认为低温可改善中度(但不严重)窒息婴儿的预后,将18~24个月时死亡和神经功能障碍的综合预后从约60%降至45%。联合治疗,如促红细胞生成素加低温正在考虑进一步改善患儿预后的可能。然而,彻底评估联合治疗的安全性是十分必要的。考虑缺氧缺血、低温和促红细胞生成素对凝血功能的联合作用也十分必要。缺氧缺血增加了弥散性血管内凝血的风险,同时体温过低会以剂量依赖的方式破坏止血,即使体温过低也会出现凝血障碍,这可能是由于纤维蛋白原可用性降低和凝血酶产生延迟。促红细胞生成素治疗也可能影响凝血功能,在成年人应用EOP后患者表现出心血管意外风险增加,导致血栓形成。尽管在新生儿中没有EPO引起的凝血并发症的报道,但随着临床研究的进行,保持警惕是很重要的。
2.2EPO治疗新生儿缺氧缺血性脑病可能机制:促红细胞生成素属于一种糖蛋白水溶性激素(含唾液酸),主要由人体肝脏、肾脏(成年人)合成获得,此外其也可经特殊诱导过程由脑部产生[8]。促红细胞生成素具有免疫调节、抗炎、细胞保护、抗凋亡、抑制兴奋性毒性等生理功能,既往在癫痫、脊髓损伤、帕金森病、多发性硬化症、脑外伤等人群中均已发挥相应作用。促红细胞生成素受体激活触发不同信号通路,包括磷酸肌醇激酶P13K、蛋白激酶B信号,二者均可诱发促红细胞生成素发挥神经保护作用。近年来有研究认为利用促红细胞生成素对神经保护作用可起到一定的新生儿缺氧缺血性脑病治疗效果,此外其还可通过刺激脑源性神经营养因子达到此病治疗目的[9]。
2.2.1神经保护:促红细胞生成素对神经保护的作用研究较多,具体机制包括[10-11]:①脑部缺血缺氧状态破坏血脑屏障,此举反而对促红细胞生成素进入脑局部提供有利条件;②促红细胞生成素进入脑部后可显著增强铁元素利用率,对降低自由铁、减少氧化损伤脑组织均具有重要价值;③通过稳定氧的有效利用改善自由铁及全身性炎性反应,从而达到直接保护神经目的;④针对大脑已经受损者,促红细胞生成素能够促进脑组织及细胞恢复,增加带氧能力促进红细胞、血管及神经生成;⑤促红细胞生成素能够促进神经元再生,从而减少脑白质损伤情况、改善患儿认知功能;⑥通过活化ERK通路、JAK-2/STAT5通路、PI3K/Akt通路使下游细胞因子有效调节,抗凋亡基因Bcl-Xl表达随之增强,而caspase-3、caspase-9活性则有效下降,达到避免缺氧损伤神经元效果,见图1。
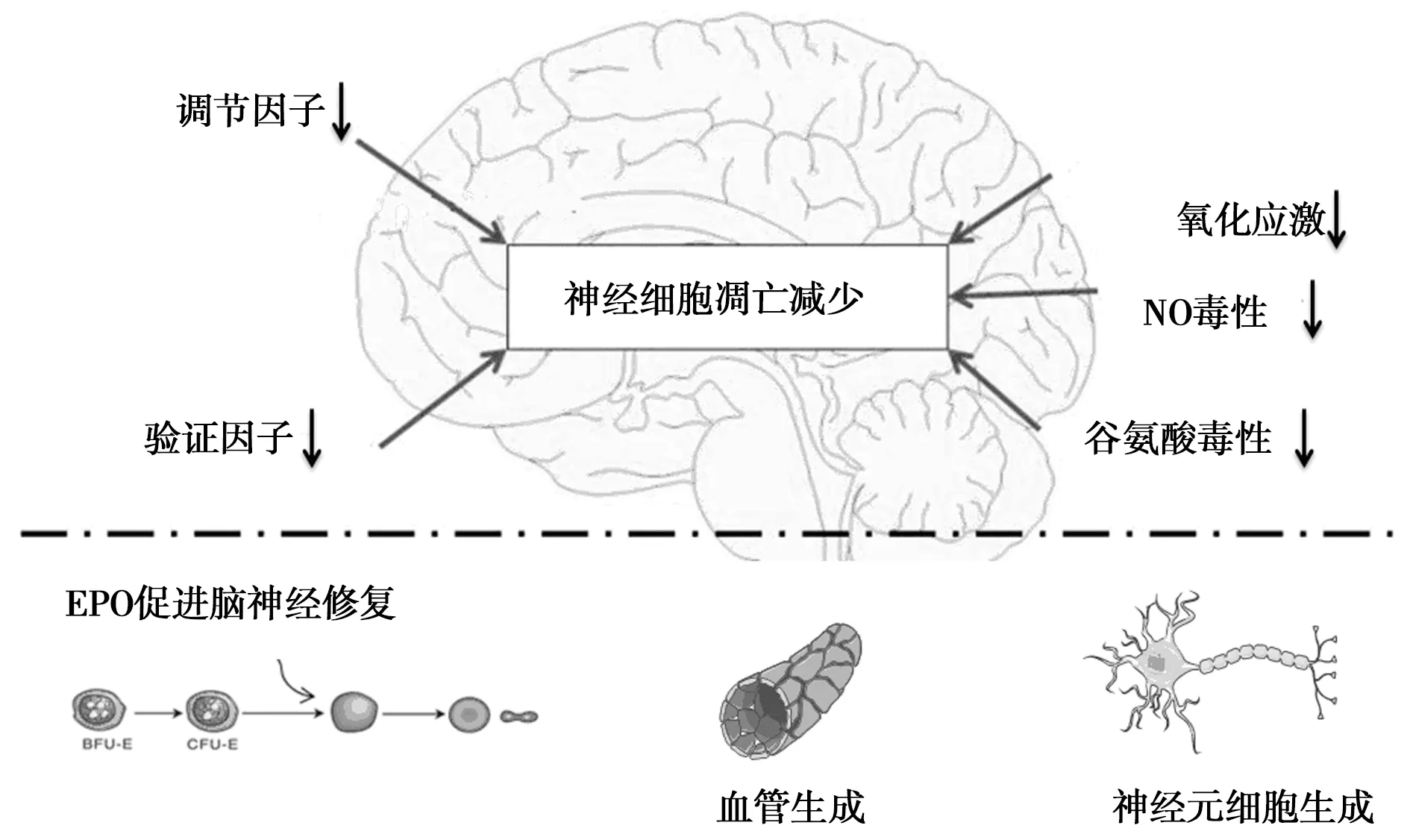
图1 EPO促进脑神经功能修复机制的模式图
2.2.2协同作用:现阶段有研究证实针对中度窒息婴幼儿应用亚低温可使其死亡率、神经功能紊乱率有效降低,而在亚低温治疗基础上加用促红细胞生成素则可达到显著的协同作用,取得更好的脑保护治疗目的,分析可能与二者联用产生的混合效应相关,如低温、血块凝集、缺氧缺血等[12]。但应注意亚低温、促红细胞生成素联用过程或可增加血栓发生风险。胰岛素样生成因子也具有神经保护、神经营养作用,其可通过对磷酸肌醇激酶有效激活,从而达到联合促红细胞生成素使用时的协同作用。目前有研究[13-14]认为,胰岛素样生成因子、促红细胞生成素联合使用时,前者可提高后者对神经保护效果,同时能够使其阈值下降,此外二者协同治疗能够延长有效期限,即损伤发生9 h后联用两种药物仍可具有显著作用。
2.2.3相关信号通路:EPO受体(EpoR)的激活可以触发不同的信号通路。传统的认识是EPO通过Janus激酶/Stat5激活和NF-κB磷酸化来阻止神经元凋亡[15]。然而,EPO的神经保护还涉及PI3K和蛋白激酶B(Akt)信号转导。Byts等人发现激活PI3K/Akt而不是Stat5对于Epo诱导的兴奋性毒性保护是必需的,而Stat5和Akt对于EPO的神经营养作用是必需的[16]。类似地,EPO通过PI3K/Akt依赖性机制防止神经细胞培养中的兴奋毒性。因而,由EpoR和共β链(βc)受体组成的脑特异性异二聚体作为介导EPO神经保护的特异性受体[17]。然而,新的数据削弱了这一假设,因为βc受体的表达与脑中EPO或EpoR的表达不一致。Sanchez等人[18],明确评估了Epo、EpoR和βc受体RNA在出生后和老年大鼠脑中的表达和受体免疫标记,并检测了神经元前体PC12细胞,他们的发现完善了EpoR的定位,确定了发育过程中的具体调控模式。据报道,EPO通过PI3K/Akt和细胞外信号调节激酶(ERK,a.k.a.MAPK)信号途径刺激血管内皮生长因子的分泌和血管生成。其他EPO效应现在被认为是通过EPO刺激脑源性神经营养因子(BDNF)介导的。
3 展望
促红细胞生成素在新生儿缺氧缺血性脑病的治疗价值已部分得到证实,但应注意的是其安全性仍不乐观。由于现阶段促红细胞生成素在成人患者中应用后有报道出现癫痫、凝血、高血压、红细胞增多症甚至死亡等异常情况,但在婴幼儿中并未出现相应报道。在早产儿中应用促红细胞生成素的历史悠久,但目前越来越多的研究证实其可能增加患儿视网膜病变发生几率,应引起相关医护人员注意[19-20]。提示在临床实际工作中,医务人员应准确掌握促红细胞生成素的适应证,接诊新生儿缺氧缺血性脑病患儿后严格按照相关要求制定用药方案,从而达到确保患儿临床用药有效性、安全性的最终目的。
综上所述,应用促红细胞生成素治疗新生儿缺氧缺血性脑病具有重要的临床价值,值得今后实际工作中参考使用。

