胃癌患者术后血清中TGFBI与复发转移的关系及其机制
肖萍,宋振宇,姚倩
胃癌是临床上常见的一种恶性肿瘤,具有病死率高和术后易复发与转移的特点[1]。目前,胃癌的临床治疗多以手术为主,也有利用替吉奥单药或与奥沙利铂联合等进行化疗的治疗方式,其中有效的预后与分析手段对防止其术后的复发转移至关重要[2]。研究表明,影响胃癌术后预后的影响因素较多,主要包括pTNM分期、肿瘤大小及围手术期化疗等,其复发与转移也涉及多种转录因子,如转化生长因子β诱导(TGFBI)、COL1A1和TAGLN2等,这些都为其预后及相关治疗增加了难度[3-4]。
TGFBI是一种由TGF-β1诱导合成的胞外基质蛋白,可参与细胞之间以及细胞与基质之间的黏附[5]。已有研究证明,在人肝癌、大肠癌细胞中上调TGFBI的表达能够显著提高癌细胞的浸润和转移能力[6-7]。上皮细胞间质转化(epithelial mesenchymal transition, EMT)是肿瘤细胞在进展过程中的典型特征,其主要标志是E-cadherin的下调或缺失[8]。研究表明,一些转录因子如Snail、Slug、Twist、ZEB1、ZEB2和E12/E47等均表现出对E-cadherin具有转录抑制的作用,进而使肿瘤细胞发生EMT转变[9-10]。目前,关于TGFBI在卵巢癌[11]、乳腺癌[12]及膀胱癌[13]等细胞进展过程中的功能作用已有较多的研究报道,而其与胃癌细胞术后复发转移之间的关系及作用机制尚不清晰。
本研究考察了TGFBI在胃癌细胞血清样本中的表达水平,并利用shRNA结合慢病毒技术稳定敲低技术对其表达进行下调,通过胃癌细胞增殖、侵袭与迁移能力的变化以及EMT相关转录因子表达水平的改变,探究TGFBI与胃癌细胞术后复发转移之间的关系及可能存在的作用机制。
1 材料与方法
1.1 材料
1.1.1 实验材料 胎牛血清(FBS)、RPMI 1640培养基购自Gibco公司;四甲基偶氮唑蓝(MTT)购自Sigma公司;Transwell小室购自美国Coming公司;胃癌细胞系SGC-7901购自上海中科院细胞库;一抗TGFBI、GAPDH和二抗购自Proteintech公司;一抗E-cadherin、Snail和ZEB1购自Cell Signaling Technology公司;人 TGFbI ELISA 试剂盒购自Biorbyt公司。
1.1.2 病例资料 将 2014年6月至2019年12月在四川省凉山彝族自治州第二人民医院进行手术切除后复发的胃癌患者血液标本86例。其中,男50例,女36例;患者年龄27~70岁,平均年龄(46.8±2.5)岁。根据酶联免疫反应检测血液中的TGFBI含量(ng/mL)值,并根据86例标本所测得的TGFBI含量值大小进行排序,将86例患者分为高TGFBI组(n=43)和低TGFBI组(n=43)。所有患者已知情同意,已经过医院伦理委员会批准。此外收集20例未观察到任何疾病的正常健康人(25~35岁)的血液标本作为对照。纳入标准:①诊断明确;②患者对本研究知情同意。排除标准: ①心、脑、肝、肾等脏器损害;②凝血障碍;③合并其他恶性肿瘤;④重度感染。
1.2 实验方法
1.2.1 细胞培养 胃癌SGC-7901细胞的常规培养使用含有10% FBS的RPMI 1640培养基,于37 ℃、5% CO2的孵育箱中孵育,每1~2天换液一次,3~4天用1%胰酶常规消化传代培养备用。
1.2.2 酶联免疫反应检测血液中的TGFBI 向反应孔中添加0.1 mL的抗体稀释液(用缓冲液稀释至1~10 μg/mL),并于4 ℃孵育过夜。次日,弃去孔内溶液,用洗涤缓冲液洗3次。向反应孔中加入0.05 mL稀释至合适浓度的待检样品,于37 ℃孵育1 h,然后洗涤(同时做空白孔,阴性对照孔及阳性对照孔)。各反应孔中,分别加入0.05 mL新鲜稀释的酶标抗体(经滴定后的稀释度),37 ℃孵育0.5~1.0 h,洗涤。向各反应孔中加入0.1 mL临时配制的TMB底物溶液,37℃反应10~30 min。于各反应孔中加入0.05 mL的2 mol/L硫酸,于450 nm(若以ABTS显色,则410 nm)处,以空白对照孔调零后测各孔OD值,若大于规定的阴性对照OD值的2.1倍,即为阳性。
1.2.3 稳定沉默TGFBI细胞系的构建 胃癌SGC-7901细胞中转染慢病毒载体pLV5-GFP-Luc,3 d后进行克隆筛选;稳定表达Luc的SGC-7901-Luc细胞用于细胞系的建立。使用慢病毒载体pLV3-TGFBI shRNA(表达TGFBI shRNA)转染SGC-7901-Luc细胞,5 d后利用2 μg/mL的嘌呤霉素筛选转染成功的SGC-7901-Luc-shTGFBI细胞;TGFBI干扰后在重组细胞系中的表达水平通过Western blot进行检测。本文所使用的shRNA序列: TGFB1 shRNA#1:GAUAAGGUCAUCUCCACCA,TGFB1 shRNA#2:CUUGAAGUCAGCUAUGUGU,NC:UUCUCC-GAACGUGUCACGU。
1.2.4 q-PCR 取对数生长期构建的胃癌SGC-7901细胞,消化接种至6孔板中,继续培养48 h后收集细胞。用TRIZOL法裂解并提取RNA反转录试剂盒反转录得到cDNA。使用实时荧光定量PCR检测试剂盒进行检测。引物序列(5′→3′):TGFBI (forward: AGGAATTTGCTTCGGAACCAC; reverse: GCT-GTTCTCAATGCAAAGGCTA), GAPDH (forward: CCCACTCC-TCCACCTTTGAC; reverse: TCTTCCTCTT-GTGCTCTTGC)。
1.2.5 Western blot检测 取对数生长期构建的胃癌SGC-7901细胞,消化接种至6孔板中,继续培养48 h后收集细胞。用三氯乙酸(TCA)法提取培养上清中的蛋白,以及用SDS提取细胞裂解物进行Western blot检测,GAPDH的表达作为对照。对于SGC-7901细胞的裂解,向每组细胞加入60 μL的RIPA裂解液,冰上放置30 min,130 00×g离心30 min收集上清液;样品通过BCA法进行定量检测,使每孔上样等量(40 μg左右)的目的蛋白,10%SDS PAGE电泳后,半干转于PVDF膜上;使用5%脱脂奶粉封闭2 h,一抗4 ℃ 孵育过夜,TBST洗膜3次,每次10 min,二抗室温孵育1 h,TBST洗膜,3次/10 min,ECL显色。
1.2.6 MTT法检测细胞增殖 取对数生长期的胃癌细胞SGC-7901,制备单细胞悬液,按每孔细胞密度为4×103个/mL,接种至96孔培养板中,边缘加入PBS缓冲液,设置空白调零组,进行MTT法检测。使用酶联酶标仪,选取490 nm波长处检测各孔的光吸收值(OD490值)。胃癌SGC-7901细胞存活率SR=(实验组平均OD490值/对照组平均OD490值)×100%,每组设置3个重复孔,每组实验重复3次。
1.2.7 细胞侵袭与迁移检测 胃癌SGC-7901细胞饥饿处理12 h后进行消化,使用无血清培养基进行重悬,调整细胞浓度为1×105/组,体积为200 μL,接种于上室,下室加入含有10%胎牛血清的完全培养基600 μL;实验分为4组,细胞迁移实验需在培养箱培养36 h后取出小室。细胞侵袭实验需将 Matrigel 胶用无血清1640培养基按1 ∶4稀释后,取50 μL加到 Transwell小室底部膜的上室中去,细胞培养箱中放置1 h后再加入2×105/组的细胞,在培养箱培养48 h后取出小室。用PBS清洗上室和下室3次,用甲醇固定细胞,结晶紫染色;倒置显微镜下采集数据。
1.3 统计学方法

2 结果
2.1 复发胃癌临床病理特征与TGFBI表达的关系
对比不同年龄、性别、分化程度、转移情况以及临床分期胃癌患者血液中的TGFBI表达情况,发现胃癌复发病人血液中TGFBI的表达水平与肿瘤低分化、转移以及临床分期正相关,且这种差异与患者的年龄和性别无明显的相关性(表1)。将收集的所有胃癌患者血液样本中的TGFBI含量进行ELISA定量分析,发现血液样本中TGFBI的平均表达水平显著高于正常人血液样本(图1)。该实验结果表明,胃癌细胞中TGFBI的表达可能与其术后的复发、转移以及临床分期存在一定的关系。
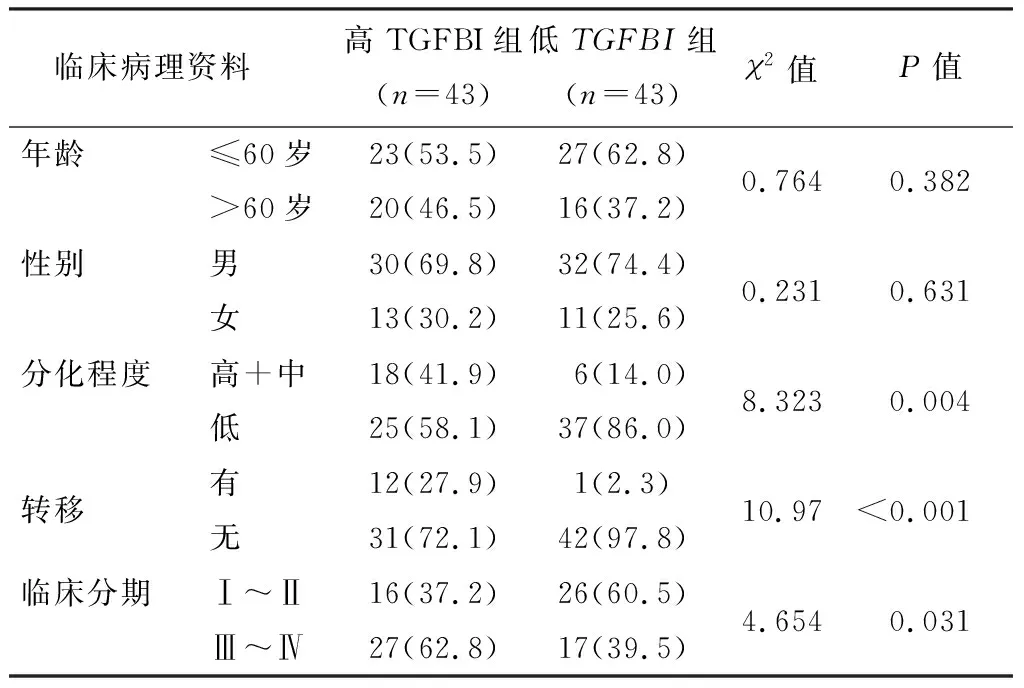
表1 复发胃癌临床病理特征与病人血液中TGFBI蛋白表达的相关性[n(%)]
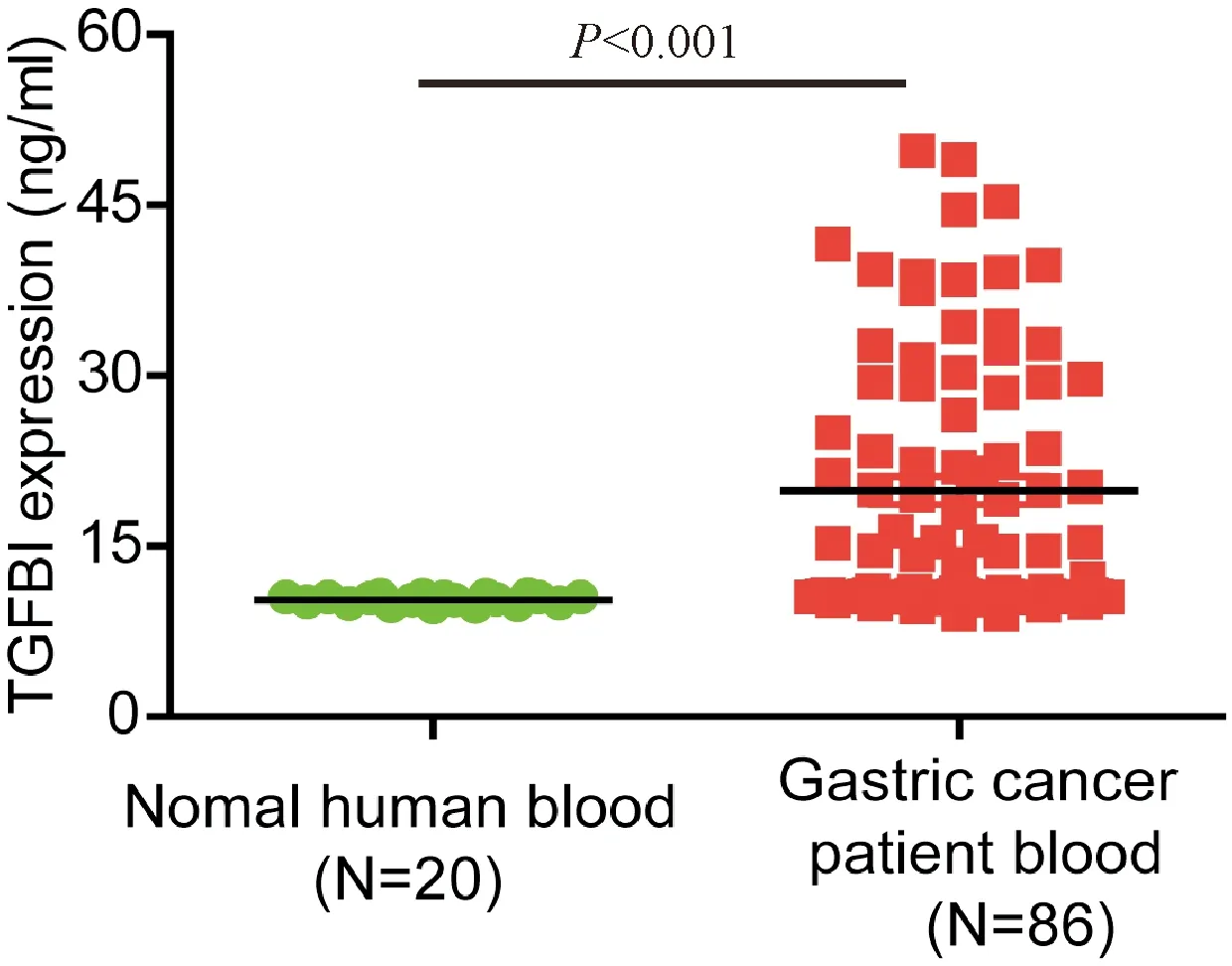
图1 ELISA检测血液样本中TGFBI的含量检测
2.2 利用shRNA结合慢病毒技术稳定敲低技术抑制TGFBI在SGC-7901细胞中的表达和分泌
为进一步研究胃癌术后复发的高进展性病理特征与TGFBI的关系,通过shRNA结合慢病毒技术稳定敲低技术下调胃癌SGC-7901细胞中TGFBI的表达,构建SGC-7901-shTGFBI稳定敲减细胞系(TGFBI sh#1和TGFBI sh#2)。通过q-PCR检测发现,两株SGC-7901-shTGFBI稳定干扰细胞系中TGFBI的转录水平较对照组均显著降低(图2A)。Western blot结果显示,与对照组相比SGC-7901-shTGFBI细胞以及上清中TGFBI的蛋白表达水平显著下降(图2B、C)。该实验表明,shRNA稳定敲减后SGC-7901细胞中TGFBI的表达和分泌均受到了显著抑制。
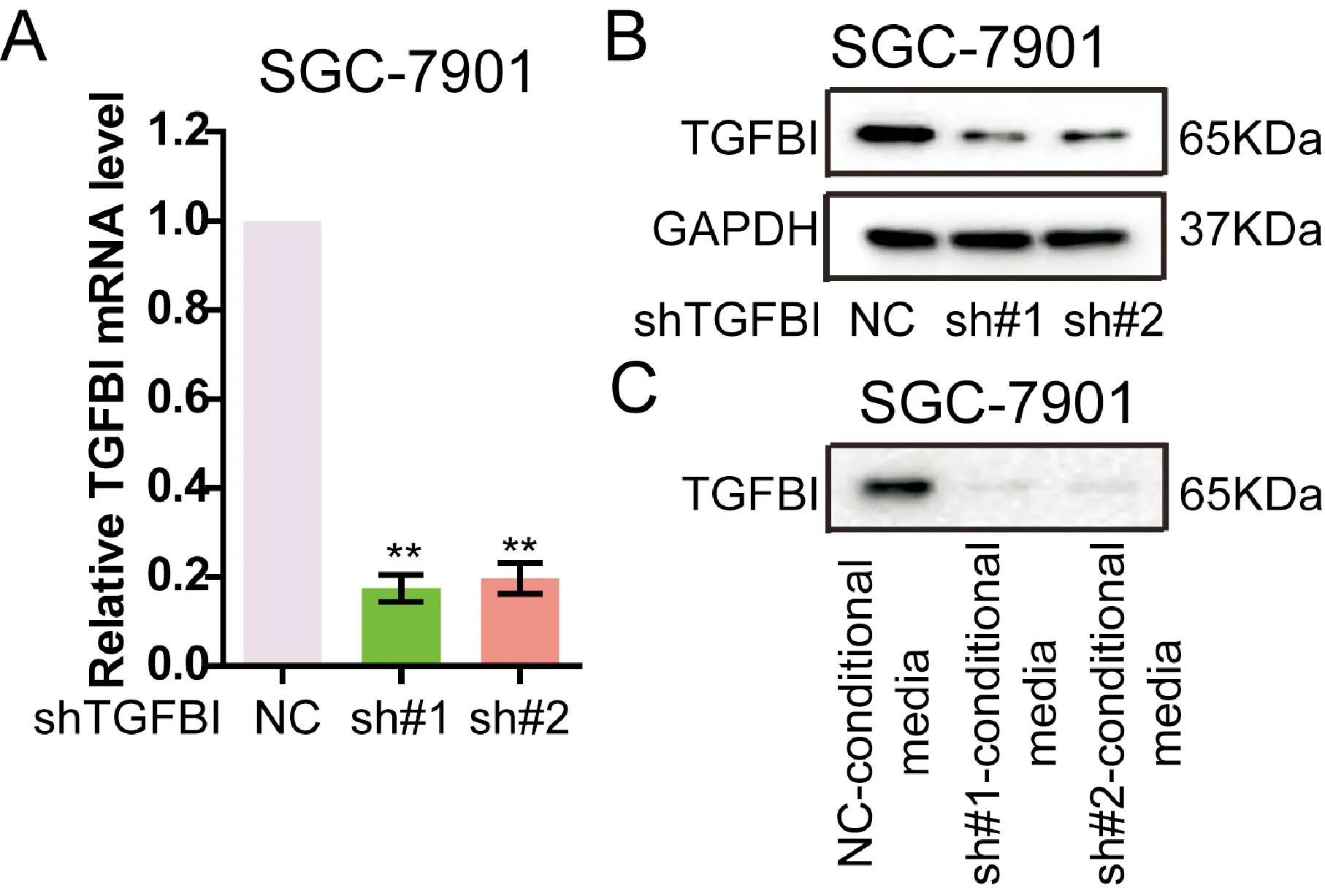
图2 TGFBI的表达水平检测 A:TGFBI转录水平检测(**与NC组比较,P<0.01);B:TGFBI在SGC-7901细胞中的表达水平检测;C:TGFBI在培养上清中的表达水平检测
2.3 TGFBI表达下调可抑制SGC-7901细胞的增殖
对比TGFBI稳定敲减细胞(TGFBI sh#1和TGFBI sh#2)与正常SGC-7901细胞的生长情况,发现在细胞培养过程中,SGC-7901-shTGFBI细胞的增殖速率较正常细胞显著降低;培养7 d后,SGC-7901-shTGFBI细胞的存活率较正常细胞下降了40%左右(图3)。该实验表明,下调SGC-7901细胞中TGFBI的表达,可显著抑制其增殖。
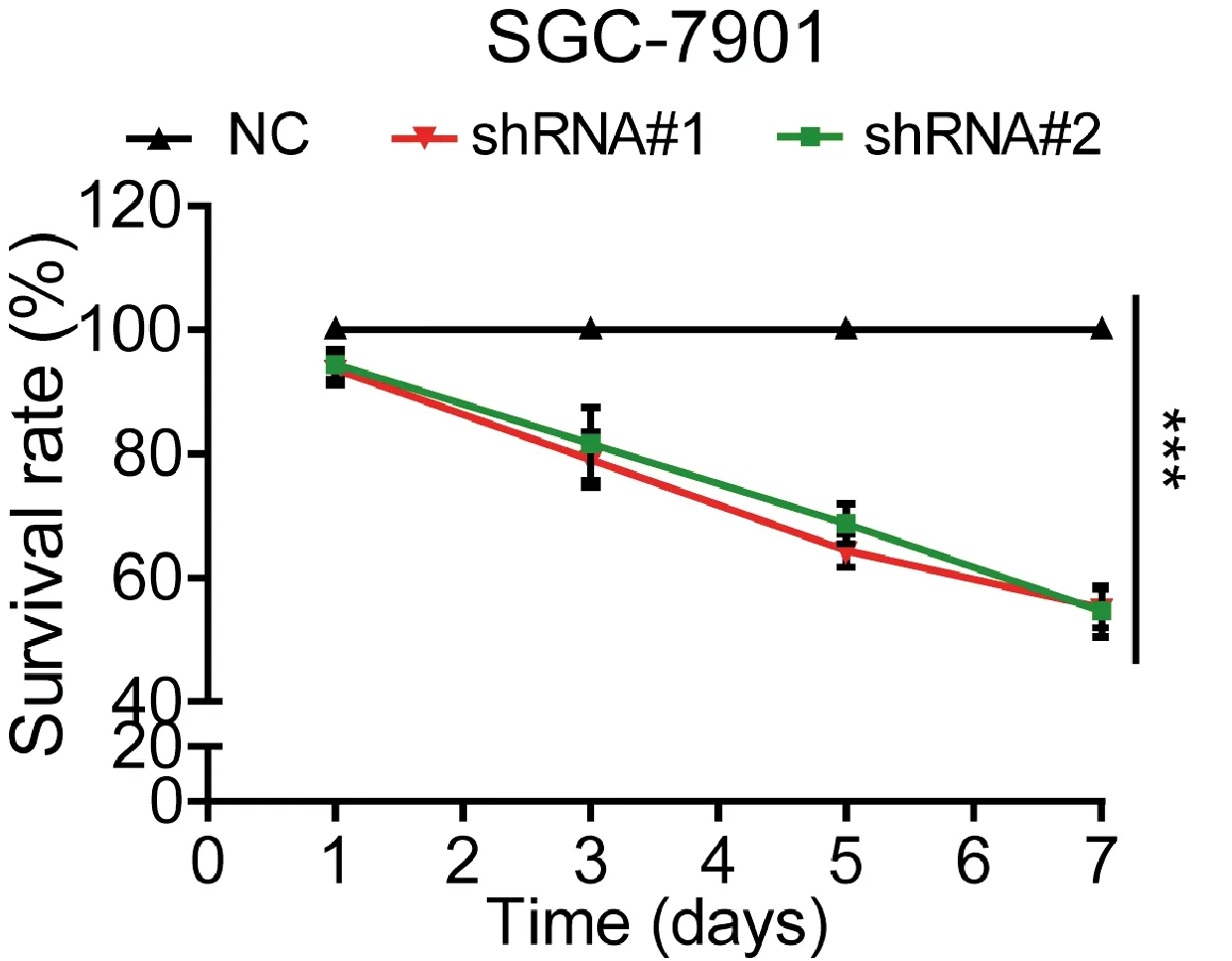
图3 TGFBI下调对SGC-7901细胞增殖的影响 ***表示P<0.001
2.4 TGFBI表达下调可抑制SGC-7901细胞的侵袭与迁移
为进一步考察TGFBI下调对胃癌细胞SGC-7901的侵袭与迁移影响,transwell法检测TGFBI稳定敲减细胞(TGFBI sh#1和TGFBI sh#2)和正常SGC-7901细胞侵袭与迁移的能力变化。结果发现,TGFBI表达下调后,SGC-7901细胞的侵袭与迁移能力均受到了显著抑制(图4)。

图4 TGFBI下调对SGC-7901细胞侵袭与迁移的影响 与NC组比较,**P<0.01
2.5 TGFBI影响胃癌复发转移的作用机制探究
为了探究TGFBI是否通过EMT促进胃癌的转移复发,通过Western blot检测EMT的标志物Snail、ZEB1和E-cadherin在SGC-7901-shTGFBI细胞中的表达水平,发现TGFBI表达下调后,细胞中Snail和ZEB1的表达受到了一定的抑制,而E-cadherin的表达水平得到了显著提高(图5A)。通过对比,Snail和ZEB1的蛋白表达水平较对照组分别下降了60%和30%左右,而E-cadherin的蛋白表达水平与对照组相比提高了4倍左右(图5B)。
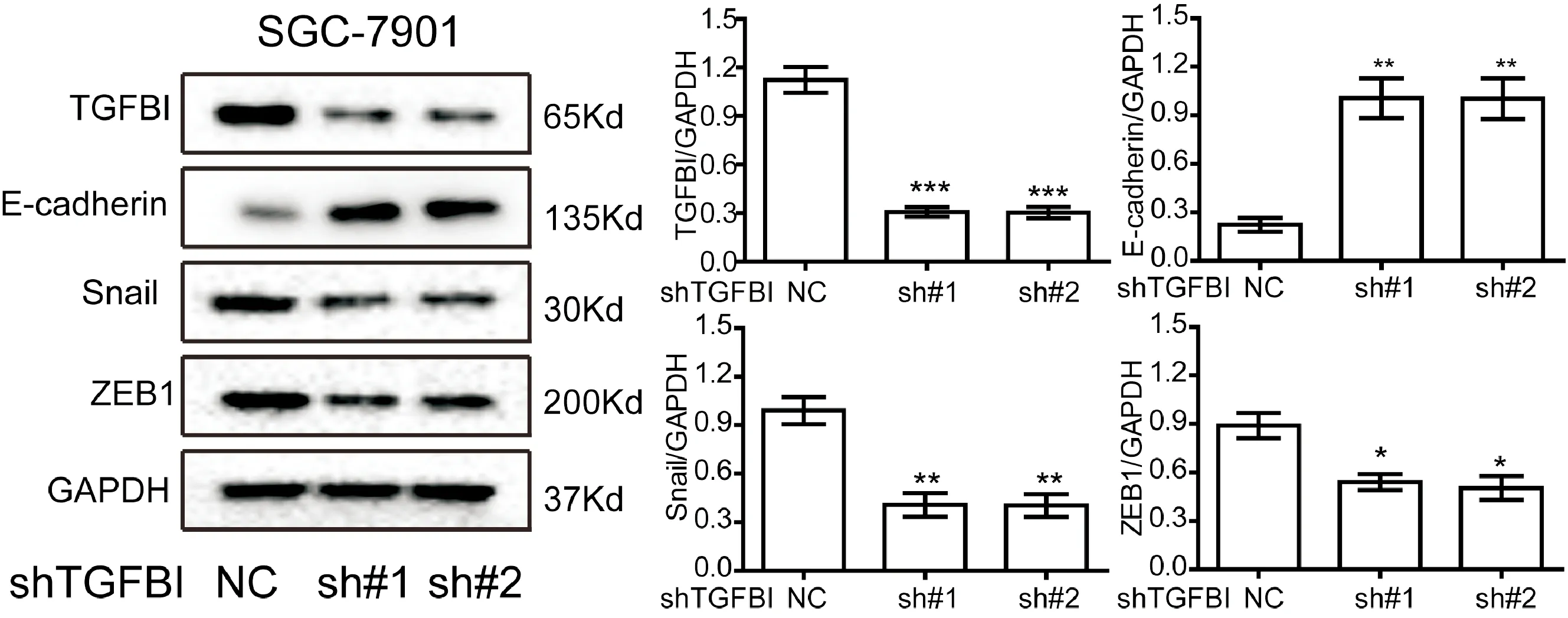
图5 转录因子表达情况检测 与NC组比较,*P<0.05,**P<0.01,***P<0.001
3 讨论
胃癌是一种临床高发性肿瘤疾病,术后易发生复发和转移,目前尚无有效的预后手段。以癌细胞增殖和转移通路中的关键基因为靶点的靶向药物研究,一直以来都是癌症临床治疗研究过程中所关注的重点。如在有关乳腺癌的靶向药物研究中,赫赛汀被发现能够通过特异性的抑制HER-2编码基因的表达,而用于乳腺癌晚期的解救治疗及其早期的辅助治疗[14]。目前,有关胃癌细胞转移的信号通路及作用机制已有一定的研究报道,其中在以表皮生长因子受体EGFR[15]、血管内皮生长因子VEGF[16]和膜受体酪氨酸激酶C-MET[17]等为靶点的靶向药物研究方面均取得了一定的进展。近年来,有研究表明上皮细胞间质转化与胃癌细胞的转移及进展有密切的关系[5]。
TGFBI作为一种由TGF-β1诱导合成的胞外基质蛋白,在多种癌细胞的转移机制中均具有重要的作用,然而该蛋白与胃癌术后复发和转移之间的关系尚不明确。本研究首先对比了不同性别、年龄和临床病理特征胃癌患者血液样本中TGFBI的表达情况,发现胃癌复发病人血液中TGFBI的表达水平与肿瘤低分化、转移以及临床分期正相关,表明TGFBI与胃癌的复发和进展有密切相关。研究表明,敲除口腔鳞癌细胞的TGFBI可显著抑制其增殖、侵袭和转移[18]。为了考察TGFBI的表达与胃癌细胞行为特性的关系,本研究利用RNA干扰技术将SGC-7901细胞中TGFBI的表达进行了下调,结果发现TGFBI表达下调后SGC-7901细胞的增殖、侵袭与迁移能力均受到了显著的抑制。
以往研究表明,转录因子Snail高表达及黏附分子E-cadherin低表达可作为胃黏膜恶性转变和胃癌浸润转移的重要生物学标志,并对其预后有重要的意义[19]。为进一步探究TGFBI表达对胃癌术后转移复发的作用机制,本研究对胃癌细胞中Snail、ZEB1和E-cadherin的表达水平进行了检测。发现TGFBI表达下调后,SGC-7901细胞中E-cadherin的表达水平显著提高,而Snail和ZEB1的表达水平显著下降。由E-cadherin表达下调引起的EMT转变,是癌细胞侵袭和迁移抑制过程中的常见作用机制,且在肝癌的侵袭和转移机制研究中已得到证实[6, 20]。因此,SGC-7901细胞中TGFBI表达下调后可能也是通过该机制对胃癌细胞的增殖、侵袭和迁移进行抑制。
综上所述,胃癌细胞中TGFBI下调可能通过上调E-cadherin的表达抑制胃癌细胞发生EMT转变,进而抑制其侵袭和迁移。因此,TGFBI可能作为一个候选的靶点用于胃癌相关靶向药物的研究开发,并为胃癌的有效预后提供一定的指导。

