通过水下内镜黏膜切除术确诊肠道滤泡性淋巴瘤2例
霍佳慧,王小云,龚镭,胡臻,顾馨
胃肠道滤泡性淋巴瘤(gastrointestinal follicular lymphoma, GI-FL)发病率较低,占胃肠道非霍奇金淋巴瘤的1%~3.6%[1]。肠道滤泡性淋巴瘤在我国报道较少,长期随访数据较少。本院收治2例肠道病变患者经反复内镜下组织钳活检获取病理组织,无法确诊,通过水下内镜黏膜切除术(underwater endoscopic mucosal resection,UEMR)取得大块病变组织,确诊为肠道滤泡性淋巴瘤,现详述其诊断、治疗及随访过程。
1 病例资料
1.1 病例一
患者,男,42岁。2019年3月体检发现十二指肠降部黏膜粗糙,病灶大小约2.0 cm×3.0 cm,活检标本病理示黏膜慢性炎伴淋巴组织增生。胸腹盆平扫及增强CT、小肠CT、结肠镜检查均未见明显异常。胶囊内镜示十二指肠降部见一片状黏膜粗糙,空肠多发灶性淋巴管扩张。2019年4月患者复查胃镜,并行十二指肠降部病变内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)大块黏膜活检(图1A-C),术中出现标本丢失,进入小肠无法回收,重新予大块活检,病理示固有膜内见大量淋巴细胞浸润,细胞较小而一致,可见滤泡形成。免疫标记结果示:CKpan(-)、CD20(+)(图1D)、CD3(滤泡间散+)、CD79α(+)、CD43(滤泡间散+)、CD5(滤泡间散+)、CD10(滤泡+)、CD35(滤泡树突网+)、CD23(滤泡+)、Bcl-6(滤泡+)、Bcl-2(+)、CyclinD1(-)、MUM1(-)、Ki-67(滤泡内30%+,滤泡间区5%+),病理诊断考虑滤泡性淋巴瘤(1级,低级别)。2019年12月患者复查胃镜,十二指肠降部可见片状黏膜粗糙,病灶较前增大(图1E),经血液科医师会诊后,建议再次行病理评估,故行UEMR大块活检(图1F、G),病理示黏膜内异常淋巴细胞增生(图1H),呈结节状及散在分布,结节内以中心细胞为主,中心母细胞<15个/高倍镜视野(high-power field,HPF),考虑滤泡性淋巴瘤,免疫标记结果示:CD20(+)、CD3(散在+)、CD79α(+)、CD43(散在+)、CD10(+)、CD35(散在+)、CD23(+)、Bcl-6(+)、Bcl-2(+)(图1I)、CyclinD1(-)、MUM1(-)、Ki-67(热点区域30%+),患者PET-CT及骨髓穿刺活检结果未见明显异常。根据Ann Arbor分期,诊断考虑十二指肠滤泡性淋巴瘤(Ⅰ期,低级别),采取观察等待的治疗方式,随访9个月。
1.2 病例二
患者,女,57岁。既往因直肠癌行直肠前切除术,有结肠息肉病史。患者2016年1月行肠镜检查时发现回肠末端黏膜充血,活检病理提示黏膜慢性炎伴淋巴组织增生。2017年2月复查肠镜末端回肠多发黏膜小隆起(图2A),病理提示淋巴组织增生。小肠CT提示右下腹回肠可见局限性肠腔轻度狭窄,周围可见小淋巴结。2018年5月患者胸腹盆增强CT提示腹腔多发淋巴结轻度肿大,肠镜示回盲瓣见颗粒样增生(图2B),病理诊断考虑末端回肠、回盲瓣淋巴组织高度增生伴不典型增生,免疫组化结果:CD20(+)、CD79α(部分+)、CD3(部分+)、CD43(部分+)、CD45RO(部分+)、Kappa(部分+)、Lambda(小灶性+)。患者出院后至复旦大学附属肿瘤医院行病理示浅表黏膜内见淋巴组织增生伴非典型增生,免疫组化结果示淋巴细胞大部分CD20(+)、Bcl-6(+)、Bcl-2(+)、少量CD3(+)、cyclin D1(欠满意)、Ki-67+(约30%);浆细胞:Kappa部分+、lambda部分+(κ+者略多于λ+者);上皮细胞:AE1/AE3+,建议重复活检进一步诊断。2018年12月行UEMR大块活检,末端回肠可见及回盲瓣可见多发黏膜隆起,大小约0.6~0.8 cm。并予完善骨髓穿刺术,组织病理示回盲部黏膜活检处淋巴滤增生(图2C),套区萎缩或消失,滤泡内细胞形态趋于一致,以中心细胞为主,中心母细胞<15个HPF,免疫组化:CD20(+)(图2D)、CD79α(+)、CD3(-)、CD5(-)、CD23(+)、CyclinD1(-)、CD10(+)、Bcl-2(+)、CD43(-)、CD45RO(-)、Ki-67+(20%~30%)。骨髓穿刺结果示滤泡性淋巴瘤,流式细胞学检查提示CD19、CD20、CD79b、FMC7、CD23、CD22、CD81、sIgM、sIgD、cKappa表达阳性,CD103、CD11c、CD5、CD43、CD38、CD138、CD25、cLambda、CD200表达阴性。根据Ann Arbor分期,诊断考虑末端回肠滤泡性淋巴瘤(Ⅳ期,低级别),采取观察等待的治疗方式,共随访35个月。
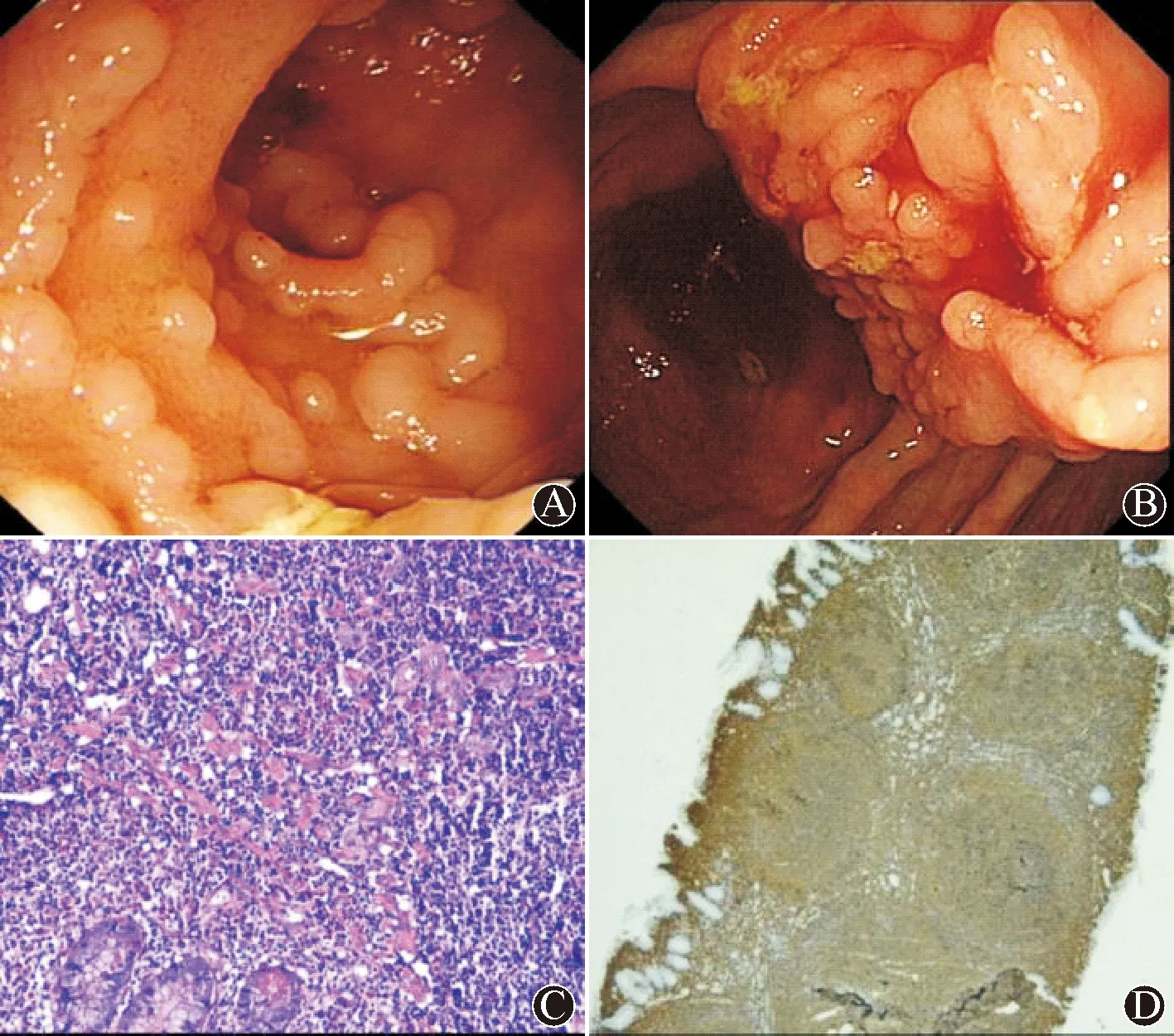
图2 病例二内镜及病理图像 A:肠镜检查可见末端回肠多发黏膜小隆起;B:随访肠镜提示回盲瓣见颗粒样增生;C:UEMR活检病理,HE×100;D:UEMR活检标本免疫组化示CD20+,×40
2 讨论
GI-FL大多无明显特殊临床表现,GL-FL好发于十二指肠、末端回肠、空肠等部位,以十二指肠降部较为多见。在一项日本的多中心回顾性研究中,125名患者中病变累及十二指肠部位有89%,其中十二指肠降部占81%,22%的患者病变累及回肠部,2%累及结肠[2]。GI-FL的内镜下表现包括散在的1~2 mm白色小结节、多发的肿块和隆起型息肉,也有较为少见的表现为环状溃疡[3]。免疫组化结果表现为B淋巴细胞的表面标志如CD19、CD20、CD22、CD79a等表达阳性,CD3、CD5、cyclin D1等表达阴性。FL免疫组化CD10及Bcl-2阳性可用于与淋巴样增生、MALT淋巴瘤、套细胞淋巴瘤鉴别[4]。
在临床实践中,病例二经长期内镜随访,多次行组织钳活检,但因活检组织较少,免疫组化结果欠满意,而FL的确诊主要依靠病理。获取标本的量对病理医师的诊断至关重要。既往研究表明,在部分胃肠道疾病中EMR大块活检标本较普通内镜活检标本的确诊率更高[5-7]。通过EMR、ESD大块活检的组织标本则能进一步提供病变浸润深度、切缘状态、有无脉管侵犯等信息,能进一步协助诊治。由于此病变好发于十二指肠降部及末端回肠,其肠壁较薄,ESD大块活检技术可以获取大块组织,但是手术风险较大,对操作者的要求高,易发生穿孔、延迟出血。病例一病变位于十二指肠降部,进行黏膜下注射时倾向于沿褶皱方向扩散,较难产生良好的抬举效果,十二指肠肠壁较薄,在切开时易导致穿孔[8]。在第一次获取病例一病理组织时采用了ESD技术,术后无明显并发症,但术中标本由于降部重力及肠道推进式蠕动进入十二指肠远端,而未能回收标本。UEMR由Binmoeller发明并证实其可行性,不采用充气的方式,而是通过注水形成天然安全的水垫,消除重力影响,使黏膜和黏膜下层漂浮相较于固有肌层分离。Binmoeller对12例十二指肠非壶腹部侧向发育型腺瘤进行UEMR治疗,25%(3/12)患者出现延迟出血,未发生穿孔[9]。应用UEMR切除结肠侧向发育型肿瘤的研究中,UEMR组(36例)未出现出血、穿孔等不良事件,传统EMR组中4.5%(2/44)的患者发生出血事件[10]。在一项135例结肠息肉的研究中,UEMR较EMR的完整切除率更高,随访后复发率较低[11]。UEMR技术由于水的预填充,病灶在黏膜下层的脂肪组织衬垫下,容易漂浮起来,在单位圈套内获得更多活检标本,且相对于空气填充,肠壁被动性变薄的风险降低,标本漂浮在水中,使标本易于回收,应用在肠道滤泡性淋巴瘤的活检中更为安全有效。
FL是一种惰性淋巴瘤,预后相对良好,结合美国国家综合癌症网络(NCCN)发布的B细胞淋巴瘤指南[12]、2019年中国临床肿瘤学会(CSCO)淋巴瘤诊疗指南[13],对于Ⅰ~Ⅱ期FL,放射治疗为标准治疗,单用抗CD20单克隆抗体利妥昔单抗或联合环磷酰胺+多柔比星+长春新碱+泼尼松CHOP化疗也较为常用。Ⅲ~Ⅳ期FL由于病变进展缓慢,可采用观察等待的方式,若有治疗指针如终末器官功能受损、病情快速进展、继发血细胞减少症等也可进行局部放疗、化疗等治疗方式。部分十二指肠淋巴瘤患者可自愈。采取手术治疗的患者较少,合并肠穿孔或肠梗阻时多会选择手术治疗,手术治疗后仍有复发风险,需要注意手术范围的选择及淋巴结的清扫[14]。由于GI-FL发病率低,缺少大样本的综合性研究,对于无症状的晚期低级别非霍奇金淋巴瘤患者,观察等待的方式是合适的[15]。另一项研究表明观察等待组与使用利昔单抗联合化疗并维持治疗组,两组无进展生存率无明显差异[16]。本文中2例患者均采用了观察等待的方式,分别随访9个月、35个月。病例一为Ⅰ期患者,根据指南建议放疗、化疗或免疫治疗的方式,考虑等待观察组与化疗维持组无进展生存率无明显差异,患者选择观察等待的治疗方式,并密切随访胃镜及病理检查。病例二为Ⅳ期低级别患者,目前无明显症状,根据NCCN及CSCO指南,患者选择继续观察等待。
综上所述,胃肠道是结外淋巴瘤的好发部位,最终确诊及后续治疗需要大块活检标本明确病理。十二指肠及回肠均为好发部位,但此处肠壁较薄,无论EMR或ESD均有迟发性穿孔的风险,而UEMR可避免上述缺点,在较为安全的前提下取得大块病变组织。本文报道了2例肠道滤泡性淋巴瘤,内镜表现、疾病分期、疾病进展各不相同,均采取UEMR获得大块活检标本。目前GI-FL的诊治尚不规范,需要更多及更长时间的随机对照试验证明最佳治疗方法,对于临床医师,尤其是消化科医师,应当提高对GI-FL的认识,避免漏诊、误诊、过度治疗,增强多学科合作意识,制定个体化的治疗及随访方案。

