川芎嗪通过抑制内质网应激减轻小肠缺血再灌注损伤的研究
孔维,尹清臣
小肠缺血再灌注损伤是肠道手术、创伤、休克、心功能不全等常见并发症,导致肠黏膜屏障受损使肠道内细菌、毒素进入血液循环,引发系统性炎症反应并诱发细胞凋亡,是导致患者死亡的重要因素[1-4]。近年来研究发现,内质网应激是诱导炎症反应和细胞凋亡的重要信号通路[5-6]。因此,以抑制内质网应激为切入点,研究能够防治小肠缺血再灌注损伤的新型药物具有重要的临床意义。川芎嗪(Tetramethylpyrazine,TMP)是从我国传统中药川芎中提取的一种活性生物碱,化学名 2,3,5,6-四甲基吡嗪,具有良好的抗炎、抗凋亡活性[7-8]。本研究在小肠缺血再灌注损伤大鼠模型造模前给予TMP预处理,研究TMP对小肠缺血再灌注损伤及内质网应激通路的影响。
1 材料与方法
1.1 实验动物与分组
无病原微生物级雄性Wistar大鼠120只,体质量(220~240)g,由河北医科大学实验动物中心提供,动物许可证号:SYXK(冀)2018-004,实验前适应性饲养7 d,实验前12 h禁食禁水。将120只大鼠数字编码后,按照随机数字表法分为假手术组、模型组和TMP低、中、高(15、30、60 mg/kg)剂量组[8],每组24只。
1.2 药物与试剂
磷酸川芎嗪注射液(TMP,规格2 mL∶50 mg)购自扬子江药业集团有限公司(批号20191219);CRP(货号:H126,批号:191228)、TNF-α(货号:H052,批号:191017)、IL-1β(货号:H002,批号:200114);酶联免疫(ELISA)检测试剂盒和TUNEL试剂盒(货号:G001-2-2,批号:191125)购自南京建成生物工程研究所;糖调节蛋白78(GRP78)抗体(货号:bs-1219R,批号:20191208)、增强子结合蛋白同源蛋白(CHOP)抗体(货号:bs-1630R,批号:20200107)、激活型半胱氨酸蛋白酶-12(Cleved Caspase-12)抗体(货号:bs-1105R,批号:20200311)、Cleved Caspase-3抗体(货号:bs-0081R,批号:20191108)、核因子-κB(NF-κB)抗体(货号:bs-0465R,批号:20191216)和山羊抗兔IgG二抗(货号:bs-0294P,批号:20191125)购自北京博奥森生物科技有限公司;DAB显色试剂盒(货号:ZLI-9017,批号:190426)购自北京中杉金桥生物技术有限公司。
1.3 主要仪器
VARIOSKANLUX型多功能酶标仪(美国 Thermo Scientific 公司);HM340E石蜡切片机(德国Thermo Scientific公司);SE300型蛋白质电泳仪(美国 Hoefer 公司);5427R型低温高速离心机(德国Eppendrof公司);DYCZ-40D型电泳槽(北京六一仪器厂);CFX型凝胶成像系统(美国Bio-Rad公司)。
1.4 实验方法
1.4.1 给药与模型制备 造模前30 min,TMP低、中、高剂量组分别腹腔注射15、30、60 mg/kg剂量的TMP,假手术组和模型组腹腔注射给予生理盐水。模型组和TMP低、中、高剂量组采用夹闭肠系膜上动脉60 min的方法复制小肠缺血再灌注大鼠模型;假手术组不夹闭肠系膜上动脉外,其余操作同模型组。再灌注2 h后,麻醉后脊椎脱臼处死,开腹剪取回盲部10 cm以上部分肠管,行各指标检测。
1.4.2 肠组织含水量的测定 随机取各组8只大鼠的肠管,用生理盐水冲洗内容物与血液后滤纸拭干,称重为湿重(W1);置95 ℃烤箱至恒重后称重为干重(W2),含水量(%)= [(W1-W2)/W1]×100%。
1.4.3 肠组织病理学检查及Chiu′s氏评分 随机取各组8只大鼠的肠管,用生理盐水冲洗内容物与血液,置4%多聚甲醛溶液固定3 d,石蜡包埋、切片(4 μm)、展片、二甲苯透明和梯度乙醇脱水后,行常规HE染色、中性树脂封片后通过光学显微镜观察肠组织病理学改变。Chiu′s氏评分[9]:未见异常计0分,肠黏膜绒毛顶端上皮下间隙增宽计1分,绒毛尖端上皮抬高与固有层剥离计2分,绒毛两侧上皮成块脱落计3分,上皮完全脱落计4分,黏膜固有层崩解并出血计5分。
1.4.4 细胞凋亡观察及凋亡指数(AI)的计算 取经二甲苯透明和梯度乙醇脱水后的肠组织石蜡切片,参照TUNEL试剂盒操作说明进行处理,50%甘油封片后通过光学显微镜观察细胞凋亡状况;分别计数视野中总细胞数和阳性细胞数(细胞核黄褐色为凋亡细胞),AI(%)=(阳性细胞数/总细胞数)×100%。
1.4.5 肠组织炎症因子水平检测 取各组剩余的8只大鼠的肠管,用4 ℃预冷生理盐水将肠内容物和血液冲洗干净后,加入9倍量4 ℃预冷裂解液行研磨匀浆,3 000 rpm离心取上清(转速3 000 rpm,时间10 min),按照ELISA试剂盒操作说明进行处理后,通过酶标仪检测肠组织CRP、TNF-α、IL-1β含量。
1.4.6 肠组织蛋白表达检测 取已制备的肠组织匀浆液,4 ℃离心取上清液(转速12 000 rpm,时间20 min),BCA法检测总蛋白含量、95 ℃水浴使蛋白变性后,以30 μg蛋白量上样、SDS-PAGE凝胶电泳、转膜、5%脱脂奶粉溶液37 ℃封闭1 h,洗膜后滴加GRP78、CHOP、Cleved Caspase-12、Cleved Caspase-3、NF-κB、β-actin抗体4 ℃孵育过夜,洗膜后滴加二抗37 ℃孵育1 h,洗膜后滴加DAB溶液显色,以β-actin为内参半定量GRP78、CHOP、Cleved Caspase-12、Cleved Caspase-3、NF-κB蛋白相对表达量。
1.5 统计学方法

2 结果
2.1 各组大鼠肠组织含水量比较
与假手术组相比,模型组大鼠肠组织含水量显著升高(P<0.01);与模型组相比,TMP中、高剂量组肠组织含水量显著降低(P<0.05),见表1。
2.2 各组大鼠肠组织病变及Chiu′s氏评分比较
假手术组大鼠肠组织形态结构未见异常;模型组呈现肠系膜结构紊乱、上皮细胞脱落、固有层分离、大量中性粒细胞浸润等病变;与模型组比较,TMP低、中、高剂量组大鼠肠组织上述病变明显减轻,其中TMP高剂量组肠系膜结构清晰、未见固有层分离、中性粒细胞明显减少。与假手术组比较,模型组大鼠Chiu′s氏评分显著升高(P<0.01);与模型组比较,TMP中、高剂量组Chiu′s氏评分显著降低(P<0.01)。见图1、表1。

图1 各组大鼠肠组织病变比较(HE,×200) A:假手术组;B:模型组;C:TMP低剂量组;D:TMP中剂量组;E:TMP高剂量组
2.3 各组大鼠肠细胞凋亡状况及AI比较
假手术组大鼠可见极少量散在的肠黏膜上皮细胞凋亡;模型组凋亡细胞数量明显增多,AI较假手术组显著升高[(41.50±6.02)%vs(3.42±0.58)%,P<0.01];TMP低、中、高剂量组凋亡细胞数量不同程度减少,其中TMP中、高剂量组AI较模型组显著降低[(22.65±4.37)%、(14.28±2.65)%vs(41.50±6.02)%,P<0.01]。见图2、表1。
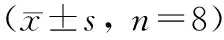
表1 各组大鼠肠组织含水量、Chiu′s氏评分和AI 比较
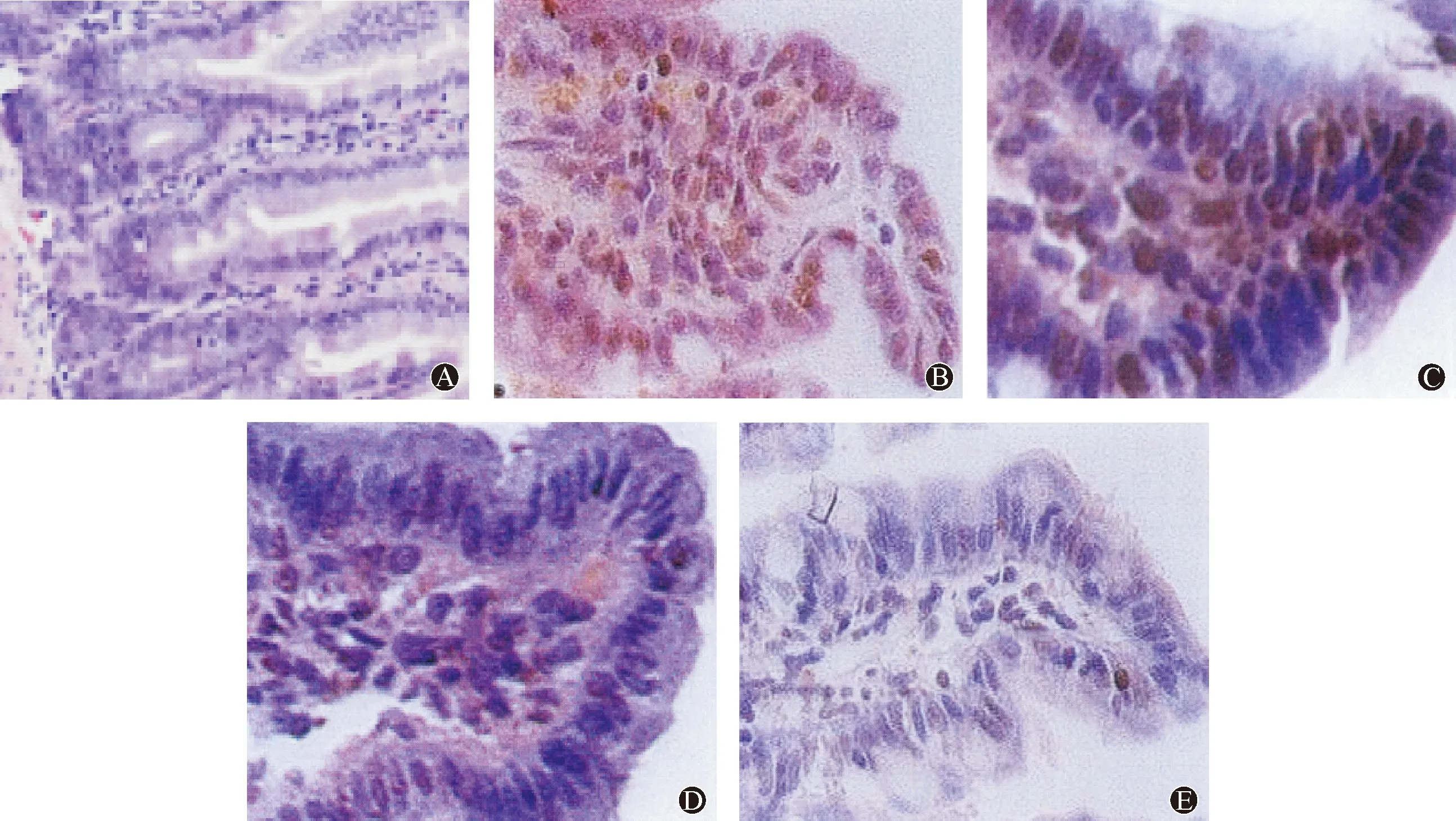
图2 各组大鼠肠细胞凋亡状况比较(TUNEL,×200) A:假手术组;B:模型组;C:TMP低剂量组;D:TMP中剂量组;E:TMP高剂量组
2.4 各组大鼠肠组织炎症因子水平比较
与假手术组比较,模型组大鼠肠组织炎症因子CRP、TNF-α、IL-1β含量显著升高(P<0.01);与模型组比较,TMP中、高剂量组CRP、TNF-α、IL-1β含量显著降低(P<0.01),见表2。
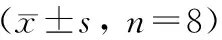
表2 各组大鼠肠组织炎症因子水平比较
2.5 各组大鼠肠组织GRP78、CHOP蛋白表达比较
与假手术组比较,模型组大鼠肠组织GRP78、CHOP表达显著上调(P<0.01);与模型组比较,TMP低、中、高剂量组GRP78、CHOP表达显著下调(P<0.05),见图3、表3。
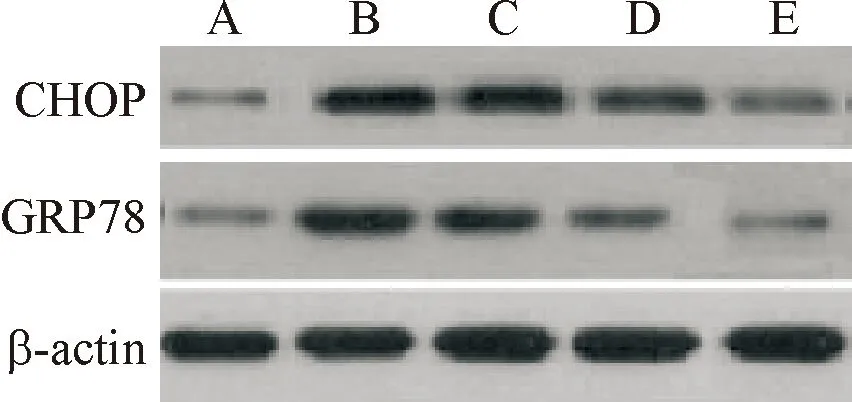
图3 各组大鼠肠组织GRP78、CHOP蛋白表达比较 A:假手术组;B:模型组;C:TMP低剂量组;D:TMP中剂量组;E:TMP高剂量组

表3 各组大鼠肠组织GRP78、CHOP蛋白表达水平比较
2.6 各组大鼠肠组织Cleved Caspase-12、Cleved Caspase-3、NF-κB蛋白表达比较
与假手术组比较,模型组大鼠肠组织Cleved Caspase-12、Cleved Caspase-3、NF-κB表达显著上调(P<0.01);与模型组比较,TMP中、高剂量组Cleved Caspase-12、Cleved Caspase-3、NF-κB表达显著下调(P<0.05),见图4、表4。
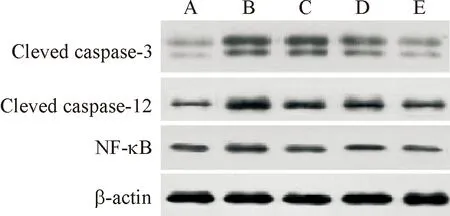
图4 各组大鼠肠组织Cleved Caspase-12、Cleved Caspase-3、NF-κB蛋白表达 A:假手术组;B:模型组;C:TMP低剂量组;D:TMP中剂量组;E:TMP高剂量组

表4 各组大鼠肠组织Cleved Caspase-12、Cleved Caspase-3、NF-κB蛋白表达水平比较
3 讨论
小肠是机体消化吸收的主要场所,拥有丰富的毛细血管网,对缺血缺氧极为敏感。小肠缺血再灌注损伤是临床常见并发症,在肠道术后及创伤、休克、心功能不全等重症疾病进展过程中发挥着重要作用。因此,防治小肠缺血再灌注损伤对改善危重病患者转归具有积极意义。
随着国家振兴中医药战略的实施以及中医药现代研究的深入,中药治疗消化系统疾病逐渐得到人们的关注与认可。川芎为伞形科蒿本属植物,主产于四川,为我国传统中药品种,《本经》、《吴普本草》、《唐本草》等医学典籍中均有记载,性温、味辛,具有活血行气、祛风止痛之功效。TMP是提取于川芎的一种活性生物碱,目前临床主要用于缺血性脑血管病的治疗。近年来研究发现,TMP能够通过抑制炎症和细胞凋亡而对心肌、肾脏缺血再灌注损伤起到保护作用[10-11]。而肠黏膜屏障受损致使肠道内毒素、细菌进入血液循环,引发系统性炎症反应综合症和细胞凋亡是小肠缺血再灌注损伤重要病理通路[12]。本研究发现,经TMP干预能够明显降低小肠缺血再灌注大鼠肠组织含水量,抑制肠系膜上皮细胞脱落、固有层分离、中性粒细胞浸润等病变,降低Chiu′s氏评分,抑制肠细胞凋亡并明显降低AI,提示TMP对大鼠小肠缺血再灌注损伤具有保护作用。
组织缺血缺氧及实现再灌注后将病理性刺激炎症因子(CRP、TNF-α、IL-1β等)大量释放而诱发炎症反应,其中TNF-α、IL-1β做为炎性趋化因子能够刺激粒细胞进一步合成与释放炎症因子,进而导致炎症级联反应[13-14]。本研究发现,经TMP干预能够显著降低小肠缺血再灌注损伤大鼠肠组织炎症因子CRP、TNF-α、IL-1β水平,提示TMP对小肠缺血再灌注后炎症反应具有抑制作用。
内质网是普遍存在于真核细胞中一种膜性细胞器,是机体调控炎症反应、细胞凋亡的重要通路。庞志路等[15]研究发现,内质网应激在小肠缺血再灌注损伤进展过程中发挥着重要作用。GRP78是存在于内质网的钙离子伴侣蛋白,对维持内质网稳态至关重要。Yang等[16]和余琴华等[17]研究发现当病理性刺激细胞导致内质网过度应激时,导致大量错误折叠和未折叠的蛋白蓄积,进而诱导GRP78大量合成,因此GRP7升高可作为内质网应激标志检测物质。CHOP是重要的促凋亡信号分子,内质网应激将诱导CHOP上调表达,激活Caspase-12(Cleved Caspase-12),并且Cleved Caspase-12能够剪切并活化Caspase-3(Cleved Caspase-3),进而诱导细胞凋亡[18-19]。NF-κB能够刺激炎症因子释放,任国强等[20]研究发现抑制NF-κB表达能够显著降低心肌缺血再灌注损伤大鼠炎症反应。本研究发现,经TMP干预能够明显下调小肠缺血再灌注大鼠肠组织GRP78、CHOP、Cleved Caspase-12、Cleved Caspase-3、NF-κB蛋白表达,这可能是TMP抑制小肠缺血再灌注后炎症反应和细胞凋亡的重要分子机制。
综上所述,TMP能够通过抑制内质网应激相关炎症和细胞凋亡通路,对小肠缺血再灌注损伤起到保护作用。

