氩离子凝固治疗胃窦血管扩张症的临床可行性研究
银新,张静,孙涛,李白容,陈虹羽,肖年军,宁守斌
胃窦血管扩张症(gastirc antral vascular ectasia, GAVE)于1953年由Rider最初报道,1984年由Jabbari正式定义[1]。Jabbari等将GAVE的内镜下表现描述为:胃窦部纵向、含有红色可见的、扩张、扭曲的血管黏膜皱褶,与周围组织边界清楚,这些血管受压后颜色变苍白,胃镜活检可致出血,根据其胃镜下表现,被形象地称为“西瓜胃”。GAVE常常合并全身系统性疾病如肝硬化、自身免疫性疾病、系统性硬化症、慢性肾功能衰竭、心脏瓣膜病变及胶原血管病等[2-5]。扩张的血管可导致难治性胃肠道出血。其临床表现从大便潜血阳性、慢性缺铁性贫血到急性胃肠道出血均可发生[6-8]。GAVE临床少见,本研究将4名GAVE患者作为研究对象,进行一次或多次内镜下APC治疗,根据患者的预后评价该治疗方法对GAVE的临床安全性及有效性。
1 资料和方法
1.1 一般资料
选取2016年1月至2020年4月中国人民解放军空军特色医学中心消化内科采用内镜下APC治疗的GAVE患者4例,共行APC治疗11例次,最多者接受4次治疗。
1.2 纳入及排除标准
1.2.1 纳入标准 ①患者符合GAVE的诊断标准[9];②临床表现为反复出现的黑便、大便潜血阳性、缺铁性贫血需要反复输血的患者;③内镜下血管扩张明显,具有GAVE的典型内镜下表现:纵向、含有红色可见的、扩张、扭曲的血管黏膜皱褶,与周围组织边界清楚,这些血管受压后颜色变苍白,胃镜活检可致出血。
1.2.2 排除标准 ①合并严重基础疾病不能耐受胃镜检查及治疗的患者;②患者或家属不愿意承担内镜下胃窦血管扩张治疗的相关风险。
1.3 APC治疗GAVE的术前准备及注意事项
1.3.1 术前评估 全面评估患者一般情况,部分患者存在自身免疫性肝病、肝硬化、血液系统疾病等,凝血机制障碍、血小板减低,对该类患者应纠正凝血功能、补充血小板后再进行内镜下治疗。
1.3.2 术前补充血红蛋白 GAVE患者均存在不同程度的贫血,多数患者处于中-重度贫血,需补充血红蛋白至60 g/L以上再进行内镜下治疗,同时可减少因贫血带来的麻醉相关风险。
1.3.3 注意事项 GAVE 患者血管扩张分布于胃窦四壁,呈纵向分布,多数累及面积大,APC治疗后形成大面积溃疡,因此为避免术后并发症的发生,对于累及范围广的扩张血管,应分次治疗。
1.3.4 术后处理和随访 术后48 h内禁食,予以补液、静脉营养、PPI抑酸、胃黏膜保护剂;术后长期随访。
1.4 病历资料
病例1:患者,女性,56岁,因“间断黑便伴头晕、乏力10年,加重1个月”入院。既往血红蛋白最低至49 g/L,外院反复多次输血,曾行胃镜检查诊断:慢性胃炎伴糜烂,肠镜检查未见异常。2019年11月外院复查胃镜并诊断胃窦血管扩张症,未予治疗。既往否认其他疾病病史。2019年12月就诊于空军特色医学中心消化科,胃镜检查:环腔血管扩张(图1A、B),血管受压后颜色变苍白,根据典型的内镜下胃窦扩张血管的特点,诊断“GAVE”明确,并行内镜下APC治疗(图1C、D)。2020年4月复查已明显好转(图1E),再次内镜下APC治疗余所见扩张血管。治疗的4个月期间血色素由72 g/L升至111 g/L,监测大便潜血阴性,期间未再输血。两次内镜术中及术后均未发生出血、穿孔及感染等并发症。2020年7月复查胃镜,胃窦扩张血管完全消失(图1F)。
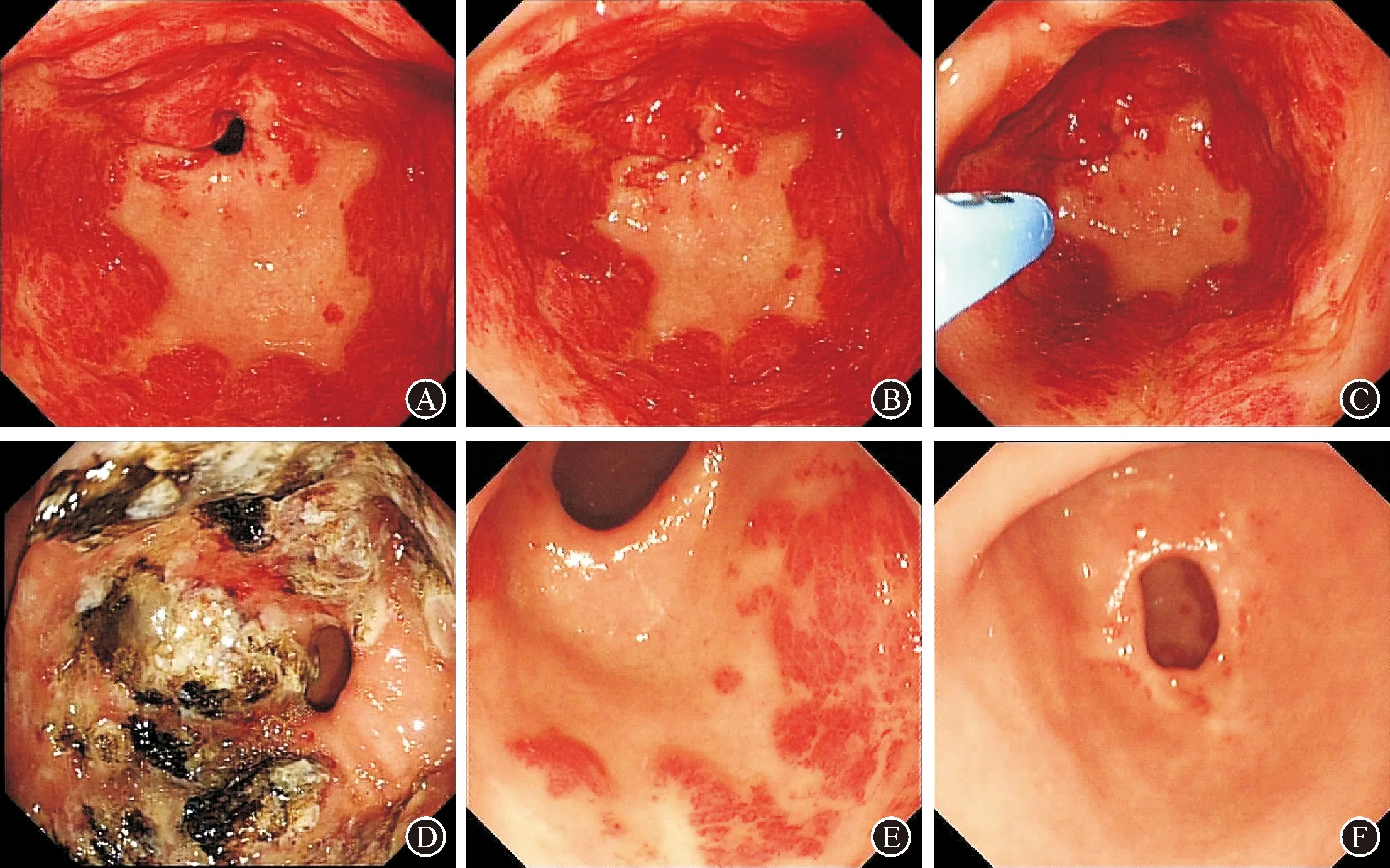
图1 病例1内镜表现及治疗经过 A、B:初次就诊(2019年12月),胃窦环腔血管扩张;C:对扩张血管进行APC高频电流凝固治疗;D:APC凝固后创面呈环周溃疡改变;E:第二次胃镜检查(2020年4月),胃窦扩张血管明显减少,扩张血管以胃窦后壁明显,余区域散在治疗后修复瘢痕;F:第二次治疗后3个月复查胃镜(2020年7月),胃窦扩张血管完全消失,幽门周围可见白色溃疡瘢痕
病例2:患者,女性,52岁,因“间断黑便伴头晕、乏力9个月”于2017年6月入院,既往多家医院就诊,曾行胃镜检查诊断为:慢性胃炎伴糜烂,未明确消化道出血原因。既往病史:①双侧甲状腺结节;②混合性焦虑、抑郁状态。就诊我院后行胃镜检查,可见胃窦扩张血管,与患者沟通后,患者拒绝接受内镜下治疗。出院后仍反复黑便,2017年9月再次因“黑便”就诊,此次经口小肠镜检查可见胃窦散在分布6条纵行的扩张血管(图2A)及空肠畸形血管(图2B),内镜下APC治疗(图2C、2D)。术中及术后无出血、穿孔及感染等并发症。2017年9月治疗后电话随访至2020年8月,未再出现黑便,血色素稳定于100 g/L以上。因患者精神障碍,未来院复诊。
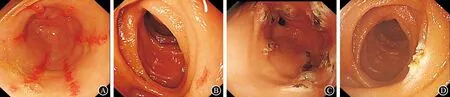
图2 病例2内镜下表现及治疗情况 A:治疗前胃窦可见6条纵行扩张的血管;B:治疗前空肠距幽门90 cm及180 cm两处畸形的血管;C:APC凝固治疗胃窦扩张的血管;D:APC凝固空肠畸形、扩张的血管
病例3:患者,女性,59岁,2016年1月因“反复黑便伴头晕、乏力9年”入我科。9年期间多次因“黑便、乏力”就诊于外院,多次胃镜检查诊断为:慢性胃炎伴糜烂。曾给予“奥美拉唑+悬浮红细胞输注”等治疗,但贫血反复发生,大便潜血阳性。2013年6月外院胶囊内镜检查:胃窦多发血管扩张。2014年腹部CT:肝左叶及尾叶丰满,实质性密度欠均匀,考虑脂肪性浸润可能,门静脉主干增宽,脾大;行肝穿活检,病理:肝细胞肿胀,部分脂肪变性,可见点状坏死,肝血管窦血管扩张充血及汇管区少量淋巴细胞浸润,诊断为“原发性胆汁性肝硬化”。2016年1月血红蛋白降至27 g/L,输血至61 g/L后由外院转入我科。查体:重度贫血貌,消瘦,皮肤及结膜、甲床苍白;心率92次/min,腹平软,无压痛,肝脾肋下未触及。胃镜检查:胃窦多发纵行、扩张血管伴活动性出血(图3A、B),结合患者病史及内镜下胃窦扩张血管的表现及胃窦活检病理“黏膜萎缩,间质伴小血管增生、扩张”(图3C、D),诊断“GAVE”明确。
自2016年1月至2016年10月先后三次在我院行胃镜检查及镜下APC治疗(图3E),术中及术后无出血、穿孔及感染等并发症出现。三次治疗期间未再输血,血红蛋白逐渐上升,2016年10月末次诊疗期间复查胃镜:胃窦四壁呈纵行及片状分布的增生样改变,无血管扩张及活动性出血(图3F)。化验血红蛋白升至117 g/L,大便潜血阴性。末次治疗后电话随访至2020年8月,期间未再出现黑便,血色素稳定于100 g/L以上。
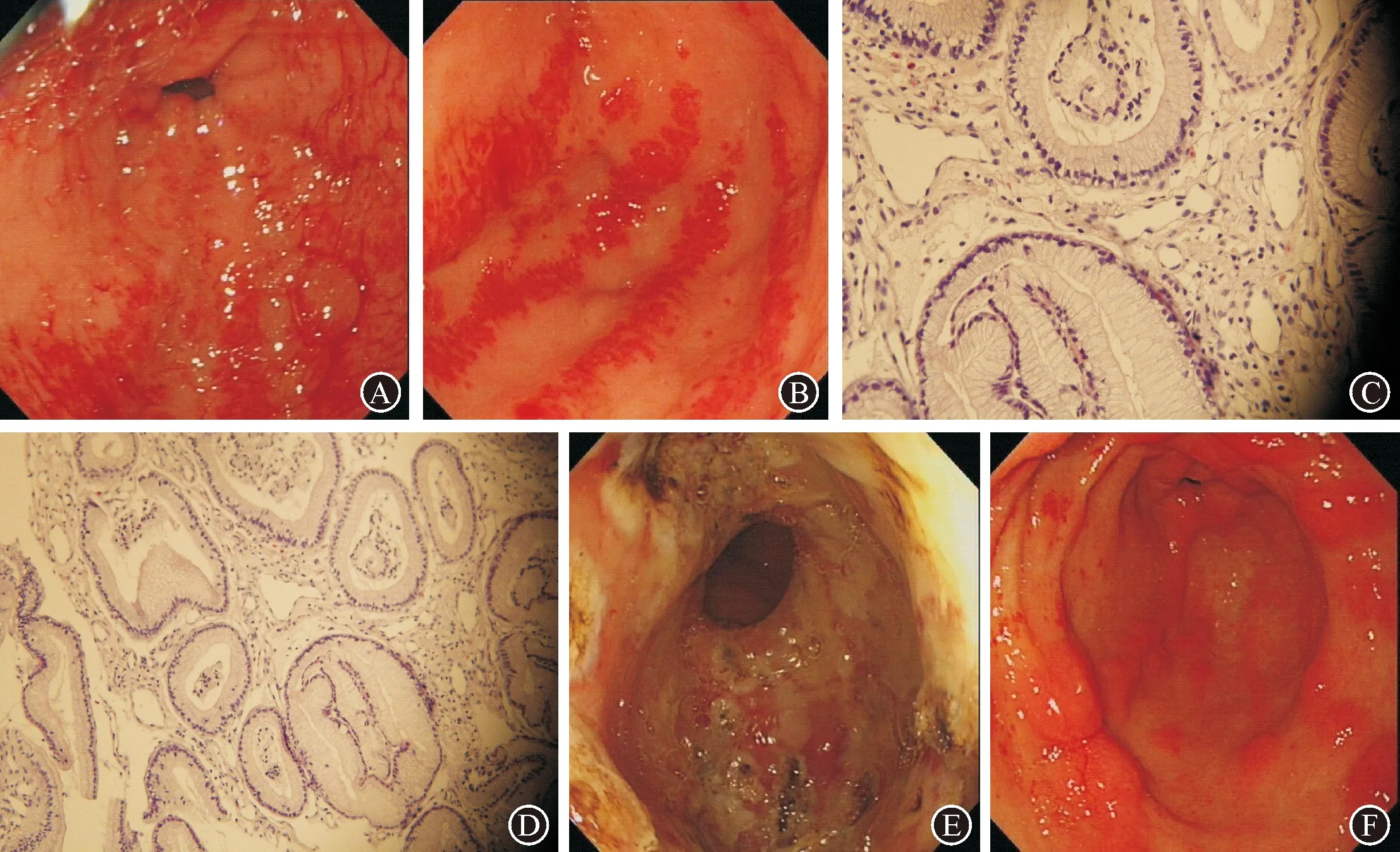
图3 病例3治疗前后内镜下表现及胃窦病变处的病理表现 A:初次胃镜检查(2016年1月),胃腔内较多鲜红色血性物,充血黏膜处不断有新鲜血液渗出;B:生理盐水冲洗后见胃窦四壁多条纵行分布的条带状鲜红色黏膜,贴近观察见成片血管扩张,伴多个部位渗血;C(×20)、D(×40):胃窦病变处活检,黏膜萎缩,间质伴小血管增生、扩张;E:对所有可见的扩张血管予以APC凝固治疗,治疗后呈环腔溃疡改变;F:末次胃镜检查:胃窦四壁见纵行及片状分布的增生样改变
病例4:患者,女性,74岁,因“间断黑便2年”于2016年2月入院。两年期间曾多次行胃镜检查诊断:十二指肠球部溃疡、慢性胃炎伴糜烂。正规PPI治疗消化性溃疡后仍反复黑便。外院经口小肠镜及胶囊内镜检查均未明确出血原因。2016年2月我科胃镜复查首次确诊为GAVE,并先后4次进行APC凝固治疗(分别为2016年2月、2016年6月、2016年11月、2017年4月),治疗后由之前“条带状扩张的血管(图4A)”变为“弥漫点状充血(图4B)”,无再发活动性出血。术中及术后未发生出血、穿孔及感染等并发症。治疗期间监测血色素逐渐上升,由初次就诊时48 g/L升至101 g/L,期间未输血。2018年1月该患者因“腹胀伴下肢水肿”外院就诊,诊断为“肝硬化、脾大、腹水”,之后继续于外院治疗(具体情况不详)。
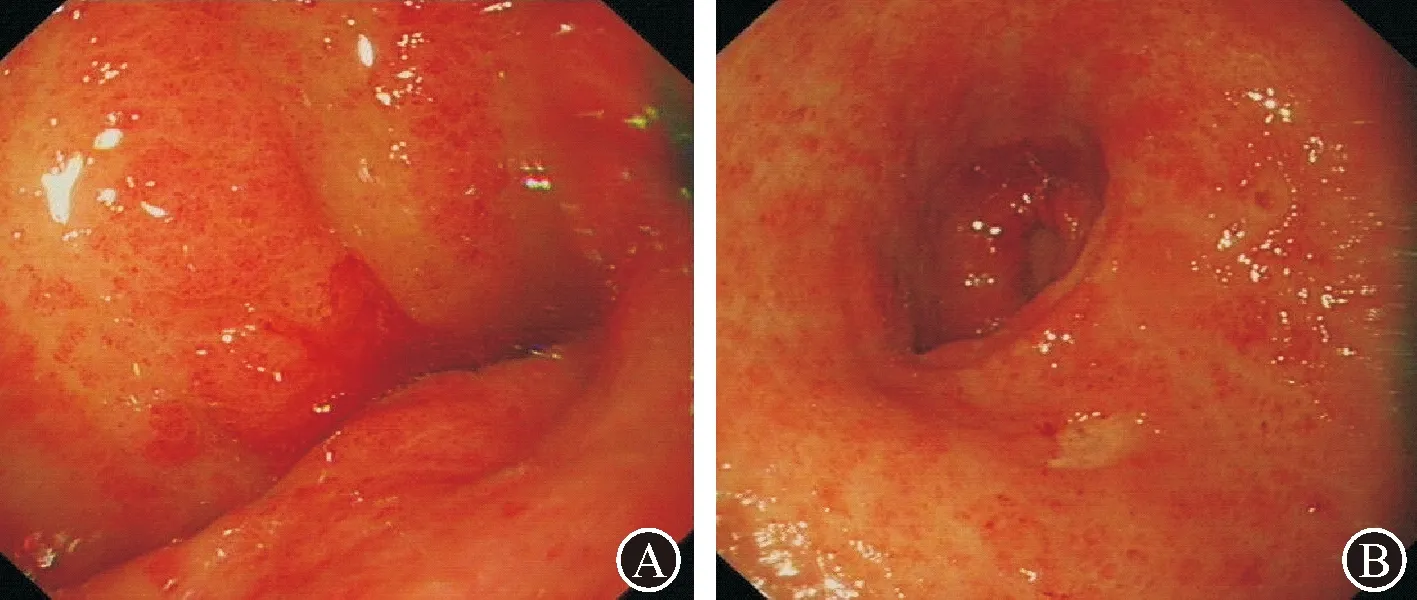
图4 病例4内镜治疗前后比较 A:初次胃镜检查(2016年2月),胃窦大弯及小弯侧散在分布条带状的扩张血管,表面可见渗血;B:末次胃镜检查(2017年4月),胃窦黏膜弥漫性点状充血,无渗血,对区域性充血黏膜予以APC凝固治疗
2 结果
4例患者共进行11例次胃窦扩张血管的APC凝固治疗,均达到内镜止血效果。4例患者末次化验大便潜血均为阴性,血色素均提升至100 g/L以上并稳定,术中及术后均未发生出血、穿孔等并发症。4例患者术后均无腹痛、腹胀、反酸、发热等不适症状。
3 讨论
GAVE发病率低,约占非静脉曲张上消化道出血患者的4%,多见于有自身免疫性疾病的中老年女性。诊断主要依靠典型的内镜下表现及病变组织活检。病变主要在胃窦部,内镜表现主要分为点状和条状血管扩张、畸形。典型的病理特征是活检组织中可见胃黏膜血管扩张和微血栓形成、梭形细胞增生和纤维透明样变性。除了胃窦部,病变还可累及其他部分的胃黏膜,可合并十二指肠及空肠血管扩张。我科诊治的病例2,就同时存在空肠血管扩张。本病有时与门静脉高压性胃病、急性糜烂出血性胃炎、药物相关性胃炎等难以鉴别。本报道的4个病例病史在9个月至10年,均在外院接受过胃镜检查,未能明确出血病因,最可能的原因在于当地基层医院的诊治经验及认识不足,简单诊断为“慢性胃炎伴糜烂”,且未行活检,导致误诊,给予抑酸、黏膜保护剂等治疗,效果不佳,患者反复消化道出血不能控制。
GAVE的病因及发病机制并不明确,可能机械和体液因素共同作用导致血管发育异常,胃酸及胃内食物损伤黏膜下充血血管导致了临床上明显的出血。GAVE胃窦部常有异常蠕动,所产生的机械压力可以刺激肌层成纤维细胞增生肥大,渐渐引起黏膜下血管堵塞,血管内静水压升高,静脉、小静脉、毛细血管逐渐扩张,导致血管发育异常。血管发育异常使远端胃黏与肌层疏松结合,引起血管黏膜脱垂和损伤,并且刺激固有层肌细胞反应性增生和纤维化。纤维微血栓可引起局灶缺血的胃黏膜血管破裂而出血[10]。高胃泌素水平可以诱导毛细血管括约肌舒张,进而促进局部血管增生和扩张[11]。目前关于GAVE发病机制的理论均是在小样本病例上总结的,随着研究的深入,其确切的发病机制将更加明确。
目前报道的GAVE治疗方法主要有:①药物治疗,激素、环磷酰胺、氨甲环酸、沙利度胺等,效果均有限,且以激素为主的药物治疗其副作用限制了临床使用[12-14];而静脉用“贝伐单抗”虽可降低胃窦性血管扩张和小肠血管扩张患者的输血需求和内镜干预,但有待于进一步证实临床可行性[15-16]。②内镜治疗,包括热探头、激光、APC、内镜下结扎术等。③外科手术治疗(胃窦切除等)[17-19]。近年来,氩离子凝固法(APC)越来越显示出其优越性,其应用电离的气体凝固2~3 mm深病灶,但并不直接接触病灶,相比其他内镜下治疗方式及外科手术,其成本低、创伤小、并发症发生率低,且其有效性得到一些小样本临床数据的验证。2013年,陈步吉等采用氩气对13例消化道毛细血管扩张症患者进行APC治疗,疗效满意[20]。我们中心诊治的4例患者,共行11例次APC治疗,每位患者内镜治疗前后对比均有良好的效果,且术后化验大便潜血,监测血常规变化,验证了消化道出血能够得到有效地控制;术中及术后均未发生消化道出血、穿孔、术后感染等并发症。
综上所述,内镜下APC治疗GAVE是一种安全、有效、创伤小的治疗方式,值得临床推广。但其是否可成为GAVE的首选治疗方式,仍需要临床大数据支持及更长时间的病例随访。
——待赏的孤芳

