富燃料条件下CH4 对H2S 氧化及COS 和CS2 生成的影响
郭松灵,李 洋,喻昕蕾,陶 迅,梁钦锋,丁 路,许建良,代正华,王辅臣
1.华东理工大学水煤浆气化及煤化工国家工程研究中心(上海),上海 200237;2.广东美芝制冷设备有限公司,广东 佛山 528300
H2S 是煤气化过程、石油加工和天然气净化等工艺的主要副产物[1]。其本身是一种易燃、剧毒和有腐蚀性的气体,燃烧产物主要为SO2,会严重污染环境[2]。目前,克劳斯工艺被广泛应用于H2S 回收生产单质硫[3],该工艺主要包括热反应和催化反应两个过程。热反应过程中,H2S 主要进行以下两个反应:
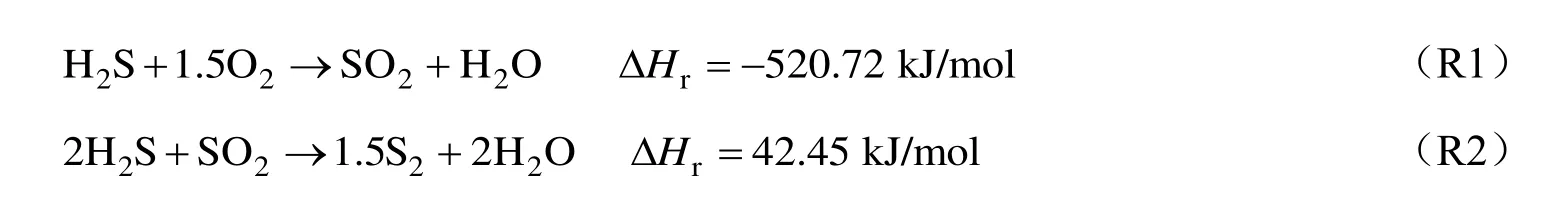
催化反应过程中,剩余H2S 与SO2在催化层上进行如下反应[4-6]:
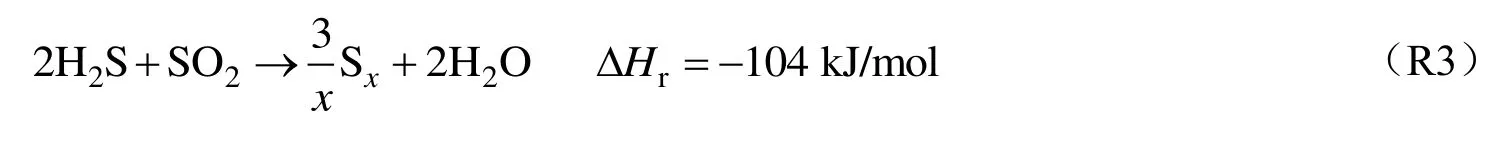
H2S 部分氧化过程被认为是克劳斯工艺中最重要的步骤,其燃烧特性、气体组分和杂质等因素均与总硫回收率密切相关[7]。来自不同气体净化工艺的H2S 气体组成各异,且经常存在CO、CO2和烃类物质(如甲烷、苯、甲苯和二甲苯)等杂质,在燃烧过程中会发生副反应,产生COS 和CS2[8],烃类物质在不完全反应时会产生炭黑,沉积在催化剂表面,影响催化剂性能[7-8]。因此要优化氧化工艺,抑制副产物的生成以及提高硫回收率,就需要深入探究H2S 氧化以及COS 和CS2的形成过程,这已成为国内外学者研究的热点。
Li 等[9-12]进行了酸性气体燃烧实验与模拟研究,总结了反应炉膛内H2S 部分氧化的反应机理以及气体产物生成的影响因素。Colom 等[13]在高压下进行了H2S 氧化实验,考察了氧气浓度、温度与气体停留时间对H2S 氧化的影响;同时还研究了H2S/CH4在不同压力下的氧化过程,发现随着压力升高,CH4对H2S 氧化的影响逐渐变小[14]。Bongartz 等[15]优化了H2S/CH4动力学模型,研究了O2浓度对层流火焰的影响,准确预测了层流火焰传播速度及产物浓度。Bernez-Cambot 等[16]研究了克劳斯工艺中H2S的火焰结构,阐述了火焰各区域的主要反应与相关产物。Selim等[17]在不同H2S与O2的体积比(0.5,1.5 和3.0)下,对H2S 在CH4-空气火焰中的氧化过程进行了实验研究,发现CS2主要由CH4和硫化物反应生成。Ibrahim 等[18]考察了二甲苯添加量对H2S 火焰的影响,发现二甲苯的存在导致了COS,CS2以及CO 的形成。Abián 等[19]对COS 和CS2的生成过程开展了实验和模拟研究,结果表明COS,CS2和CO 的生成、分解过程与SO2和CO2密切相关。然而,目前H2S 与CH4的氧化过程大都在管式炉中进行,这种完全混合且电加热下的恒温燃烧与克劳斯炉膛的实际燃烧环境相差甚远,而且有关富燃料扩散火焰中CH4对高H2S 含量的酸性气体氧化过程的影响研究还十分缺乏,在国内的相关研究近乎空白。
本研究以H2S,CH4,N2和O2为原料,采用小型射流反应器,对富燃料条件下的非预混燃烧过程进行实验研究,通过测量不同实验条件下中心轴向不同位置火焰温度以及反应器出口的组成,对H2S 氧化和CH4转化过程,以及COS 和CS2生成与转化的途径进行分析,探究富燃料条件、不同组分比例下H2S 与CH4的竞争氧化机理。
1 实验部分
1.1 实验装置
图1 为燃烧实验装置流程示意,系统主要由流量阀、射流燃烧反应器、硫磺回收系统、竖直电机导轨、分析系统等构成。射流燃烧反应器结构如图2 所示,材质为铬镍不锈钢(0Cr18Ni9),外侧包裹35 mm 厚的细石英棉层用以隔热,在反应器底部中心安装了一个同轴双通道烧嘴,烧嘴中心通道上端设有环形钝体,促进燃气与空气的混合,保证火焰稳定。

图1 实验装置流程示意Fig.1 Schematic diagram of experimental setup

图2 射流燃烧反应器示意Fig.2 Schematic diagram of the jet combustion reactor
所有气体流量均由流量阀计量控制。为获得燃烧反应器的中心轴向温度及气体组分浓度分布,搭建了移动测温及采样装置。利用位置校准器确定中心轴向后,预设程序控制电机转动,带动导轨上的移动模块上下移动,由此带动热电偶或石英管进行测温或采样。利用悬停在火焰上方的K 型热电偶检测火焰温度,当温度波动小于3 K 时即认为燃烧已达稳定,温度测量数据由温度显示器采集。各采样点的高温气体在泵的作用下,以5 mL/s 的恒定速率通过细石英管(内径为2.2 mm,外径为4 mm)抽取;先在一段石英管中强制风冷,再于冰水中进一步水冷,此时气态硫磺逐渐冷凝并被极细石英棉过滤分离;而后气样经变色硅胶瓶干燥并通过三通管进入真空气袋,完成气样的采集与制作;测样时,使用针筒从气袋中抽取微量气样打入气相色谱仪(瑞敏GC-2060)分析。热导检测器(TCD)与火焰光度检测器(FPD)(色谱柱GDX-303 型)串联后用以检测含硫物质的浓度,色谱柱在60 ℃保持2.5 min,而后在升温程序下温度以8 ℃/min 的速率升高到130 ℃并保持,直到检测完所有含硫物质。TCD 与氢火焰离子化检测器(FID)(色谱柱Parapak Qs 型)串联测定非硫组分的浓度,TCD 和FID之间为装有活性镍催化剂的转化器,助于精准测量CO 和CO2的浓度,色谱柱温度为60 ℃,催化炉的温度为320 ℃。
1.2 实验条件
在克劳斯硫回收过程的反应炉膛中,CH4需作为助燃剂保持炉温:
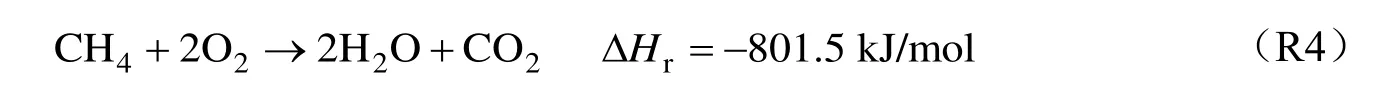
根据化学反应计量式,理论上当O2与H2S 的体积比为0.5 的克劳斯工况下H2S 部分氧化,O2与CH4的体积比为2 的条件下完全燃烧,事实上两者会发生竞争氧化行为,共同进行部分燃烧。因此,本研究的富燃料条件指的是H2S/CH4在上述条件下的不完全燃烧,供氧流量()由下式决定:

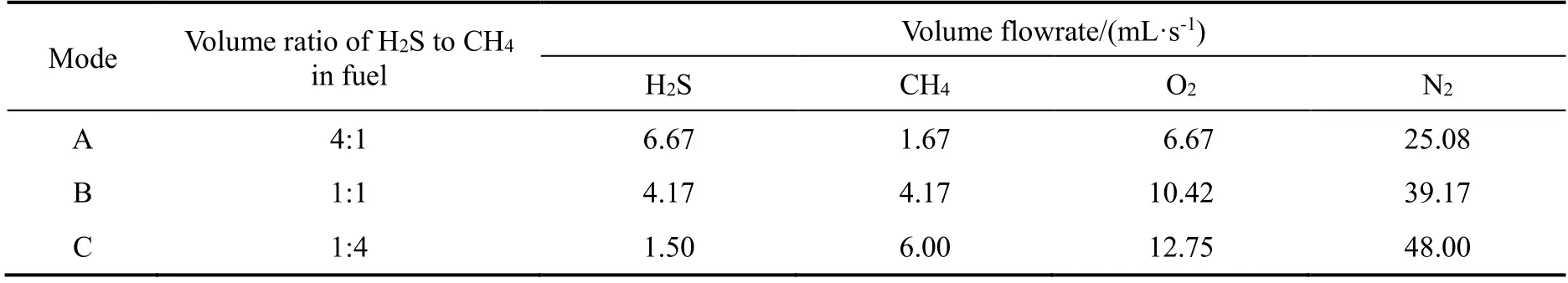
表1 实验条件Table 1 Experimental Condition
由于装置出口截面积较小,当烧嘴内外通道的气体总流量过大时,会导致反应器出现轻微震动,火焰难以稳定,因此为了使工况C 能稳定燃烧,将燃料流量略调整为7.5 mL/s,其余工况燃料流量为8.34 mL/s。
为了使实验结果具有较强的普适性,定义了无量纲轴向距离(D):D=X/DF,其中DF为烧嘴中心通道内径,mm;X为烧嘴端面到反应器出口的轴向距离(X=0 为烧嘴端面),mm。测量温度时,热电偶初始位置在烧嘴出口上方2 mm 处。测量浓度时,石英取样管初始位置在烧嘴端面,采样的步距为15 mm。
2 结果和讨论
2.1 轴向温度分布
图3 给出了三种工况下火焰温度随轴向距离的分布。由图3 可见,各工况的温度分布趋势相似,呈现出明显的扩散火焰特征。在烧嘴出口位置,H2S/CH4与O2几乎未接触,但温度仍然较高,这是外焰加热所致;随轴向距离的增加,各位置的温度不断升高,直至在火焰尖端(D≈9)处温度达到顶峰,此时H2S/CH4与O2充分接触,氧化反应最为剧烈。由于CH4的燃烧热高于H2S 的燃烧热,因此工况C 的轴向温度相应较高,此外,工况C 的空气流量大于工况A 和B,且在烧嘴钝体的作用下使气流产生更强烈的径向扰动,致使燃料与空气之间反应更为剧烈,工况A,B 和C 的峰值温度依次为705.75,910.75 和974.55 K。峰值之后的温度几乎呈线性下降,此时由空气流量较大带来的稀释效应也体现了出来:对于工况C,温度峰值与反应器末端的温差约为280 K,而流量最小的工况A 温差约为200 K。热损失形式主要为与较低温度气体的热对流和与壁面的热辐射。
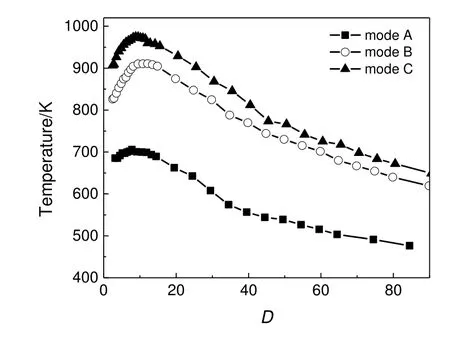
图3 火焰温度随轴向距离的分布Fig.3 Axial distributions of measured flame temperature
2.2 H2S/CH4 和燃烧产物轴向分布
H2S,SO2和H2的浓度随D的变化见图4~图6,D=0 为烧嘴端口位置,其浓度即为各工况下的初始浓度。由图4 可见,三种工况下的H2S 变化趋势相似,D<3.3 时体积分数快速衰减,D>3.3 时衰减平缓,分别为快速转化区和温和转化区。结合图5 和图6 可知,在快速转化区SO2几乎未生成,仅产生少量H2,可推测此区域H2S 主要发生部分氧化反应,生成大量的S2和H2O[9,20],见式(R5);此外,H2S还可与O 和OH 等活性自由基部分氧化为SH,SH进一步氧化为SO,见式(R6)~式(R8)[17,21-22],相关反应进行程度取决于氧化自由基的浓度大小[23]。
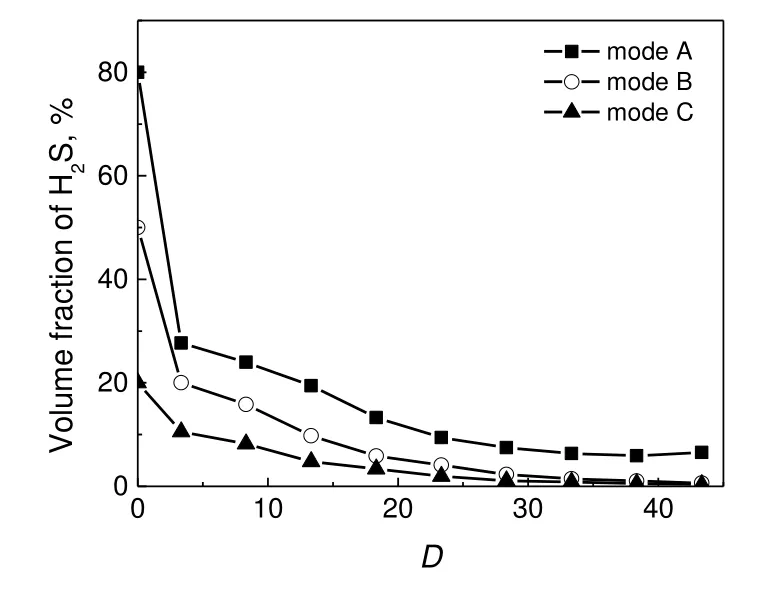
图4 H2S 浓度的轴向分布Fig.4 Axial distributions of H2S concentration

图5 SO2 浓度的轴向分布Fig.5 Axial distributions of SO2 concentration
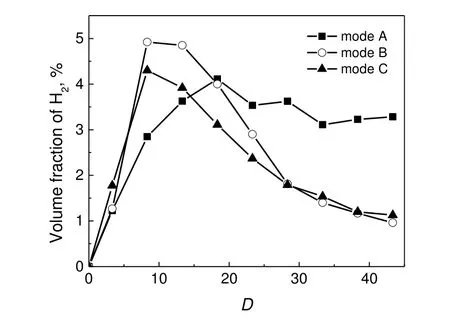
图6 H2 浓度的轴向分布Fig.6 Axial distributions of H2 concentration

在温和转化区,由于外焰的加热以及燃气与空气的充分接触,H2S 主要发生完全氧化反应,产物以SO2为主。由图5 可见,在工况B 和工况C,D>3.3 时SO2开始生成,于D>9 时大量存在,此时许多部分氧化的自由基(如SO,HSO)会进一步氧化,生成SO2,其基元反应见式(R9)~式(R11)[9]。此外,H2S 在高温下除了发生氧化反应,还存在一部分与中间物(M)的反应,主要生成H2和S,见式(R12)~式(R13),导致H2体积分数快速增加[21,24]。

在H2S 的氧化过程中也存在CH4的燃烧反应,在本实验工况下,不可能按化学计量比使CH4全部氧化成CO2和H2O,同时使1/3 的H2S 氧化成SO2,H2S 和CH4之间一定存在氧化竞争。根据反应器初末端测得的H2S 浓度来看,各工况下H2S 最终转化率都超过80%。由图5 可以看到,三种工况下的SO2含量均随反应器长度呈近似“S”型增加,工况C 在D<9 时SO2以较快速度生成,直到下游的SO2含量达到最大值约2.05%;对于工况B,SO2的体积分数在D为35 时到达峰值,约为4.34%,几乎两倍于其余工况,这可能是因为H2S、CH4与空气流量均适中,反应更利于SO2的生成;工况A的O2供给量相对较少,完全氧化反应发生时的距离较远,因此SO2于D<15 时几乎未被测出。在反应器末端SO2浓度几乎保持稳定或略有下降,可能是发生了克劳斯反应,见式(R2),或与H 反应转化为SO 与HSO 自由基,见式(R14)~式(R15)[12]。

Selim 等[17]在接近化学计量的工况下(CH4和O2的体积比为0.5)向CH4-空气火焰中添加少量H2S(H2S 体积占比为0.04~0.1),结果在反应器中下游测出大量的SO2,这与本实验结论一致。本实验为富燃料燃烧,结合图5 中D<9 时的SO2浓度较低,可以推测,在富燃料条件下H2S/CH4燃烧过程中SO2的生成速率与供氧量密切相关,在靠近烧嘴处由于H2S 与O2尚未完全反应,几乎不会产生SO2。
如图6 所示,三种工况下H2体积分数沿轴向距离分布相似,均在温度峰值区域有大量H2生成,并在反应器末端有所消耗。除H2S 与M 反应贡献一部分H2外,CH4也可通过分解和部分氧化产生H2,见式(R16)~式(R18)[25]。至于工况A 反应器中后段的H2浓度仍较高,是因为供氧量太少不足以充分氧化H2,而且H2S/CH4既分解产生H2,又因氧化反应消耗O2,会对H2氧化起抑制作用。

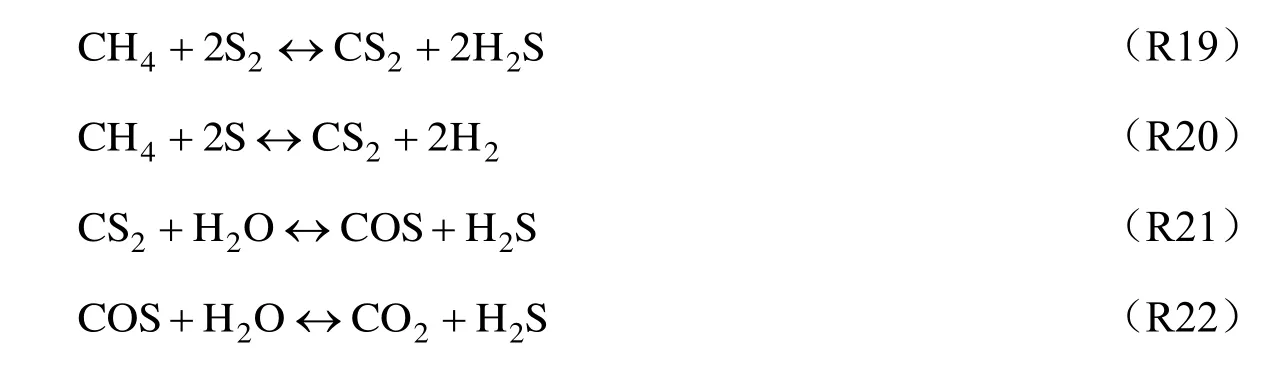
为了分析H2S 和CH4在氧化过程中的关系,测定了CH4,CO 和CO2沿轴向距离的浓度分布,结果见图7~图9。由图7 可见,对于工况C,CH4的浓度在高温区内快速衰减,包括CH4的热分解、氧化反应及与H2S 的相互作用。当燃料流股中H2S 含量增加时,在H2S 快速转化区CH4的转化速率明显变慢,特别是工况A,CH4浓度在烧嘴附近甚至略有提高,表明在富燃料条件下CH4的氧化能力弱于H2S,这也可在图8 中工况A 的最低CO 浓度所印证。从反应器初末端测得的CH4浓度来看,三种工况下CH4的出口转化率均很高,分别为97.44%,98.36%和83.60%,然而,三种工况下的O2流量相差很大,其中工况A 与工况C 相差近一倍,这说明CH4转化率受供氧量的影响较小,这与Li 等[9]的结论一致。Clark 等[20]关于H2S/CH4部分氧化的研究提出,首先是H2S 的部分氧化占主导,生成的S2与CH4继续反应会产生CS2,后续还产生COS 和H2S,见式(R19)~式(R22)。H2S 能通过上述反应再次生成,这与下游区域H2S 含量的略有增加十分吻合。
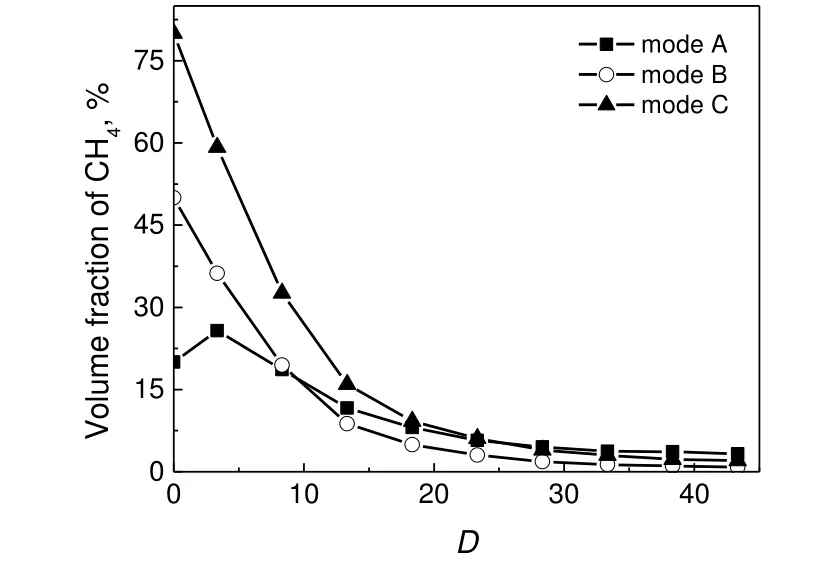
图7 CH4 浓度的轴向分布Fig.7 Axial distributions of CH4 concentration
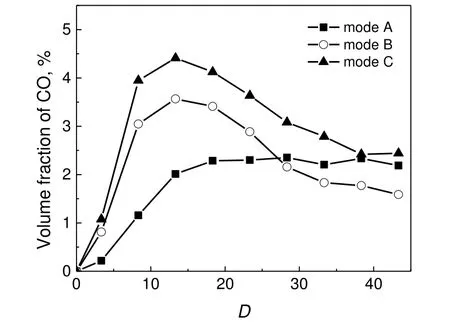
图8 CO 随轴向距离的浓度分布Fig.8 Axial distributions of CO concentration
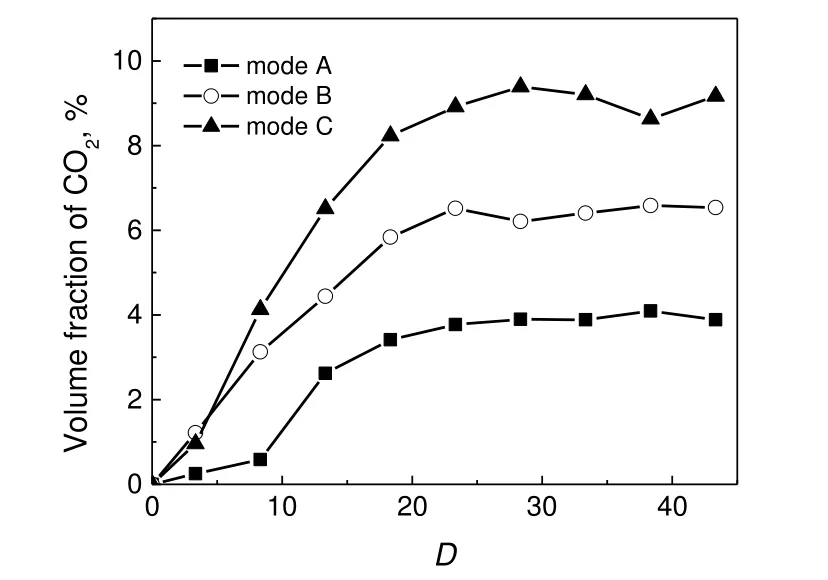
图9 CO2 随轴向距离的浓度分布Fig.9 Axial distributions of CO2 concentration
由图8 可见,CO 的浓度变化趋势与H2相似,均先单调增加到最大值,之后略有衰减或几乎保持不变,这主要取决于供氧量的大小,在拥有高供氧量的工况B 和工况C 中,CO 会在反应器中后端被继续氧化,导致CO 浓度降低。生成CO 的反应主要有CH4的部分氧化和水蒸气重整反应,而燃烧过程高温区的CO 形成常用水煤气转变反应来解释,见式(R23)。

从图9 可以发现,CO2的生成量随CH4在燃料中的比例增加而增加,同时在达到峰值后表现出较低的反应活性。对于工况C,距喷嘴最近的测量点D为3.3 处CO2的浓度仅为0.96%,这进一步证实在富燃料条件下CH4与H2S 氧化能力的差异。
图10 给出了以C2H4为代表的高碳氢类物质沿轴向距离的浓度分布。C2H4的分布曲线与CO 和CO2的分布曲线较为相似。对于工况A,几乎可以忽略整个纵向范围内的C2H4浓度。C2H4的形成与C2H6脱氢反应或其它较小烃类自由基(CH,CH2和CH3等)的结合有关,这在富燃料条件下的CH4氧化反应中极为常见。此外,由于SO2的偶合催化作用,会导致较小烃类自由基加速偶合成高碳氢类物质,因此认为CH3在形成C2H6的二聚反应中的活性有较大促进作用[17]。但本次实验并没有发现碳氢化合物与SO2浓度有何种紧密关系。工况B 曲线显示,C2H4的浓度变化与高SO2浓度关联不大,SO2的偶合催化作用极弱,说明C2H4的形成或许存在其他途径。
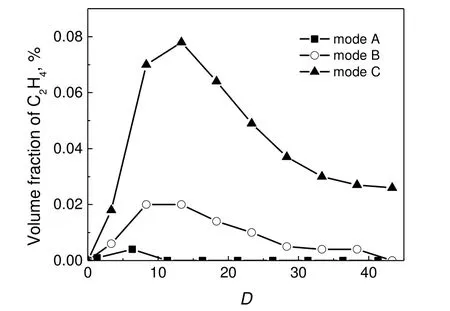
图10 C2H4 随轴向距离的浓度分布Fig.10 Axial distributions of C2H4 concentration
图11 分别给出了CS2和COS 沿反应器中心轴向距离的浓度分布。

图11 主要组分随轴向距离的浓度分布Fig.11 Axial distributions of the major components
由图11 可见,CS2与CO 分布较为相似,三种工况在燃烧器出口都可以观察到CS2,这主要来自CH4和硫化物的反应,见式(R19)~式(R20),少量来自CH4和H2S 的直接反应,见式(R24)[26]。

CS2的形成比较复杂,受CH4、H2S 和硫化物浓度的综合影响,从动力学角度看,氧化环境不利于CS2的形成,因为上述物质更易生成CO,OH 和SH 等自由基。在工况B 下,CS2的浓度在烧嘴附近增长最快,并在达到最大值3.55%后于反应器末端迅速下降,而在其他两种条件下,CS2含量相对稳定,尤其是在供氧量最少的工况A 中,CO,H2和CS2在下游区域均保持较高浓度,可见CS2的消耗主要是由氧化作用引起的[27-28]。CS2的初级氧化包括CS 和SO 的形成,见式(R25),O 被视为这种氧化过程的重要自由基[29]。在克劳斯条件下应更重视CH 和S 在CS2形成过程中的作用,其中CS2的浓度会比按化学计量的反应高出近一个数量级[30]。在O2存在的情况下,CS 会在三个可能的反应中被进一步氧化,见式(R26)~式(R28),反应程度主要取决于供氧量大小[30-31]。考虑到CH4氧化会形成大量的CO 和CO2,后两种反应可能会受到抑制,见式(R27)和式(R28)。此外,CS2可以被OH 和其他自由基氧化,见式(R29)和式(R30),此时COS 更易成为CS2氧化的主要产物[19]。

从图11(b)中可见,各工况下的COS 浓度在D<3.3 时基本一致,说明COS 的生成对O2并不敏感。总体上COS 的浓度分布呈现先增后减的态势,但COS 的生成速度和浓度要低于CS2。COS 的生成主要由前驱体CO 与含硫物质的反应,见式(R31)~式(R34),但本实验仅有少量CO 检出。根据Clark 等关于COS 生成的研究[32],COS 可通过CO2与H2S 在缺氧区的反应生成,见式(R35)。实际上,在合适温度下COS 会发生加氢还原反应转化为CO 和H2S,见式(R36),其浓度亦会因H2存在而减少。综上可以得出结论,由于CH4在与H2S 的氧化竞争中处于劣势,仅能产生少量CO 和CO2,而H2S 分解会产生大量H2,因此在H2S/CH4火焰底部也很难产成COS。CO 和CO2可能会一直存在于反应器,并最终成为尾气排出,这从图8 和图9 中相应浓度分布可以印证。

在下游COS 浓度出现明显衰减,其衰减速率与供氧量呈正相关。从图11(b)工况A 的浓度曲线可以看到,最末检测点(D=43.3)的COS 浓度仅为0.29%,近乎消耗殆尽。与CS2相似,COS 的消耗形式同样为氧化反应,相关反应见式(R37)~式(R39)[19]。实际克劳斯硫回收过程中,虽CH4的浓度远低于本研究的情况,但是在火焰区可能会产生CS2与COS,形成污染物。因此提高O2浓度、选择合适当量比等方法强化燃烧区的氧化过程,是减少尾气中COS 和CS2的关键步骤。

综上,因CS2与COS 主要来自CH4与硫化物之间的反应以及后续反应,见式(R19)~式(R21)[26],而CO 与CO2来自CH4的氧化反应。从图11 中D为3.3 位置处可得,工况B 下CS2与COS 的浓度分别为1.57%和0.84%,分别高于同位置CO 与CO2的浓度,即CH4与硫化物的产物浓度高于与O2的产物浓度,且在工况A 下CO、CO2的浓度与CS2、COS 的浓度差异更为明显。由此可推测,富燃料条件下CH4与S2在烧嘴附近的反应速率可能快于O2。
3 结论
通过H2S/CH4的空气扩散火焰实验,研究了富燃料条件下CH4对H2S 氧化反应以及COS 和CS2生成的影响,测量了射流反应器轴向温度和燃烧产物浓度分布,讨论了各组分的生成规律与反应途径。结论如下:
a)三种工况均呈现扩散火焰特征,燃料流中CH4占比越大,反应器中心轴向各点的燃烧温度越高,同时因空气流量较高而造成的稀释效应凸显,导致温度峰值与反应器末端温差更大。
b)在烧嘴附近(D<3.3),燃料与O2混合尚不充分,H2S 与CH4主要发生部分氧化反应,并存在竞争关系。其中,H2S 在与CH4的竞争氧化中处于优势,产物有S2、H2O 和少量H2等;CH4还涉及与S2之间的反应,通过生成产物分析,其反应速率可能会快于O2,此时CO 和CO2的生成受到抑制。在温度峰值区域(D≈9),H2,CO 与C2H4的生成速率明显加快。在反应器中下游(9<D<38.3),随着混合更加充分,SO2开始大量生成,其生成速率对O2浓度十分敏感;此外,H2,CO 与C2H4会被氧化消耗,消耗速率与供氧量有关。在反应器末端(D>38.3),H2S 浓度因CH4与硫化物的反应及CS2与COS 的后续反应而出现回升。从反应器初末端浓度来看,CH4的转化率受供氧量影响不大。
c)CS2主要来源于CH4与含硫自由基的反应,并于烧嘴附近迅速出现;COS 则主要来自CO 与含硫物质的反应,然而,在烧嘴附近CO 的生成受到抑制,其生成速率与浓度极小。此外,COS 也可成为CS2的氧化产物,且CS2和COS 的消耗形式均为氧化反应,因此在工业上通过提高O2浓度、选择合适当量比等方法,能减少CS2和COS 等副产物的生成。
——人-时间资料率比分析与SAS实现

