Sp1特异性调控先天性心脏病相关基因钙调磷酸酶调节蛋白1基因亚型的转录
李晓勇, 宋来春, 陶 超, 金 晶, 许 铭
(武汉科技大学附属武汉亚洲心脏病医院 心外科 职业危害识别与控制湖北省重点实验室, 湖北 武汉 430022)
先天性心脏病 (congenital heart disease, CHD) 占儿童出生缺陷率的首位,发病率高,危害大,其病因仍然不明[1]。近期研究表明,基因异常在其发病机制中起重要作用。唐氏综合征是最常见的导致CHD的遗传性疾病,其21号染色体上的钙调磷酸酶调节蛋白1基因(regulator of calcineurin 1, RCAN1)被证明是先天性心脏缺陷相关的致病基因[2-3]。RCAN1主要有2个亚型,RCAN1-1主要在中枢神经系统表达,RCAN1-4主要在心肌、胎儿肾脏中表达,这种组织特异性表达的机制不清[4]。因此本课题拟从转录调控入手,研究RCAN1基因不同亚型的启动子区转录因子结合位点的差异,探索其在人体内特异性表达的机制。
1 材料与方法
1.1 材料
RCAN1基因及其上游的序列参照RefSeq (NG-007071.1) 以及UCSC、LOVD、千人基因组计划等数据库。定点突变试剂盒(KOD-Plus-Mutagenesis Kit, TOYOBO公司)。荧光素酶报告基因检测试剂盒 (Dual-Luciferase Reporter Assay System, Promega公司)。荧光定量PCR试剂盒 (GoTaq qPCR Master Mix, Promega公司)。光辉霉素(18378-89-7,Amresco公司)。RNA提取试剂盒(北京天根生化科技有限公司)。
1.2 方法
1.2.1 分子克隆及定点突变: RCAN1-1和RCAN1-4分别通过两个不同的启动子来转录,两个启动子区分别位于第1和第4外显子的上游。在TRANSFAC数据库中通过在线生物信息学软件AliBaba 2.1预测两个启动子区所有可能的转录因子结合位点(http://www.gene-regulation.com),结合既往文献报道及物种属性(只在人体内表达),再对比分析两个启动子区的差别,初步筛选出一个具有差异性的候选转录因子结合位点:Sp1,位于第1外显子上游-129至-138碱基位置,符合Sp1经典结构nyCCGCCsmC。
本课题组前期已克隆出RCAN1的两个启动子[5]。通过限制性内切酶MluⅠ和XhoⅠ将RCAN1-1启动子区-498-+153克隆至pGL3-basic载体中荧光素酶报告基因的上游,构建质粒pRCAN1-Luc-1,通过RCAN1-1启动子启动荧光素酶基因的表达。同样的方法将RCAN1-4启动子区-1 059至-28构建质粒pRCAN1-Luc-4。设计突变引物(表1),pRCAN1-Luc-1作为模板,分别定点突变筛选出Sp1结合位点的关键碱基,构建一系列突变质粒。PCR条件同说明书。通过测序验证突变体。将pRCAN1-Luc-1和7个突变体分别转染到HEK293T 细胞中,孵育24 h后裂解,检测荧光素酶活性来间接测定启动子活性。

表1 突变引物
1.2.2 荧光定量PCR检测RCNA1 mRNA: 进一步研究转录因子Sp1是否特异性调控RCNA1-1亚型的转录。本课题组前期已经构建了包含启动子区的RCAN1-1和RCAN1-4表达载体:pCMV-RCAN1-1和pCMV-RCAN1-4质粒[6],将质粒转染到心肌细胞细胞系H9c2内,实验组加Sp1抑制剂(mithramycin A,光辉霉素),对照组加溶剂PBS,培养24~48 h后,提取总RNA,并反转录为DNA。通过荧光定量PCR定量检测两个亚型的mRNA的量。简要步骤如下:引物参照前期结果[6]。反应体系(20 μL)包含:GoTag qPCR Master Mix(×2)10 μL,引物(10 μmol/L)各0.4 μL,DNA 3 μL,双蒸水6.2 μL。扩增条件:Stage1:95 ℃ 10 min,1个循环。Stage2:95 ℃ 15 s;60 ℃ 1 min,40个循环。Stage3:溶解曲线。每个样品都做3个平行孔。通过标准曲线的绘制得到的RCAN1和β-actin的扩增效率分别为94.2%与96%, 最后实验结果用2-ΔΔCt法进行相对定量。
1.3 统计学分析
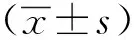
2 结果
2.1 转录因子结合位点活性
分别突变单个碱基都可导致启动子区活性明显降低(P<0.001),初步证明筛选出的Sp1结合位点是有功能的且每个碱基都是不可或缺的(图1)。构建一个Sp1突变体,将此突变体和对照(pRCAN1-Luc-1)分别转染不同的细胞系,结果显示启动子活性均有显著下降(均P<0.001),进一步证明该转录因子结合位点是有活性和功能的(图2)。

*P<0.001 compared with control group图1 单个碱基突变均使启动子活性下降Fig 1 Single base mutation decreased the promoter
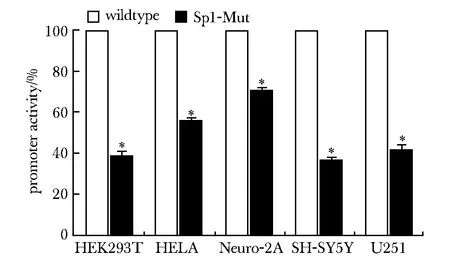
*P<0.001 compared with control group图2 在不同的细胞系中都可见Sp1突变使启动子活性下降Fig 2 Mutation of Sp1 decreased promoter activity in different cell
2.2 Sp1对RCAN1转录的调控
实验组RCAN1-1 mRNA 表达量低于对照组(P<0.001),而两组RCAN1-4 mRNA 的表达量无差异(图3)。

*P<0.001 compared with control group图3 实验组RCAN1-1的表达量明显降低,而RCAN1-4无差别Fig 3 RCAN1-1 decreased in experimental group; RCAN1-4 showed no
3 讨论
先天性心脏病(CHD)发病率在活产婴儿中占0.93%,占出生畸形的40.95%,其不仅发病率高,且严重危害健康,给家庭和社会造成了巨大的影响[7]。然而,CHD的发病机制仍然不明,目前研究表明基因异常是其重要的致病因素[1, 8]。
唐氏综合征是最常见的染色体病之一,其突出的临床表现就是智力缺陷和先天性心脏畸形[9]。唐氏综合征在21号染色体上的关键致病区域(down syndrome critical region, DSCR)已经被确定,而DSCR1(2007年被更名为RCAN1)是该区域上最最重要的致病基因之一[9]。RCAN1是最可能的导致唐氏综合征患者出现先天性心脏畸形的候选基因[9]。胚胎学实验表明RCAN1在心管形成时就有表达,心脏发育过程中在动脉干、心球及原始室间隔等组织中集中高表达[10],而这些部位的分化及形成异常构成了绝大多数先天性心脏病发病的胚胎学基础。NF-ATc (nuclear factor of activated T cells) 在心脏间隔及瓣膜的发育形成中的作用是必不可少的[11]。RCAN1直接抑制钙调蛋白磷酸酶,而后者通过对NF-ATc脱磷酸化而促进其表达。因此RCAN1过度表达对NF-ATc起间接抑制作用,可能是导致心脏间隔发育异常的原因。
RCAN1在人体内有很强的组织表达特异性[3,12]。根据生物学能量最低原则,转录调控是基因表达调控的核心,而启动子又是转录调控的主要原件。目前已证明RCAN1-1和RCAN1-4分别由不同的启动子启动转录[3-4,9]。两个启动子区域都有很多潜在的转录因子结合位点,但是真正起主要作用的位点及与其结合的转录因子仍未完全阐明。本研究通过系统分析两个启动子区域,鉴定出一个之前未报到过的有活性的转录因子结合位点及相应的转录因子,初步证明其可能与RCAN1的组织特异性表达相关。本研究的主要局限是以体外实验为主,所用心肌细胞只是提供质粒表达的环境。进一步的动物或人体实验,检测Sp1在不同组织中的表达差异,能够更充分地证明Sp1对RCAN1表达的特异性调节作用。总之,本研究新发现的Sp1位点有可能作为将来CHD基因筛查或治疗的潜在靶点,为探索RCAN1在CHD发病机制中的作用提供理论基础。

