长链非编码RNA MCM3AP-AS1靶向调控miR-876-5p促进人结直肠癌细胞系的增殖和迁移
周堤侠,吕海栋
(青海省人民医院 肿瘤外科,青海 西宁 810007)
结直肠癌(colorectal cancer, CRC)是世界范围内常见的消化道肿瘤之一,其发病率仅次于肺癌、胃癌,居于恶性肿瘤第3位;其病死率在癌引起的死亡病例中居于第4位[1]。在CRC的临床治疗中,常用的有手术治疗、化学治疗、放射治疗、靶向药物治疗4种治疗策略,而目前手术治疗作为CRC的主要治疗方法。但是由于缺乏有效的早期诊断方法,80%的CRC患者就诊时已属中晚期,造成术后的复发风险升高或者失去手术的机会,进而超成患者的不良预后[2]。在CRC的进展中,多种基因、RNA和蛋白的表达异常,这些分子有望成为CRC的早期诊断标志物以及复发转移的治疗靶点。
长链非编码RNA(long non-coding RNA, LncRNA)是一组长度超过200 bp不具备完整蛋白编码功能、缺少特异开放阅读框的RNA,已经有大量的研究表明lncRNAs可以影响多种肿瘤的进展[3]。LncRNA antisense 1 to micro-chromosome maintenance protein 3-associated protein(MCM3AP-AS1)基因位于21号染色体上,近年来有研究报道,MCM3AP-AS1在成胶质瘤细胞瘤和肝癌的进展中发挥了重要作用[4-5]。与lncRNA同属于非编码RNA的microRNAs(miRNAs),它是一种具有高度保守序列的非编码微小RNA分子。miRNAs参与调控一系列生理过程,包括细胞增殖、分化、凋亡、信号传导和器官发育等[6]。据研究,miR-876是由人类染色体9p21.1转录的前体RNA剪切而来,它在乳腺癌[7]、胃癌[8]的进展中发挥了重要作用。然而,目前关于MCM3AP-AS1和miR-876-5p的表达与CRC关系的研究较少,因此,本研究拟检测MCM3AP-AS1在CRC组织和细胞中的表达水平,并利用CRC细胞系HCT-116细胞为研究对象,探讨其对HCT-116细胞增殖、迁移的作用及对miR-876-5p的调控机制,以期为临床上诊断和治疗CRC提供新的理论依据。
1 材料与方法
1.1 材料
1.1.1 组织收集:选取2017年5月至2018年5月青海省人民医院收治的30例CRC患者的癌组织及相应癌旁组织标本(收集的癌旁组织标本距离手术切缘至少3 cm),且癌旁组织标本术后经病理检查未发现癌细胞。所有标本取下后立即储存在-196 ℃液氮中直到用于提取RNA和其他实验。所有研究对象术前均未接受化疗、放疗等辅助治疗。本研究获得青海省人民医院医学伦理委员会批准(文号:2017-50),所有参与患者的知情同意。
1.1.2 试剂:人正常结肠细胞系NCM460和结直肠癌细胞系(colorectal cancer cell lines)SW620、HT-29、HCT-8和HCT-116 (中国科学院上海生命科学院细胞资源中心);DMEM培养基(Thermo Fisher Scientific公司);LipofectamineTM3000、Trizol试剂(Invitrogen 公司);miR-876-5p模拟物 (miR-876-5p mimics)、miR-876-5p抑制剂(miR-876-5p inhibitors)、MCM3AP-AS1过表达质粒、靶向MCM3AP-AS1的shRNA以及相应的阴性对照物(中国广州RiboBio公司);SYBR预混剂EX TAQ Ⅱ(TaKaRa公司);ABI 7500实时PCR系统(美国应用生物系统公司);荧光素酶报告基因系统(Promega公司)。
1.2 方法
1.2.1 细胞培养及转染:在37 ℃、5% CO2、饱和湿度的培养箱中,用含10%胎牛血清的DMEM培养基常规培养上述细胞。取对数增殖期的HCT-116细胞,以5×106个/cm2在转染前1 d接种于6孔板,保证转染时细胞汇合度达到50%以上。转染操作严格按照LipofectamineTM3000试剂盒说明书将过表达MCM3AP-AS1的质粒、靶向MCM3AP-AS1的shRNA、miR-876-5p模拟物(miR-876-5p mimics)转染HCT-116细胞。
1.2.2 qRT-qPCR检测细胞和组织中mRNA的表达:根据各基因在GenBank中的序列号,用Primer6.0软件设计引物。使用Trizol提取总RNA,用MMLV反转录酶进行反转录,产生第一链cDNA。在ABI 7500实时PCR系统上,用SYBR预混剂EX TAQ Ⅱ按照制造商的说明进行PCR。以GAPDH作为MCM3AP-AS1的标准化内参,U6作为miR-876-5p的标准化内参,基因表达的结果采用2-ΔΔCt方法进行计算。引物序列见表1。

表1 引物序列Table 1 Primer sequence
1.2.3 MTT法测定细胞增殖:取对数期生长期的HCT-116细胞,在96孔板中加入100 μL细胞(约4×103个/孔),于37 ℃、5% CO2的饱和湿度培养箱内培养24 h后,每组设置5个复孔,继续培养24 h后加入50 μL MTT(5 g/L),在37 ℃孵育4 h后吸出上清液,每孔加入150 μL DMSO,用平板摇床摇匀,待结晶溶解后用酶标仪在490 nm波长处检测每孔的吸光度值。
1.2.4 划痕愈合实验检测细胞迁移:按照5×106个/孔细胞数将HCT-116细胞接种于6孔板中,当HCT-116细胞汇合时,用无菌200 μL管尖垂直划线,在汇合的单层中间形成一个直接的划痕。然后,用无血清培养基温和清洗划痕损伤细胞单层3次。在完整的培养基中愈合。划痕形成后0 和24 h,拍摄并计算显微镜下的划痕宽度。通过确定闭合百分比来评估细胞迁移。每个实验重复3次,测量3次。
1.2.5 Transwell小室法检测细胞迁移:取2×104个/孔加入Transwell上室,下室中加600 μL的含20%FBS的培养液,37 ℃培养。12 h后去除上室细胞,4%多聚甲醛固定,0.1%的结晶紫染色,晾干后拍照并计数。
1.2.6 荧光素酶实验:野生型MCM3AP-AS1及突变型MCM3AP-AS1的目的片段被构建并整合入pGL3 vector以构建pGL3-MCM3AP-AS1-wild type (MCM3AP-AS1-wt)和pGL3-MCM3AP-AS1-mutant (MCM3AP-AS1-mut)报告载体。然后将细胞接种于24孔板上,每孔1×105个细胞。并用LipofectamineTM3000将miR-876-5p mimics或阴性对照物分别与MCM3AP-AS1-wt或MCM3AP-AS1-mut报告载体转染HCT-116细胞。转染48 h后测定荧光素酶活性。每组实验重复3次。
1.3 统计学分析
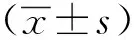
2 结果
2.1 MCM3AP-AS1在CRC中表达上调
与对照组相比,CRC组织和细胞系中MCM3AP-AS1表达水平显著上调(P<0.001)(图1A,B)。而且MCM3AP-AS1的表达上调与CRC患者的无病生存期(diease free survival, DFS)呈负相关(图1C)。
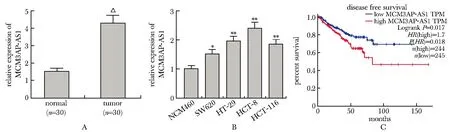
A,B.LncRNA MCM3AP-AS1 expression in CRC tissue and cells; C.survival analysis for MCM3AP-AS1 expression and diease free survival of patients with CRC; △P<0.001 compared with normal;*P<0.01, **P<0.001 compared with NCM460
2.2 敲低MCM3AP-AS1抑制CRC的增殖和迁移能力
sh-MCM3AP-AS1成功转染HCT-116细胞(图2A)。与sh-NC组相比,敲低MCM3AP-AS1后,HCT-116细胞的增殖能力降低,划痕愈合能力降低,迁移细胞数减少(图2B~D)。
2.3 MCM3AP-AS1靶向miR-876-5p
miR-876-5p是MCM3AP-AS1的候选靶点之一(图3A)。此外,miR-876-5p mimics可抑制MCM3AP-wt组的荧光素酶报告体的荧光素酶活性,而对MCM3AP-mut组的荧光素酶活性无显著影响(图3B)。CRC组织和细胞系中miR-876-5p的表达均显著下调(图3C,D)。miR-876-5p与MCM3AP-AS1呈负相关(图3E)。而且敲低MCM3AP-AS1可促进miR-876-5p的表达(图3F)。
2.4 miR-876-5p mimics抑制CRC细胞的增殖和迁移
miR-876-5p mimics成功转染HCT-116细胞系(图4A)。与miR-control组相比,转染miR-876-5p mimics后,HCT-116细胞的增殖和迁移能力均受到抑制(图4B~D)。
2.5 MCM3AP-AS1+ miR-876-5p对CRC细胞的增殖和迁移
过表达MCM3AP-AS1+miR-876-5p mimics成功转染HCT-116细胞(图5A,B)。与NC组相比,MCM3AP-AS1可促进细胞的增殖和迁移。而转染miR-876-5p mimics可削弱MCM3AP-AS1对细胞增殖和迁移的促进作用(图5C~E)。

A.HCT-116 cells were transfected with sh-MCM3AP-AS1;B-D.tThe effects of sh-MCM3AP-AS1 on HCT-116 cells proliferation and migration; *P<0.05, **P<0.01, ***P<0.001 compared with sh-NC

A.binding sites of MCM3AP-AS1 and miR-876-5p;B.double luciferase report assay, *P<0.001 compared with miR-control;C,D.miR expression in CRC tissue and cells;#P<0.001 compared with normal;*P<0.05, **P<0.01, ***P<0.001 compared with NCM460;E.correlation between MCM3AP-AS1 and miR-876-5p expression; F.the effect of MCM3AP-AS1 on miR-876-5p expression; △P<0.001 compared with sh-NC
3 讨论
CRC严重威胁人类生命安全,寻找早期诊断和治疗CRC的生物标志物具有重要的临床意义。本研究发现MCM3AP-AS1在CRC组织和细胞中表达上调并与患者不良预后呈显著相关。
LncRNAs在CRC的进展中发挥了重要作用。例如,LncRNA GLCC1在CRC中表达上调并与CRC患者不良预后相关,而且GLCC1通过与HSP90分子伴侣直接相互作用而稳定了c-Myc转录因子的泛素化,从而促进CRC的葡萄糖代谢及其恶性进展[9]。类似研究表明,Lnc PLncRNA-1在CRC中表达上调,进一步研究表明Lnc PLncRNA-1通过吸附miR-204激活Wnt/β-catenin途径加速了细胞周期进程,并通过抑制CRC细胞凋亡,促进肿瘤的生长和转移[10]。本研究发现MCM3AP-AS1在CRC中表达上调,敲低MCM3AP-AS1可抑制CRC细胞的增殖和迁移,这表明MCM3AP-AS1可促进CRC的恶行进展。
miRNAs可以在抑癌基因恶行肿瘤中发挥作用。例如,miR-193a-3p能够通过下调PLAU抑制CRC的发生和发展[11]。据报道,miR-876-5p在乳腺癌[7]、胃癌[8]、中表达显著下调,并抑制肿瘤的生长。本研究发现miR-876-5p在CRC组织和细胞中表达显著下调,进一步实验表明miR-876-5p可抑制CRC细胞的增殖和迁移。这表明miR-876-5p在CRC中作为抑癌基因发挥作用。
竞争性内源RNA(competing endogenous RNA, ceRNA)分子机制假说表明,lncRNA通过吸附 miRNA靶向调控mRNA在肿瘤中发挥作用[12]。例如,MCM3AP-AS1通过调节miR-211-5p/SPARC轴促进乳头状甲状腺癌的进展[13]。在肝癌中,LINC-ROR通过吸附miR-876-5p上调FOXMI的表达,从而促进肿瘤细胞的增殖和转移[14]。而在CRC中,LncRNA GAS5通过靶向miR-222-3p抑制癌细胞的增殖,促进细胞的凋亡[15]。而本研究中相关机制实验验证了CRC中MCM3AP-AS1可靶向调控miR-876-5p并负向调节miR-876-5p的表达,功能上miR-876-5p可削弱MCM3AP-AS1对CRC细胞增殖和迁移的促进作用。综上,MCM3AP-AS1可通过吸附miR-876-5p促进CRC的进展。
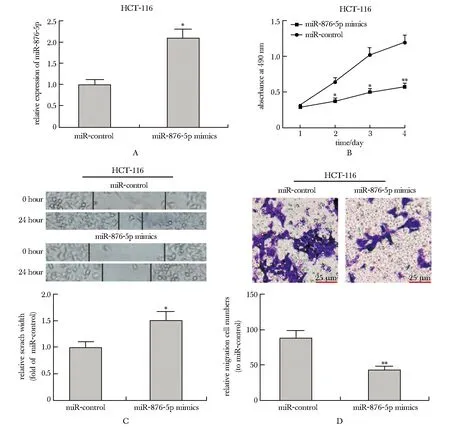
A.HCT-116 cells were transfected with miR-876-5p mimics;B-D.the effects of miR-876-5p mimics on HCT-116 cells proliferation and migration; *P<0.01, **P<0.001 compared with miR-control
总之,本研究证明了MCM3AP-AS1在CRC组织和细胞中表达上调,并与患者不良预后相关;进一步研究表明MCM3AP-AS1通过吸附miR-876-5p促进CRC细胞增殖和迁移。这些发现可能为CRC的诊断和临床治疗提供新的生物标志物和治疗靶点。

A,B.HCT-116 cells were transfected with MCM3AP-AS1+miR-876-5p mimics;C-E.the effects of MCM3AP-AS1+miR-876-5p mimics on HCT-116 cells proliferation and migration; *P<0.01, **P<0.001 compared with NC;#P<0.05 compared with NC+ MCM3AP-AS1

