锑金精矿酸性电积工艺中电解液中总铁、Fe2+、Fe3+的含量测定
康钦科,龙志华
(湖南新龙矿业有限责任公司,湖南 邵阳 422900)
高砷锑金精矿电解工艺矿石浸出过程中,部分浸出液净化和电解沉积过程分别隔离到2个装置中进行。充分利用电解沉积过程中阳极氧化反应使系统中的Fe2+氧化成Fe3+,通过均衡稳定的溶液循环,使足量的Fe3+在浸出装置中浸出矿石中的有用元素。所使用的体系为HCl-NH4Cl体系。作为全新的一个体系,体系中所涉及的离子有Fe2+、Fe3+、NH+4、Sb3+、Cl-、S2-等,在实际生产中铁发挥着重要的作用。
一方面,Fe3+对硫化锑精矿的氧化:通过该反应,一定量的Fe3+可以保证锑元素从固态转变为离子形式进入溶液中,从而保证渣含锑指标的正常。
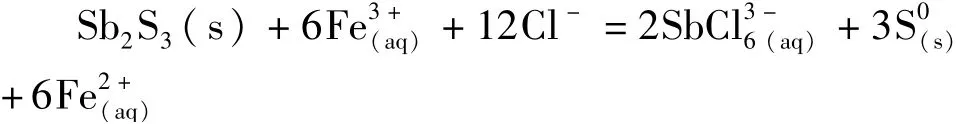
另一方面,Fe3+对电流效率的负面影响:阴极区可能发生如下反应,从而降低阴极电流效率。

因此有必要研究探讨电解系统中总铁、Fe2+、Fe3+离子测定的有效准确的分析方法。本文采用铈量法[1]测定电解系统内的阳极液、阴极补液以及萃取过程等液样中总铁、Fe2+、Fe3+离子含量。
1 试验部分
1.1 分析原理
湿法液样体系中铁的存在形式分为Fe3+、Fe2+。在适当的酸度下和磷酸介质中,以二苯胺磺酸钠作指示剂,用硫酸铈标准溶液进行滴定[2],可得出Fe2+的含量。其反应式如下:
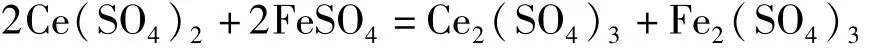
溶液中的Fe3+在盐酸介质中用氯化亚锡还原成Fe2+,再用氯化高汞氧化过量的亚锡后,参照Fe2+的分析方法可得出Fe3+和Fe2+的总量(即总铁的含量)。其反应式如下:
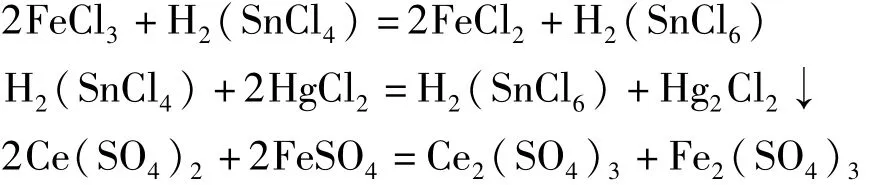
Fe3+含量由总铁和Fe2+含量相差得出。
1.2 试剂
1.硫酸(ρ=1.84 g/mL)。
2.盐酸(ρ=1.19 g/mL)。
3.氯化亚锡溶液(100 g/L):称取10 g SnCl2溶于20 mL浓盐酸,以水稀至100 mL。
4.饱和氯化高汞溶液。
5.二苯胺磺酸钠水溶液(5 g/L)。
6.磷酸。
7.甲基橙指示剂(1 g/L)。
8.锑粉(99.999%)。
9.盐酸(1+1)。
10.硫酸铈标准溶液。配制:称取125.0 g硫酸铈,置于1 000 mL烧杯中,加入200 mL硫酸,搅拌均匀,在电炉上逐步升温加热溶成糊状,并冒硫酸白烟约20 min,取下稍冷,加入预先配制好的硫酸(1+1)200 mL,搅拌溶解至清亮,冷却,移入已装有2 000 mL水的5 000 mL试剂瓶中,分次用硫酸(1+1)200 mL洗涤烧杯,一并移入5 000 mL试剂瓶中,再往5 000 mL试剂瓶中加入2 400 mL水,充分摇匀,放置1个月以上。
标定:称取0.100 0 g纯锑(99.999%)于300 mL锥形瓶中,加少量水润湿试样,加12 mL硫酸,在保持溶液近沸的温度下溶解至清亮,取下,冷却。加40 mL水,30 mL盐酸,再加热至80~90℃,立即滴加甲基橙指示剂2滴,以硫酸铈标准溶液滴定至无色为终点。平行标定3份,极差值不超过0.10 mL。
随同标定做空白试验。
计算滴定度:按公式(1)计算硫酸铈标准溶液对锑的滴定度。

式中:T为硫酸铈标准溶液对锑的滴定度/g·mL-1;m为称取锑粉量/g;V为滴定锑粉所消耗硫酸铈标准溶液的体积/mL;V0为测定空白所消耗硫酸铈标准溶液的体积/mL。
1.3 分析步骤
1.3.1 Fe2+的测定
用移液管移取1 mL待测样品,置于400 mL烧杯中,分别加入浓盐酸12 mL,水约75~80 mL,磷酸5 mL,二苯胺磺酸钠指示剂[3]两滴,用硫酸铈标准溶液在不断搅拌下滴至蓝紫色为终点。
1.3.2 总Fe的测定[4]
用移液管移取1 mL待测样品,置于300 mL烧杯中,加10~15 mL盐酸,加热,趁热缓慢滴加还原剂氯化亚锡溶液至黄色消失,再滴加氯化亚锡溶液过量至2滴,以水吹洗杯壁,加入饱和氯化高汞溶液10 mL,静置3 min。
依次加75 mL水、5 mL磷酸、2~3滴二苯胺磺酸钠指示剂,用硫酸铈标准溶液滴定至蓝紫色为终点。
1.4 总铁、Fe2+、Fe3+离子含量计算
1.4.1 Fe2+含量计算
按公式(2)计算Fe2+的浓度CFe2+。
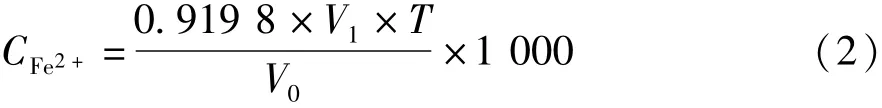
式中:0.919 8为转换系数(Ce(SO4)2对锑的滴定度与对亚铁的滴定度的质量转换系数);V1为所消耗的硫酸铈标准溶液的体积/mL;T为硫酸铈标准溶液对锑的滴定度/g·L-1;V0为所取待测样品的体积,为1 mL。
1.4.2 总铁的含量计算
按公式(3)计算总铁的质量-体积浓度C总铁。
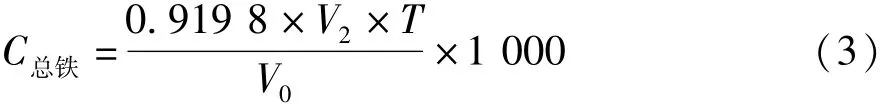
式中:0.919 8为转换系数(硫酸高铈对锑的滴定度与对Fe2+的滴定度的质量转换系数);V2为所消耗的硫酸铈标准溶液的体积/mL;T为硫酸铈标准溶液对锑滴定度/g·mL-1;V0为所取待测样品的体积,为1 mL。
1.4.3 Fe3+的含量计算
Fe3+的含量等于总铁含量与Fe2+含量相减,见公式(4)。

2 样品检测应用及讨论
2.1 硫酸铈标准溶液的标定
根据标定操作标准,进行三次平行分析及一次空白分析,结果见表1。
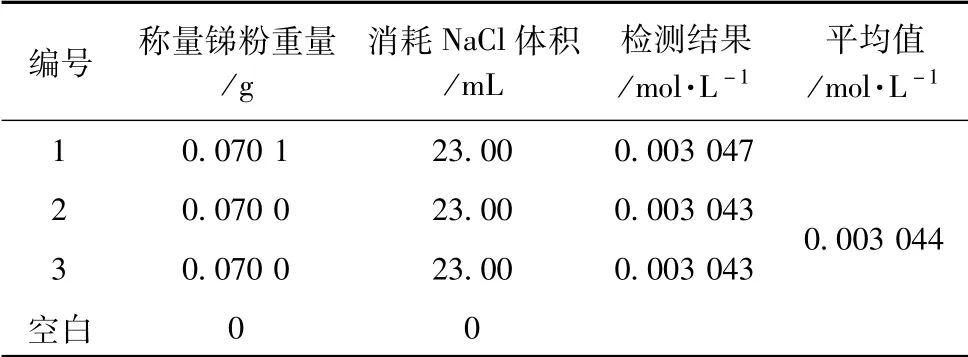
表1 硫酸铈标准溶液的标定结果
2.2 方法论证
2.2.1 Fe2+的测定方法论证
根据1.3.1中Fe2+的测定操作标准,对公司1#液、2#液、3#液质控样中Fe2+含量进行测定,依次移取三种浓度1#液、2#液、3#液质控样按步骤进行操作,分析结果数据见表2。从分析结果数据来看,该方法分析结果准确,对锑金精矿酸性电积工艺中电解液中Fe2+的含量测定具有可行性。对1#液、2#液、3#液公司质控样进行三次平行试验,同时进行空白分析。
2.2.2 总铁的测定方法论证
根据1.3.2操作标准,对1#液、2#液、3#液公司质控样进行三次平行试验,同时进行空白分析,用该方法对1#液、2#液、3#液质控样总铁含量进行测定,分别移取该三种浓度不同的质控样按步骤进行操作,分析结果数据见表3。该方法分析结果准确,对锑金精矿酸性电积工艺中电解液中总铁的含量测定具有可行性。
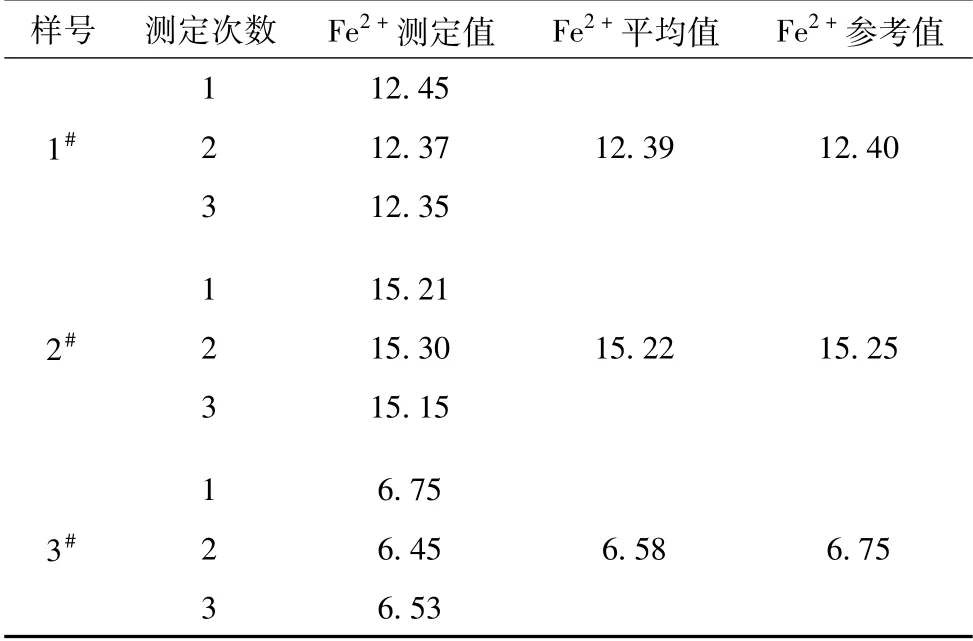
表2 质控样Fe2+含量测定结果 g/L
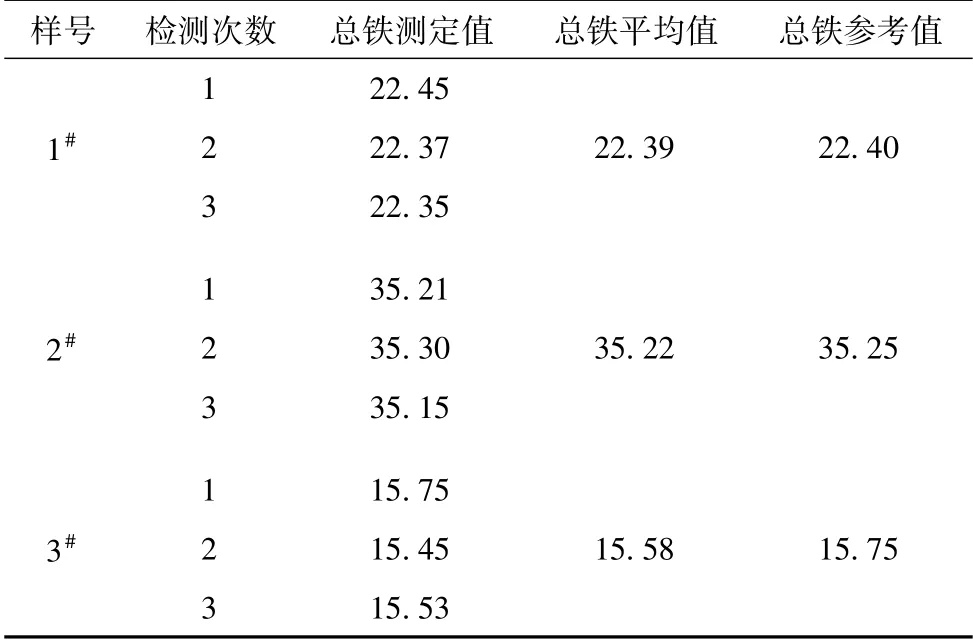
表3 总铁含量测定结果 g/L
2.3 回收率试验
1.加10 mg/mL的Fe2+标液对1#液、2#液、3#液公司质控样的Fe2+进行加标回收率试验。移取1#液、2#液、3#液质控样各1 mL,加入10 mg/mL的Fe2+标液1 mL,进行回收率试验。试验结果见表4,结果显示Fe2+的测定方法的加标回收率在99.80%~101.00%之间。
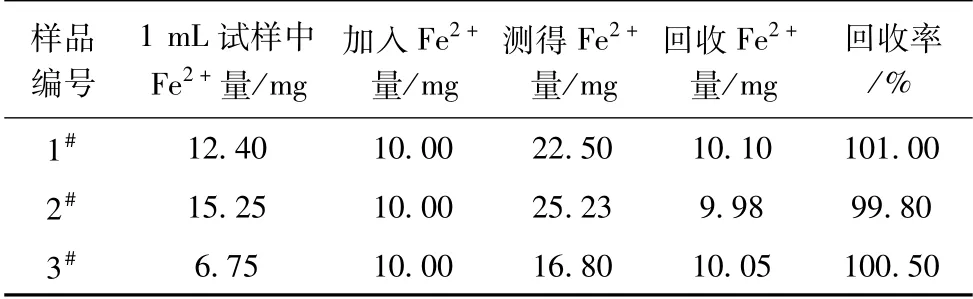
表4 质控样的Fe2+加标回收率试验结果
2.加10 mg/mL Fe2+标液对1#液、2#液、3#液公司质控样的总铁进行加标回收率试验。分别移取1#液、2#液、3#液质控样各1 mL,加入10 mg/mL Fe2+标液1 mL,进行回收率试验。试验结果见表5,该方法的加标回收率在99.50%~100.50%之间。
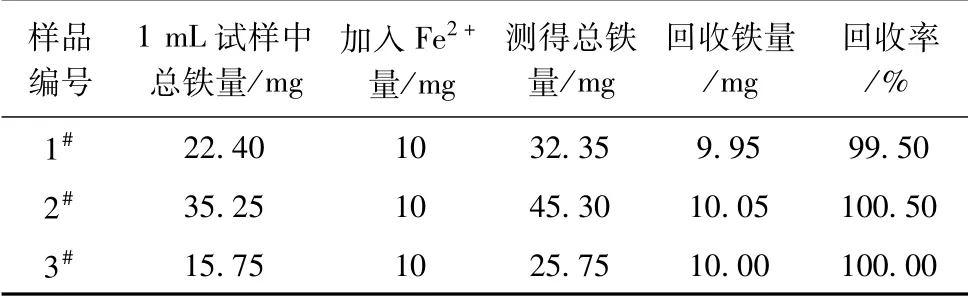
表5 公司质控样的总铁加标Fe2+回收率试验结果
3.加10 mg/mL Fe3+标液对1#液、2#液、3#液公司质控样的总铁进行加标回收率试验。移取1#液、2#液、3#液质控样各1 mL,加入10 mg/mL Fe3+标液1 mL,进行试验。试验结果见表6,该方法的加标回收率在99.00%~101.00%之间。
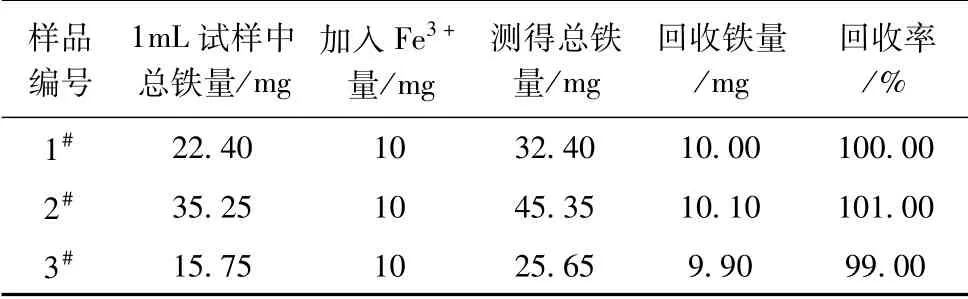
表6 公司质控样的总铁加标Fe3+回收率试验结果
3 总 结
由试验数据可以看出:针对生产中的阳极液及阴极补液在化验时,移取1 mL试样,使用该方法得到的结果与参考结果在允许误差范围之内,加标回收率正常。该方法检测电解系统内的阳极液、阴极补液以及萃取过程等液样总铁、Fe2+、Fe3+离子含量有效、可行。

