巴佛洛霉素A1抑制胃癌SGC-7901细胞中VEGF-C的表达
陈海姣,吴淼淼,刘鹏飞,张 婷,朱 琳,江柯炜,沈卫东
胃癌在中国是最常见的消化系统恶性肿瘤之一,手术切除为主要的治疗手段,但术后复发及转移率较高。根治性手术治疗进展期胃癌5年生存率约为40%,患者主要死于复发和转移,而淋巴转移是其最主要的转移方式[1]。但迄今为止,胃癌淋巴转移的具体机制却不明确[2-4]。
液泡-ATP酶(vacular-ATPases,V-ATPases)是传统的质子泵,普遍存在于从酵母至人类的真核生物中。在正常细胞中,V-ATPases主要表达在细胞质中,其功能为保持细胞质基质内中性pH值和细胞器内的酸性pH值。近来发现,V-ATPases在一些疾病的发生及进展中具有重要的作用,如骨质疏松、肾小管酸中毒以及男性不育等,尤其与肿瘤的恶性生物学行为关系密切,已成为新的研究焦点之一[5-6]。在肿瘤组织细胞的细胞膜及囊泡膜上V-ATPases表达显著高于正常组织[7],有助于肿瘤细胞将H+泵出膜外或泵入囊泡内,使得细胞外、囊泡和溶酶体酸化,从而维持肿瘤细胞外和囊泡内酸性环境并使细胞脱离H+的危害,促进细胞的增殖、转移和侵袭[8-9]。因此,V-ATPases已成为具有良好前景的抗肿瘤侵袭转移靶标。巴佛洛霉素A1(Bafilomycin A1)是V-ATPases的抑制剂[10],本研究中利用巴佛洛霉素A1来观察对胃癌细胞SGC-7901的迁移和侵袭的作用。
血管内皮生长因子(vascular endothelial growth factor,VEGF)包括多个亚型VEGF-A、VEGF-C和VEGF-D,在新生淋巴管的形成中起着非常重要的作用[4-6]。它能维持内皮细胞的存活,诱导内皮细胞的增殖与迁移,募集骨髓源性的造血祖或干细胞诱导脉管形成,增加脉管通透性。肿瘤细胞过表达VEGF-A、VEGF-C和VEGF-D,分别与淋巴内皮细胞VEGF受体2(VEGF receptor 2,VEGFR2)和VEGFR3相结合,促进新生淋巴管形成[6-7]。本课题组前期研究发现,用药物抑制食管癌细胞V-ATPases活性,会引起VEGF-C表达的降低以及新生血管形成减少[11]。近来的一些研究发现,雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)能通过缺氧诱导因子1α(hypoxia inducible factor-1α,HIF-1α)调控肿瘤细胞中VEGF的分泌,进而影响肿瘤新生脉管的形成[12-16]。因此本研究旨在探讨巴佛洛霉素A1抑制V-ATPases活性之后,对胃癌细胞中VEGF-C表达以及细胞的生物学行为的影响。
1 材料与方法
1.1 细胞、试剂与仪器
人胃癌SGC-7901细胞和人脐静脉细胞(human umbilical vein endothelial cells,HUVECs)购自中国科学院上海生命科学研究院细胞资源中心。DMEM高糖培养液购自美国HyClone公司,胎牛血清和含EDTA的0.25%胰蛋白酶购自美国Gibco公司,巴佛洛霉素A1购自美国Sigma公司(用DMSO溶解后,-20 ℃条件下保存)。CCK-8试剂盒购自日本同仁株式会社化学研究所、RIPA裂解液、PMSF酶抑制剂、BCA蛋白浓度定量试剂盒、SDSPAGE凝胶制备试剂盒和结晶紫染液均购自江苏凯基生物技术股份有限公司,ELISA试剂盒购自美国Cloud-Clone公司,Transwell小室购自美国Corning公司,V-ATPases分析试剂盒(GMS50247.1)购自上海杰美基因医药科技有限公司;TRIzol购自美国Invitrogen公司、反转录试剂盒和SYBR Green PCR Master Mix购自日本TaKaRa公司;基质胶(martrigel)购自美国BD公司。兔抗人GAPDH(内参照)单克隆抗体购自武汉三鹰生物技术有限公司,兔抗人VEGF-C单克隆抗体购自美国Omnimabs公司,辣根过氧化物酶标记的山羊抗兔IgG及电化学发光剂购自上海碧云天生物技术公司。GAPDH和VEGF-C基因引物由生工生物工程(上海)股份有限公司合成。
倒置光学显微镜(型号:CKX41)为日本Olympus公司产品,实时荧光定量PCR仪(型号:CFX96)、酶联免疫检测仪、分光光度仪(SmartSpec Plus)及凝胶成像分析仪(SYSTEM GelDoc XR+)均为美国Bio-Rad公司产品,细胞培养箱(型号:T-3111)为美国Thermo公司产品,高速离心机[型号:5810(R)]为德国Eppendorf公司产品,台式实验pH计为瑞士Mettler Toledo公司产品。
1.2 方法
1.2.1 细胞培养
人胃癌细胞系SGC-7901细胞和HUVECs用含10%灭活胎牛血清的DMEM培养液,置于37 ℃、CO2体积分数为5%的培养箱中进行培养。每2~3 d传代1次,取对数生长期的细胞用于后续实验。
1.2.2 V-ATPases活性及培养液pH值检测
将SGC-7901细胞(1×106个)接种于直径为6 cm的培养皿中,培养16 h后,在细胞中加入终浓度为10 nmol/mL的巴佛洛霉素A1(以加入不含任何药物的培养液处理SGC-7901细胞为对照组)。药物处理24 h后收集细胞,按V-ATPases分析试剂盒提供的操作说明,提取细胞内的V-ATPases,随后在分光光度仪上波长340 nm处每隔5 min(0~20 min)检测样品的D值;获得的数据,按试剂盒提供的操作说明进行换算,数据单位为unit/μg。
同时收集2组细胞的培养上清液,用pH计测量上清液的pH值。
1.2.3 CCK-8法检测细胞增殖
收集生长状态良好的SGC-7901细胞,用含EDTA的0.25%胰蛋白酶消化后,进行计数;按5×103个细胞/孔的密度接种于96孔板中,每组设5个复孔。细胞培养16 h后加入巴佛洛霉素A1进行处理,细胞分组及药物处理同1.2.2节。药物处理24 h后加入CCK-8试剂孵育1.5 h后,上酶联免疫检测仪在波长450 nm处检测各孔细胞的D值,并用GraphPad Prism5统计学软件对获得的D值进行统计分析。
同时在光学显微镜下观察,巴佛洛霉素A1进行处理后对SGC-7901细胞形态的影响。
1.2.4 Transwell小室法检测巴佛洛霉素A1对SGC-7901细胞迁移能力的影响
收集生长状态良好的SGC-7901细胞,按5×104个细胞/孔的密度接种于Transwell小室的上室中培养20 h后加入终浓度为10 nmol/mL的巴佛洛霉素A1(用不含血清的培养液进行稀释),细胞分组及药物处理同1.2.2节。小室的小室中则加入含10%胎牛血清的培养液,继续培养48 h后,取出小室,擦除未穿过小室膜的细胞,用结晶紫染色细胞15 min;用PBS洗膜3次,在光学显微镜下观察细胞形态(放大倍数为400倍)并计数细胞(随机计算5个视野)。
1.2.5 ELISA法检测细胞培养上清液中VEGF-C蛋白的表达量
将SGC-7901细胞按5×105个细胞/皿的密度接种于直径为3 cm的培养皿中,培养16 h待细胞融合度为60%~70%时,更换为含药物的培养液,细胞分组及药物处理同1.2.2节。继续培养24 h后7 500×g离心10 min收集上清液,除去沉淀;各取50 μL培养上清液按照ELISA试剂盒操作说明提供的方法检测培养液上清中VEGF-C蛋白的表达量。获得的数据用GraphPad Prism软件进行数据的统计分析。
1.2.6 实时荧光定量PCR法检测VEGF-C mRNA的表达水平
将SGC-7901细胞以5×105个细胞/皿的密度接种于直径为6 cm的培养皿中,培养16 h待细胞融合度为60%~70%时,更换含药物的培养液,细胞分组及药物处理同1.2.2节。继续培养24 h后收集细胞,用TRIzol法提取细胞的总RNA,并用反转录试剂盒将RNA反转录为cDNA;以cDNA为模板进行PCR扩增,反应体系的配制按照SYBR Green PCR Master Mix试剂盒提供的操作说明。扩增条件为95 ℃ 1 min;95 ℃ 15 s、60 ℃ 30 s,共40个循环;60 ℃15 s,最后95 ℃ 15 s。用2-ΔΔCt值表示目的基因的相对表达量。VEGF-C基因上游引物序列为5’-GAGCAGTTACGGTCTGTGTCC-3’,下游引物序列为5’-CTGTCCTTGAGTTGAGGTTGG-3’;内参照基因GAPDH引物为生工生物工程(上海)股份有限公司产品。
1.2.7 蛋白印迹法检测
收集SGC-7901细胞,用巴佛洛霉素A1处理后继续培养24 h,细胞分组及药物处理同1.2.2节;消化并收集细胞,加入RIPA裂解液和PMSF酶抑制剂处理细胞,收集细胞上清液,并用BCA法对收集获得的蛋白定量。取15 mg总蛋白上样,行SDS-PAGE分离蛋白并转移至PVDF膜上;用封闭液(含5%脱脂奶粉的PBST)封闭处理1 h,分别加入一抗[兔抗人GAPDH(内参照)单克隆抗体(体积稀释比例为1∶1 000)和兔抗人VEGF-C单克隆抗体(体积稀释比例为1∶200)]4 ℃反应过夜;用TBS洗膜3次,每次10 min;加入辣根过氧化物酶标记的二抗(工作液的体积稀释比例参阅抗体试剂盒的操作说明)常温孵育2 h;最后滴加电化学试剂后显影。采用Image J软件分析蛋白条带的灰度值,以目的蛋白VEGF-C条带灰度值与内参照GAPDH蛋白条带灰度值的比值表示目的蛋白的相对表达量。
1.2.8 HUVECs成管实验
收集SGC-7901细胞,用巴佛洛霉素A1处理24 h后常规离心10 min,取上清液-80 ℃保存备用。将5×104个HUVECs接种在预先用基质胶包被的24孔培养板中,将培养液更换为之前收集的SGC-7901细胞的培养上清液。培养6 h后,去除上清液,用PBS清洗细胞2次,然后用4%多聚甲醛溶液固定细胞15min,结晶紫染色10 min,PBS清洗3次(5 min/次);在光学显微镜下(放大倍数为400倍)观察HUVECs的成管情况。
1.2.9 统计学方法
采用SPSS 18.0和GraphPad Prism 5统计学软件对获得的数据进行统计学分析。所有的实验均独立重复3次,计量资料用表示,计数资料用整数表示。组间两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 巴佛洛霉素A1抑制SGC-7901细胞中V-ATPases的活性
用V-ATPases抑制剂巴佛洛霉素A1处理胃癌SGC-7901细胞后检测细胞中V-ATPases的活性。结果(图1A)显示,对照组与巴佛洛霉素A1组SGC-7901细胞的V-ATPases活性分别为(0.026 0±0.000 4)unit/μg和(0.021 5±0.000 6)unit/μg;与对照组相比,巴佛洛霉素A1组SGC-7901细胞中V-ATPases的活性减弱(P<0.05)。
随后检测2组细胞培养液的pH值。结果(图1B)显示,对照组培养液的pH值为6.375±0.045,巴佛洛霉素A1组为7.090±0.070;与对照组相比,巴佛洛霉素A1作用后细胞外的pH值上升酸性减弱(P<0.05)。
上述结果提示,巴佛洛霉素A1作用于SGC-7901细胞后,能抑制V-ATPases的活性,从而使其向细胞外传递H+的能力减弱。
2.2 巴佛洛霉素A1抑制细胞的增殖和迁移能力
用巴佛洛霉素A1(10 nmol/mL)处理SGC-7901细胞24 h后,观察药物对细胞形态的影响。结果(图2A)发现,相较于对照组,巴佛洛霉素A1组SGC-7901细胞的形态发生明显改变,且可导致细胞发生凋亡,细胞生长受到抑制。进一步用CCK-8法检测细胞的增殖能力,结果(图2B)发现对照组细胞的D值为1.354±0.022,巴佛洛霉素A1组为1.103±0.007;巴佛洛霉素A1组细胞的增殖能力较对照组被明显抑制(P<0.05)。提示巴佛洛霉素A1能够显著抑制细胞的增殖能力。
本研究中进一步用Transwell小室检测巴佛洛霉素A1对SGC-7901细胞的迁移能力的影响。结果(图2C)显示,对照组与巴佛洛霉素A1组SGC-7901细胞发生迁移的细胞数分别为(63.250±5.218)个和(21.170±4.347)个;与对照组相比,巴佛洛霉素A1组发生迁移的细胞明显减少(P<0.05)。
2.3 巴佛洛霉素A1抑制SGC-7901细胞VEGF-C的表达
有研究提示,VEGF与肿瘤的发生和迁移有关[16-17],因此本研究中进一步采用ELISA法、实时荧光定量PCR法和蛋白质印迹法检测了巴佛洛霉素A1(10 nmol/mL)处理后对SGC-7901细胞中VEGF-C表达的影响。
ELISA法检测结果(图3A)显示,50 μL对照组和巴佛洛霉素A1组细胞培养上清液中VEGF-C的含量分别为(322.5±23.50)μg和(190.0±19.00)μg;与对照组相比,巴佛洛霉素A1组细胞分泌到细胞外的VEGF-C表达量明显减少(P<0.05)。
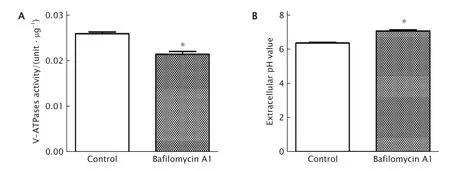
Fig.1 The vacuolar-ATPases (V-ATPases) activity of gastric cancer SGC-7901 cells treated with Bafilomycin A1 (10 nmol/mL) was detected by a V-ATPases kit,and the extracellular pH value of SGC-7901 cells treated with Bafilomycin A1 (10 nmol/mL) was measured with a pH meter.SGC-7901 cells treated without any drugs were used as the control for V-ATPases assay,and the same volume of the medium as the drug-treated group was used as the control for extracellular pH detection.Bafilomycin A1 could significantly reduce the V-ATPases activity (A) and increased the extracellular pH value (B).*P<0.05,vs the control group (n=3).图1 巴佛洛霉素A1对SGC-7901细胞V-ATPases活性(A)以及细胞外pH值的影响(B)
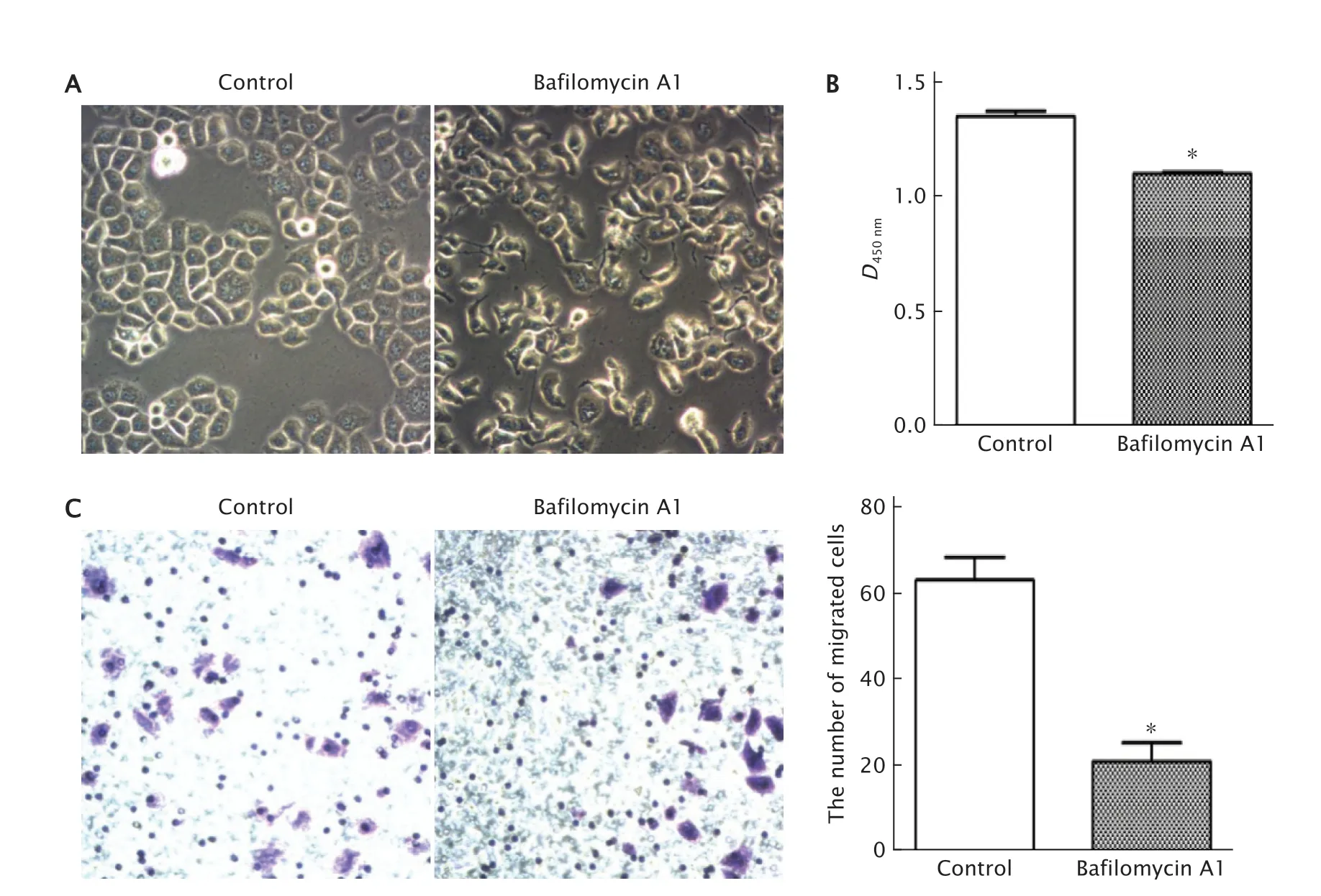
Fig.2 The cell morphology of gastric cancer SGC-7901 cells treated with Bafilomycin A1 (10 nmol/mL) was observed under optical microscope (A),the cell proliferation was detected by the CCK-8 method (B),and the migration ability was detected by Transwell chamber assay (crystal violet staining,×400) (C).SGC-7901 cells were treated without any drugs as the control.Bafilomycin A1 significantly inhibited cell proliferation and significantly reduced cell migration ability.*P<0.05,vs the control group (n=3).图2 巴佛洛霉素A1处理后光学显微镜下观察SGC-7901细胞形态的改变情况(A),CCK-8法和Transwell小室法检测对细胞增殖(B)和迁移(C)能力的影响
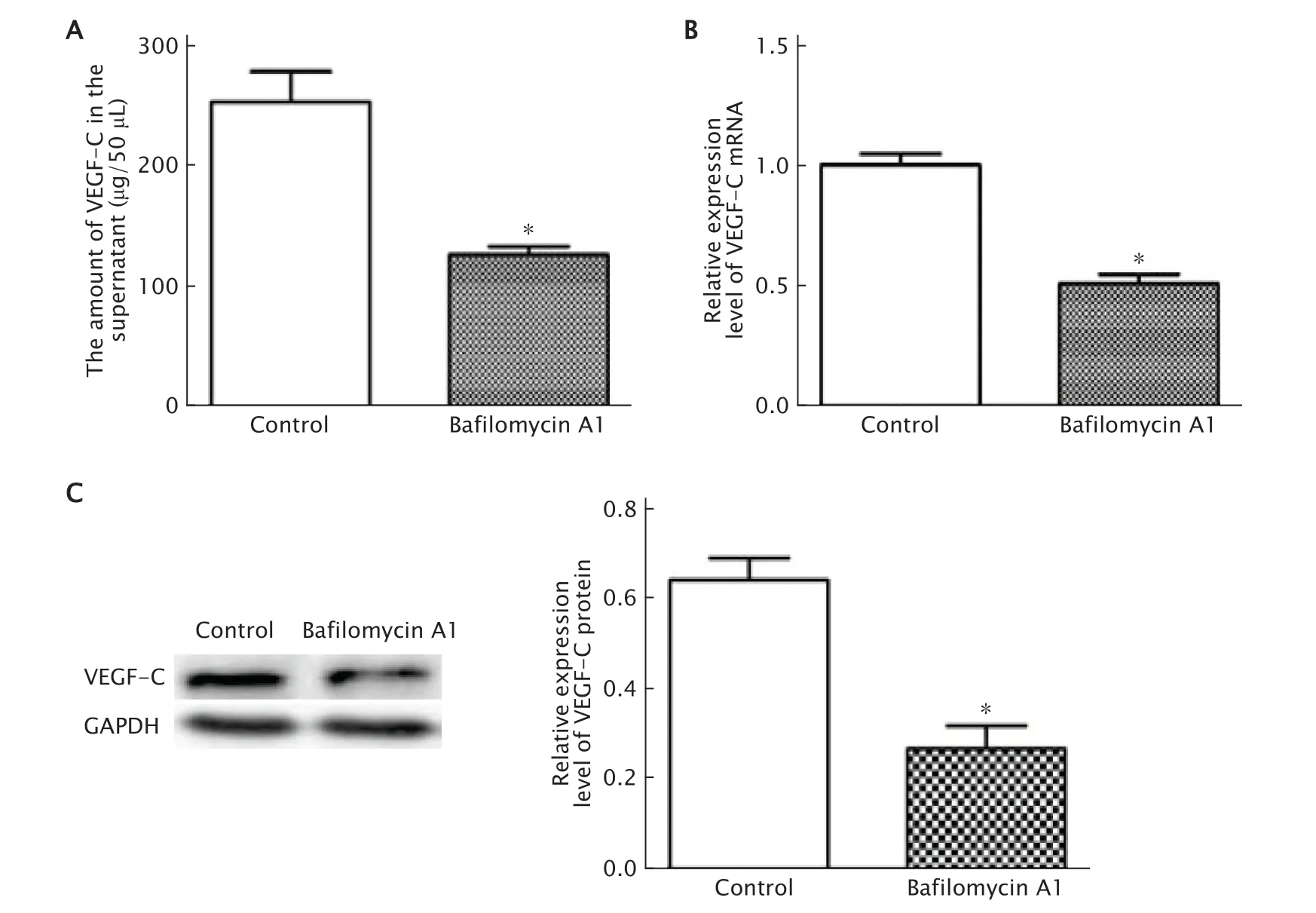
Fig.3 The vascular endothelial growth factor-C (VEGF-C) secretion of SGC-7901 cells treated with Bafilomycin A1 (10 nmol/mL) was detected by ELISA method,Bafilomycin A1 significantly reduced the VEGF-C secretion into cell culture supernatant (A);the expression level of VEGF-C mRNA (B) and VEGF-C protein (C) in SGC-7901 cells treated with Bafilomycin A1 (10 nmol/mL) were detected by realtime fluorescent quantitative PCR and Western blotting,respectively.SGC-7901 cells were treated without any drugs as the control.Bafilomycin A1 significantly down-regulated the expression levels of VEGF-C mRNA and VEGF-C protein.*P<0.05,vs the control group (n=3).图3 采用ELISA法(A)检测巴佛洛霉素A1对SGC-7901细胞分泌VEGF-C能力的影响,实时荧光定量PCR法(B)和蛋白质印迹法(C)检测对SGC-7901细胞中VEGF-C mRNA和蛋白表达水平的影响
实时荧光定量PCR法和蛋白质印迹法检测结果显示,与对照组相比,巴佛洛霉素A1组SGC-7901细胞中VEGF-C mRNA(图3B)和蛋白(图3C)的表达水平明显下调(P值均<0.05)。
上述结果提示,巴佛洛霉素A1可能通过影响SGC-7901细胞的VEGF-C表达,进而影响细胞的迁移[15]。
2.4 巴佛洛霉素A1处理后的SGC-7901细胞培养上清液对HUVECs成管能力影响
将用巴佛洛霉素A1(10 nmol/mL)处理24 h的SGC-7901细胞的上清液与HUVECs共培养。结果(图4)显示,对照组巴佛洛霉素A1组中HUVECs形成的三维管状结构分别为(47.17±4.963)个和(25.17±4.324)个,巴佛洛霉素A1处理后能明显抑制HUVECs成管数(P<0.05)。药物处理过的上清液中,可能由于部分细胞分泌因子的改变,如VEGF-C分泌水平的降低,使HUVECs的成管能力显著减弱。
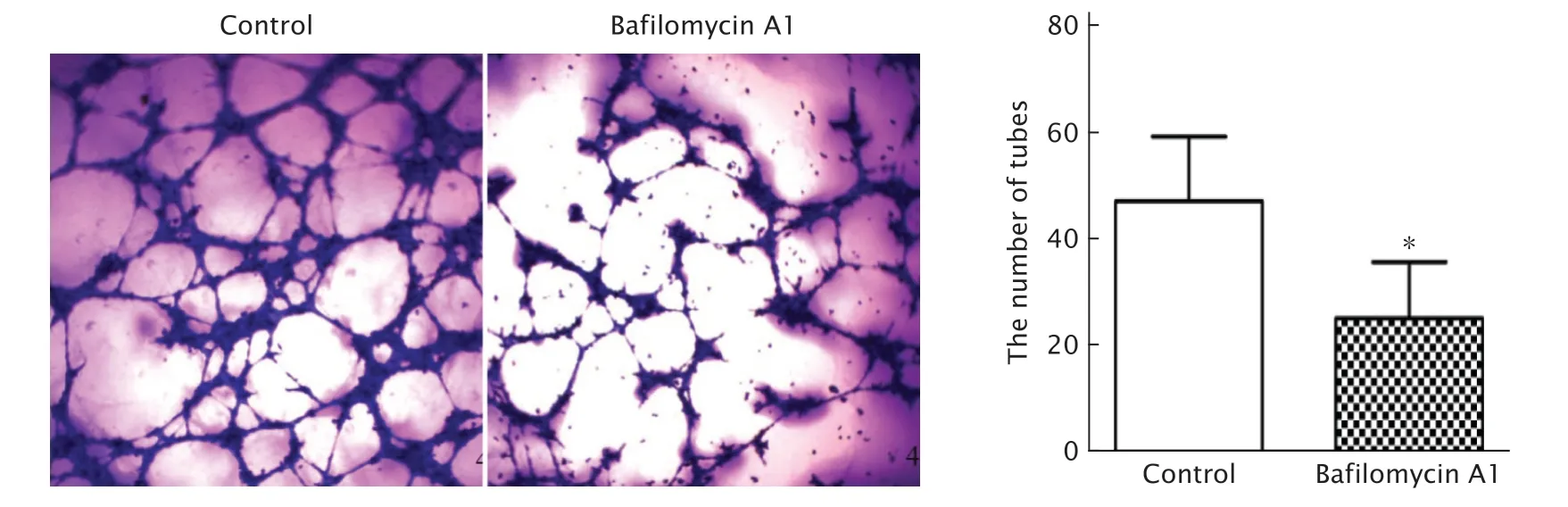
Fig.4 The number of tubular structures formed by human umbilical vein endothelial cells (HUVECs)cultured with SGC-7901 cell’s supernatant treated with bafilomycin A1 was observed under optical microscope (crystal violet staining,×400).SGC-7901 cells were treated without any drugs as the control.Compared with the control group,the number of tubular in the Bafilomycin A1 group significantly decreased.*P<0.05,vs the control group (n=3).图4 细胞成管实验观察巴佛洛霉素A1处理后的SGC-7901细胞培养上清液对HUVECs成管能力的影响
3 讨论
与正常细胞相比,肿瘤细胞呈现外酸内碱的状态,而存在于生物膜上的质子泵能够逆浓度梯度向细胞外传递H+,来调节肿瘤细胞外酸内碱的pH值梯度,肿瘤的酸性微环境能够刺激细胞增殖,活化转录因子,促进靶基因表达,促进肿瘤发生。然而,细胞外环境即便是轻度酸化,都会影响细胞的信号通路,从而对凋亡和增殖等产生一定影响。肿瘤细胞增殖到一定程度后分泌诸多淋巴生长调节因子,其中最主要为VEGF。巴佛洛霉素A1是V-ATPases的特异性抑制剂,它能够抑制V-ATPases的活性;V-ATPases活性被抑制或者降低之后,对癌细胞的运动尤其是癌细胞转移的影响的报道目前尚比较少。
本研究中用巴佛洛霉素A1处理胃癌SGC-7901细胞后发现,SGC-7901细胞的V-ATPases活性被明显抑制,细胞向外传递H+的能力减弱,导致细胞内外的pH值梯度发生改变,SGC-7901细胞的增殖受到抑制,并引起细胞凋亡的增加。进一步检测细胞的迁移能力,发现细胞的迁移能力明显降低。上述结果提示,巴佛洛霉素A1作为V-ATPases的抑制剂,能够通过抑制胃癌细胞SGC-7901的V-ATPases活性,改变细胞的增殖和迁移能力。
为了进一步探究药物作用之后对细胞信号通路或者相关因子的分泌的影响,根据本课题组前期研究的结果[11],本研究中同样进行了血管生成因子的检测。结果发现,抑制V-ATPases活性后,SGC-7901细胞分泌到细胞外的VEGF-C的表达量也减少。同时用细胞培养上清液作用于HUVECs,结果显示和巴佛洛霉素A1处理组培养上清液共培养的HUVECs的成管能力显著减弱。这一结果提示,V-ATPases也许能通过影响VEGF信号通路,进而影响肿瘤细胞的迁移[15],甚至可能会抑制新生血管的形成。其中的机制还有待通过进一步的研究予以确认。
综上所述,本研究发现巴佛洛霉素A1能抑制胃癌SGC-7901细胞增殖和迁移,其抑制作用可能与V-ATPases活性被抑制,引起细胞外酸性微环境的改变有关,并且涉及血管生成因子VEGF-C的表达和分泌。本研究将有助于更好地了解巴佛洛霉素A1与细胞增殖、迁移的关系,以及VEGF-C在人胃癌细胞转移中有着重要作用,为V-ATPases抑制剂的临床治疗提供了一定的理论基础。

