P2X7受体在乳腺浸润性导管癌中的表达水平及临床意义
王鑫蓉,王 哲,杨向红
乳腺癌是女性中常见的恶性肿瘤,乳腺浸润性导管癌是乳腺癌中最常见的类型,约占乳腺癌病例的80%[1]。近年来,随着乳腺肿瘤筛查技术的普及,越来越多的早期肿瘤被发现,并通过采用手术、放疗、化疗、内分泌治疗和靶向治疗等多种治疗方式,很大程度上阻碍或延缓了乳腺癌的进展,但乳腺癌的分子生物学机制目前尚未完全阐明,乳腺癌仍存在较高的复发和转移风险。因此,明确乳腺癌发生和发展的分子机制,寻找相关的生物标志物和治疗靶点对乳腺癌诊治十分重要。研究发现,嘌呤类受体在肿瘤的发生和发展过程中具有重要作用,嘌呤类受体包括腺苷激活的P1受体和细胞外ATP激活的P2受体2大类,P2受体又可分为离子门控型P2X受体和G蛋白耦联型P2Y受体。P2X受体包括P2X1~P2X7共7个亚型[2],其中P2X7受体(P2X7 purinergic receptor,P2X7R)作为P2X受体家族中的一员,具有促进肿瘤增殖、迁移和侵袭等作用[3-4]。目前已证实,P2X7R在乳腺癌中高表达[5],并且P2X7R影响乳腺癌发生和发展的机制也逐渐明确,但目前关于P2X7R在乳腺癌预后方面的研究鲜见报道。本研究从临床研究的角度出发,用免疫组织化学法检测P2X7R在乳腺浸润性导管癌、导管原位癌和乳腺癌旁正常组织中的表达情况,分析P2X7R与乳腺浸润性导管癌临床病理指标的关系并评估P2X7R的预后价值。
1 资料与方法
1.1 标本来源
选取2015年1月—2015年12月中国医科大学附属盛京医院临床资料齐全的乳腺浸润性导管癌石蜡标本170例,所有患者均行乳腺癌根治术,且术前均未接受放疗、化疗和内分泌治疗等。患者年龄范围为25~82岁,平均年龄52.7岁,中位年龄53岁。按乳腺癌病理分级Ⅰ级10例、Ⅱ级137例和Ⅲ级23例;按照美国癌症联合会(American Joint Committee on Cancer,AJCC)
第8版[6]TNM分期标准,Ⅰ期55例、Ⅱ期91例和Ⅲ期24例。本研究为保证预后信息的准确性,未纳入术前有远处转移的Ⅳ期乳腺癌患者。同时选取经病理诊断的50例乳腺导管原位癌和34例癌旁正常组织作为对照。所有患者均已签署知情同意书。
1.2 主要试剂和仪器
兔抗人P2X7R多克隆抗体(NBP1-32470)购自美国Novus Biologicals公司;鼠兔通用二步法检测试剂盒(PV-9000)和DAB显色试剂盒购自北京中杉金桥生物技术有限公司;组织切片机和光学显微镜购自德国Leica公司。
1.3 免疫组织化学法检测
将石蜡组织切片置于新鲜的二甲苯溶液中脱蜡20 min,随后经100%、95%和75%的乙醇溶液梯度各水化5 min,再行用自来水冲洗5 min;将组织切片置于pH=6.0的柠檬酸盐修复液中,使用高压锅隔水加热至排气后保持5 min进行抗原修复,冷却后用PBS冲洗切片;滴加内源性过氧化物酶阻断剂,室温孵育15 min,PBS冲洗切片;滴加一抗兔抗人P2X7R多克隆抗体(体积稀释比例为1∶500),于4 ℃冰箱孵育过夜;次日,复温后用PBS冲洗切片;滴加PV-9000反应增强液,室温孵育20 min,PBS冲洗切片;最后滴加二抗(辣根过氧化物酶标记的山羊抗小鼠/兔IgG),室温孵育20 min,PBS冲洗切片;滴加新鲜配制的DAB显色液,在光学显微镜下控制显色程度后行水洗,苏木素复染后再次水洗;风干后用中性树胶封固。用PBS替代一抗作为阴性对照。
1.4 结果判读
P2X7R主要表达在细胞膜上和(或)细胞质中,阳性呈棕黄色或黄色。盲法重复3次进行结果判读,用免疫组织化学评分来评价P2X7R的表达水平。按染色强度评分:阴性为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分;按肿瘤阳性细胞数占总细胞数的百分比评分:<10%为0分,10%~25%为1分,26%~70%为2分,>70%为3分。两者评分相乘即为免疫组织化学评分:其范围为0~9分,<4分为低表达组,≥4分为高表达组。此评分标准被广泛采纳用于各项研究中[7-9]。
同样用免疫组织化学法进行检测,发现雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)、p53和Ki-67均表达于细胞核上,各蛋白在细胞核上呈棕黄色即为阳性细胞。ER和PR阳性为肿瘤阳性细胞所占百分比≥1%;p53阳性为肿瘤阳性细胞所占百分比≥10%;Ki-67阳性为肿瘤阳性细胞所占百分比>14%。人类表皮生长因子受体2(human epidermal growth factor receptor-2,HER-2)定位于细胞膜上,阳性为细胞膜呈棕黄色,根据乳腺癌HER-2检测指南(2019版)为标准,HER-2的判读应先参考免疫组织化学法检测结果:0和1+(+)为阴性,3+(+++)为阳性,2+(++)需进一步行荧光原位杂交(fluorescencein situhybridization,FISH)检测,若FISH检测结果提示HER-2基因扩增,即为阳性。
1.5 随访
所纳入的乳腺浸润癌患者共有170例,在手术之后以电话、电子病历或辅助检查等方式进行追踪,其中失访15例,随访率为91.2%,随访时间6~65个月,中位随访时间为57个月。总生存(overall survival,OS)时间定义为从患者肿瘤确诊至死亡或随访截止的时间,无病生存(disease-free survival,DFS)时间定义为从患者手术日起至疾病复发、转移或患者死亡所间隔的时间。
1.6 统计学方法
采用SPSS25.0软件对数据进行统计学分析。采用χ2检验分别比较乳腺浸润性导管癌组织与导管原位癌组织和乳腺癌旁正常组织中的阳性率差异;并用χ2检验分析P2X7R表达水平与临床病理指标的相关性;采用Kaplan-Meier法及logrank检验进行生存分析;GraphPad Prism8.0软件绘制生存曲线;采用COX回归模型进行多因素分析。以P<0.05为差异有统计学意义。
2 结果
2.1 P2X7R在乳腺癌组织中的表达水平
免疫组织化学法检测结果(图1)显示,P2X7R主要表达在细胞质和(或)细胞膜上,在乳腺浸润性导管癌中P2X7R高表达者111例,高表达率为65.3%(111/170);在乳腺导管原位癌中P2X7R高表达者31例,高表达率为62.0%(31/50);在乳腺癌旁正常组织高表达者6例,高表达率为17.6%(6/34)。浸润性导管癌与导管原位癌的高表达率相比,差异无统计学意义(χ2=0.183,P>0.05);浸润性导管癌同乳腺癌旁正常组织的高表达率相比,差异有统计学意义(χ2=26.298,P<0.01)(表1)。上述结果提示,P2X7R在乳腺浸润性导管癌和导管原位癌组织中高表达,在乳腺癌旁正常组织中低表达。
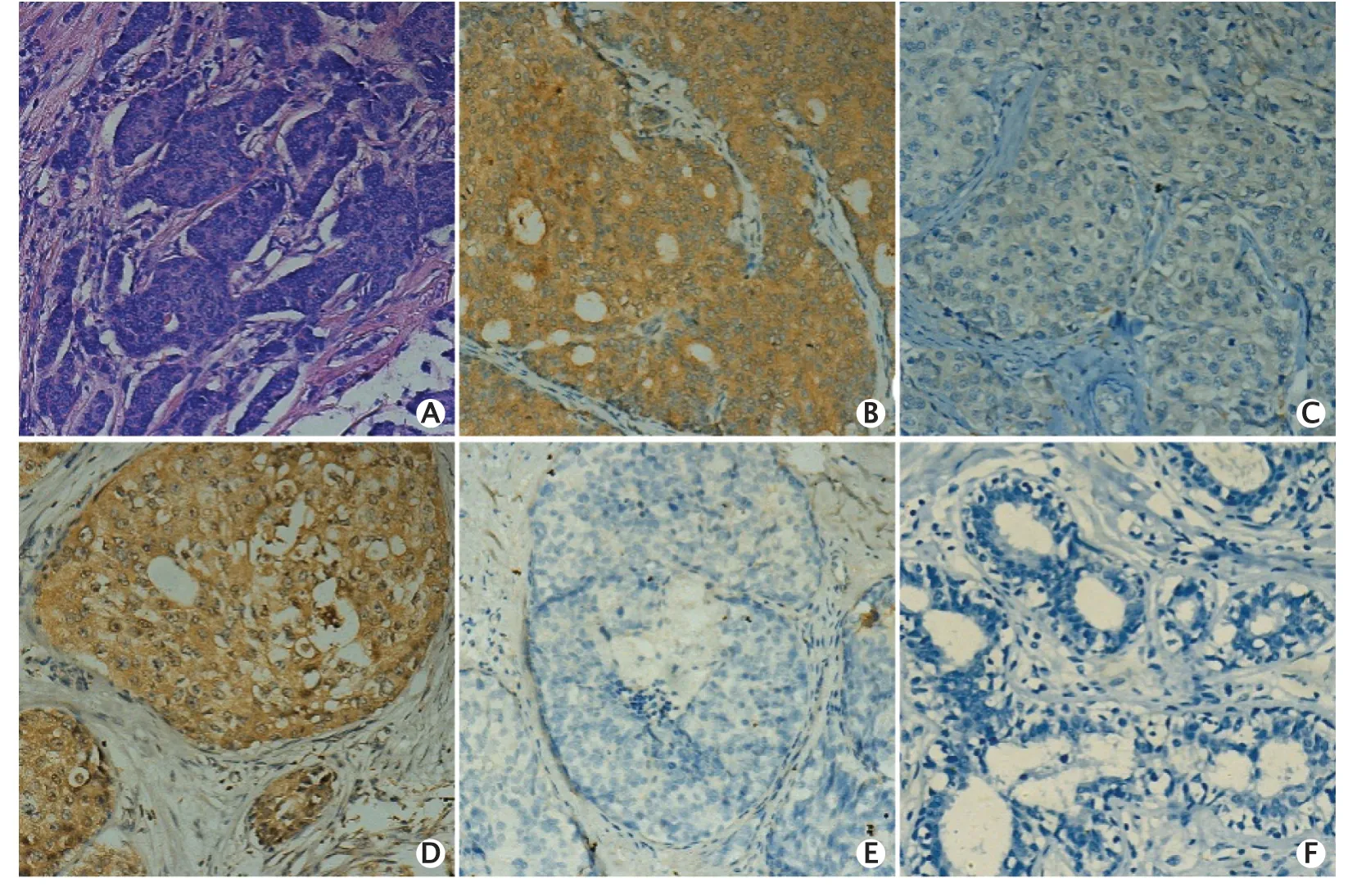
Fig.1 The HE staining result of invasive ductal carcinoma (A,×200) and the P2X7 purinergic receptor(P2X7R) expression in invasive ductal carcinoma (B-C),ductal carcinoma in situ (D-E) and paracancerous normal (F) tissues were detected by immunohistochemical staining (DAB staining,×200).B:High expression of P2X7R in invasive ductal carcinoma;C:Low expression of P2X7R in invasive ductal carcinoma;D:High expression of P2X7R in ductal carcinoma in situ;E:Low expression of P2X7R in ductal carcinoma in situ;F:Low expression of P2X7R in para-cancerous tissue.图1 乳腺浸润性导管癌的HE染色结果(A)和免疫组织化学法检测P2X7R在乳腺浸润性导管癌(B~C)、导管原位癌(D~E)和乳腺癌旁正常组织(F)中的表达水平
2.2 P2X7R表达水平与临床病理指标的相关性
对乳腺浸润性导管癌患者的临床病理参数进行统计分析。结果(表2)发现,肿瘤组织中P2X7R表达水平与患者的淋巴结转移(P=0.039)、TNM分期(P=0.045)、ER(P=0.024)和PR(P=0.033)存在相关性,在淋巴结转移、TNM分期Ⅲ期、ER阳性和PR阳性患者中P2X7R高表达率更高。淋巴结转移患者中P2X7R高表达率为73.68%(56/76),高于淋巴结无转移患者的58.51%(55/94);TNM分期Ⅲ期患者中P2X7R高表达率为83.33%(20/24),高于Ⅰ+Ⅱ期患者的62.33%(91/146);ER阳性患者中P2X7R高表达率为72.63%(69/95),高于ER阴性患者的56.00%(42/75);PR阳性患者中P2X7R高表达率为72.53%(66/91)高于PR阴性患者的56.96%(45/79)。P2X7R表达与患者年龄、肿瘤大小、组织学分级、HER-2、p53和Ki-67表达均无相关性。
2.3 P2X7R表达对乳腺浸润性导管癌患者预后的影响
本研究随访截止日期为2020年6月。170例患者中,发生骨转移、内脏转移或(伴)淋巴结转移者15例,皮肤转移者1例,同侧胸壁复发5例,对侧乳房复发12例,其中因复发转移而死亡10例。
用Kaplan-Meier法和log-rank检验分析P2X7R表达与乳腺浸润性导管癌患者OS和DFS时间的关系,结果显示P2X7R高表达患者OS时间较低表达患者短,但差异无统计学意义(P=0.099)(图2A);P2X7R高表达患者DFS时间较低表达患者短,差异有统计学意义(P=0.013)(图2B)。进一步对影响乳腺浸润性导管癌DFS时间的各个因素进行分析,在单因素分析中,肿瘤大小(P=0.002)、淋巴结转移(P=0.009)、TNM分期(P<0.001)、Ki-67(P=0.026)和P2X7R表达水平(P=0.013)与患者DFS时间显著相关,是影响乳腺浸润性导管癌患者DFS的危险因素。
COX多因素分析结果(表3)显示,TNM分期和P2X7R表达水平是乳腺浸润性导管癌患者DFS的独立预后因素。P2X7R高表达患者的不良预后风险是低表达患者的2.742倍。
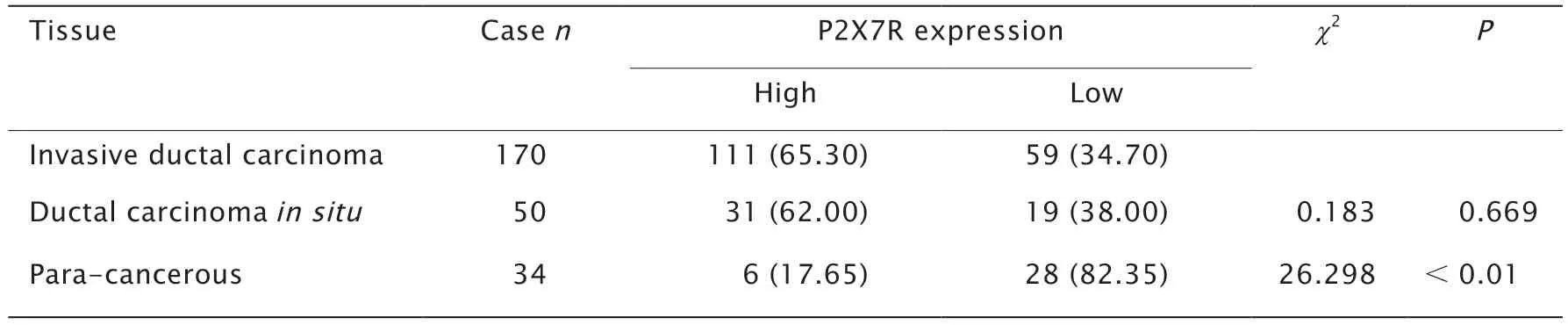
表1 P2X7R在乳腺浸润性导管癌、导管原位癌和乳腺癌旁正常组织中的表达水平Table 1 The expression of P2X7 purinergic receptor (P2X7R) in invasive ductal carcinoma,ductal carcinoma in situ and para-cancerous tissues n (%)
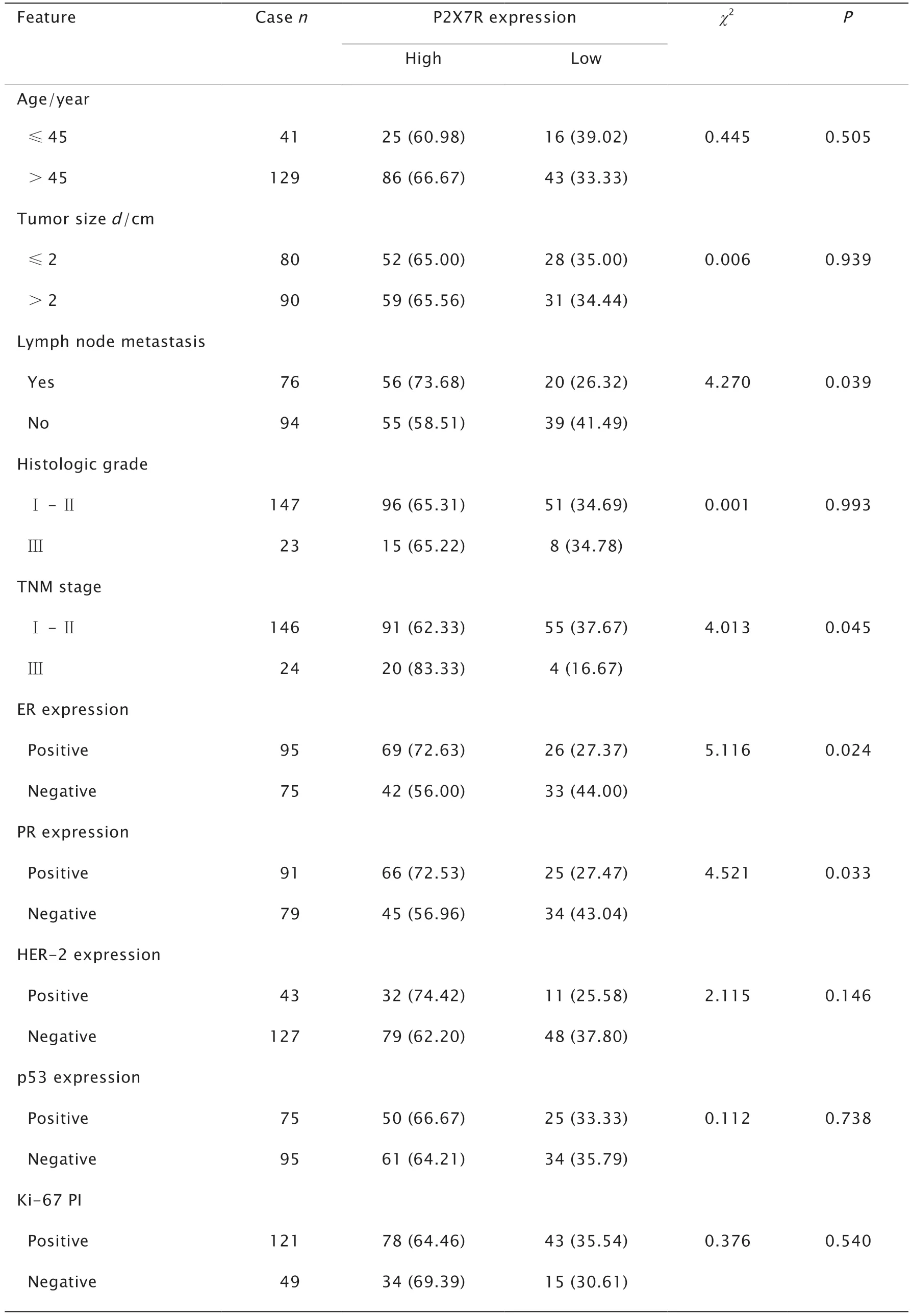
表2 P2X7R与乳腺浸润性导管癌患者临床病理参数的关系Table 2 Relationship between the expression of P2X7 purinergic receptor (P2X7R) and clinicopathological features of breast invasive ductal carcinoma[N=170,n (%)]
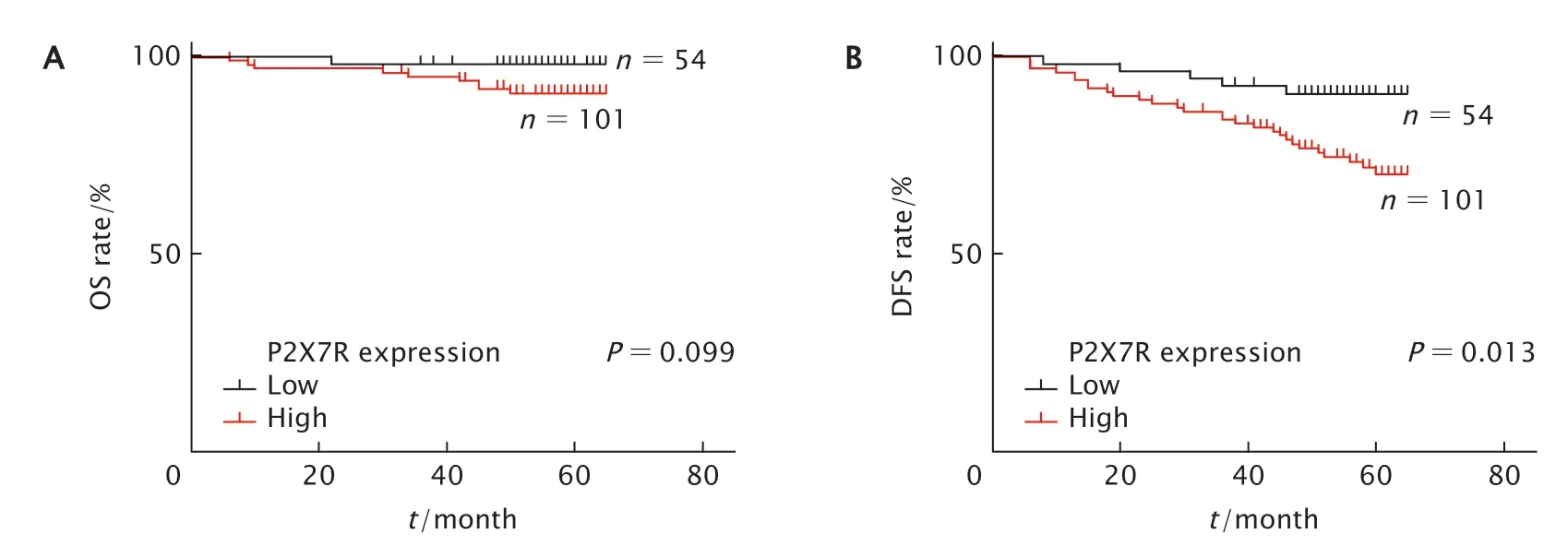
Fig.2 Kaplan-Meier plot for breast invasive ductal carcinoma patients with different expression of P2X7 purinergic receptor (P2X7R).A:Overall survival (OS) curves of breast invasive ductal carcinoma patients according to the P2X7R expression (P=0.099);B:Disease-free survival (DFS) curves of breast invasive ductal carcinoma patients according to the P2X7R expression (P=0.013).图2 Kaplan-Meier法分析P2X7R表达水平与乳腺浸润性导管癌患者OS(A)和DFS(B)时间的关系
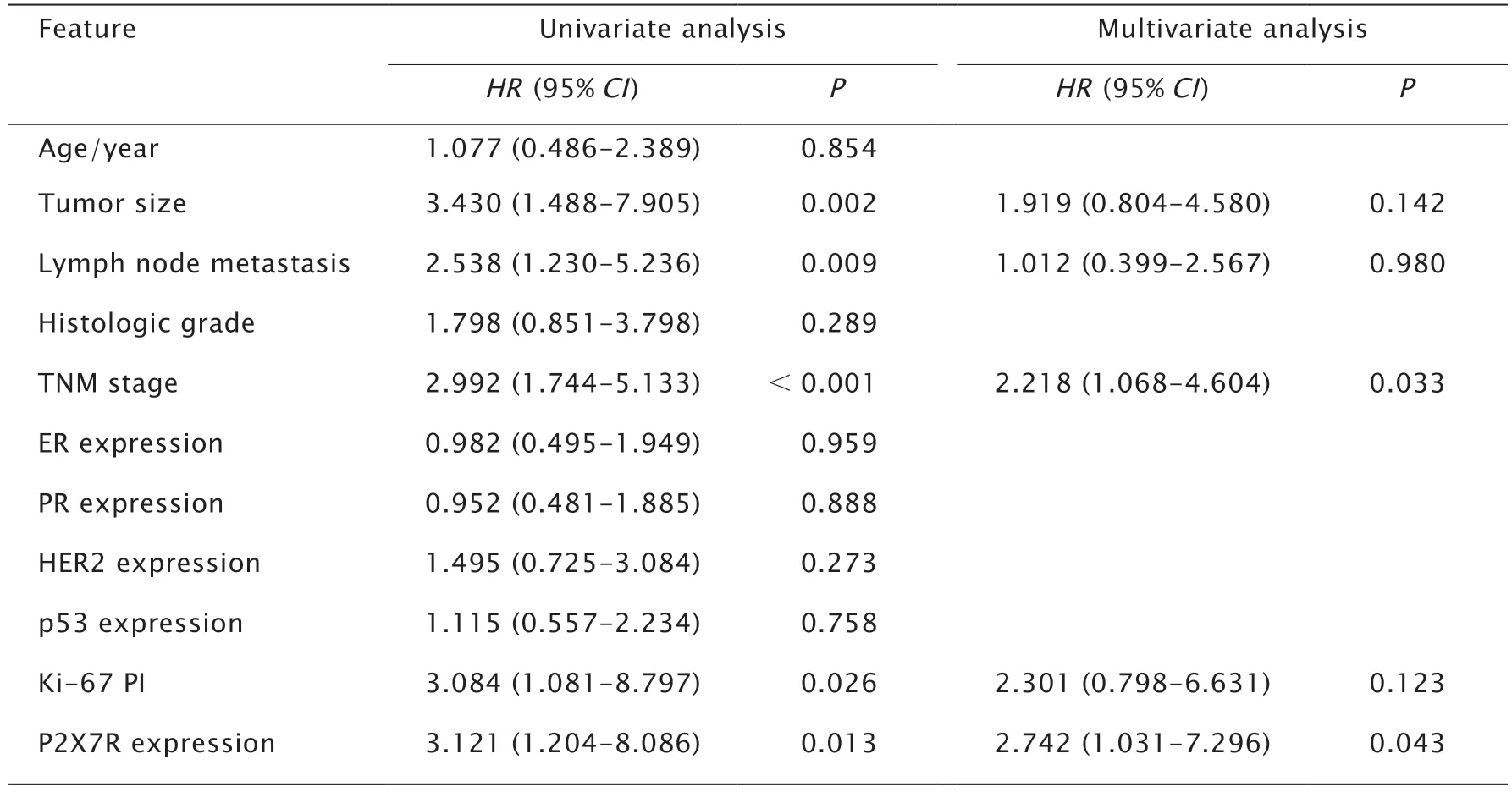
表3 影响乳腺浸润性导管癌DFS时间的单因素和多因素分析结果Table 3 The univariate and multivariate analyses of disease-free survival (DFS) in the patients with breast invasive ductal carcinoma
3 讨论
乳腺癌是女性高发的癌症,其治疗和预后受到广泛关注。乳腺癌的肿瘤大小、淋巴结转移状态、组织学分级、TNM分期、ER、PR、HER-2、p53和Ki-67等的表达水平在一定程度上影响了乳腺癌的治疗和预后。研究表明,乳腺癌与许多分子标志物密切相关,寻找乳腺癌的治疗靶点是目前的研究热点。P2X7R作为P2X受体家族中的一员,是嘌呤P2受体家族最独特的亚型[10]。ATP是P2X7R的天然配体,组织损伤、炎性反应和肿瘤等组织的微环境中ATP浓度升高,可刺激P2X7R活性上调,通过激活磷脂酶D(phospholipase D,PLD),促 进血管内皮生长因子(vascular endothelial growth factor,VEGF)的表达从而增加肿瘤血管的生成[11]。P2X7R还可上调精氨酸酶-1(arginase-1,ARG-1),转化生长因子-β1(transforming growth factor-β1,TGF-β1)及活性氧(reactive oxygen species,ROS)等的表达,从而促进肿瘤的生长[3]。P2X7R主要参与丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPKs)信号通路[12],其下游通路包括细胞外调节蛋白激酶(extracellular signal-regulated kinase,ERK)通路、p38丝裂原活化蛋白激酶(p38 mitogenactivated protein kinase,p38MAPK)通路、c-Jun氨基末端激酶/应激活化蛋白激酶(c-Jun N-terminal kinase/stress-activated protein kinase,JNK/SAPK)通路等3条信号通路。参与ERK通路引起核因子κB(nuclear factor kappa-B,NF-κB)的产生从而促进细胞的增殖和侵袭[4];通过激活凋亡相关蛋白caspase-1的表达,从而激活p38MAPK信号通路,促进乳腺癌的恶性进展;有研究证实,应用p38MAPK抑制剂可使p38MAPK蛋白水平降低,阻断其促进细胞增殖的效应,并引发乳腺癌耐药细胞凋亡[13];同时P2X7R参与JNK/SAPK信号通路引起c-Jun蛋白的磷酸化促进肿瘤细胞凋亡[14]。P2X7R还可通过蛋白激酶B(protein kinase B,PKB,又称AKT)信号通路降低乳腺癌细胞中E-钙黏蛋白的表达,并刺激基质金属蛋白酶13(matrix metalloproteinase-13,MMP-13)分泌从而促进乳腺癌的侵袭和迁移[15]。据最新文献报导,BRISSON等[16]通过建立小鼠乳腺癌模型,证实P2X7R促进小鼠乳腺癌细胞的侵袭性和肿瘤进展,并且使用P2X7R拮抗剂治疗小鼠乳腺癌是有效的,提出了P2X7R是乳腺癌抗癌治疗靶点的观点。
研究表明,P2X7R的表达具有多样性,在宫颈癌和子宫内膜癌组织中呈现低表达,发挥P2X7R的促凋亡作用,而在乳腺癌、结直肠癌、甲状腺癌、前列腺癌和神经母细胞瘤等组织中的表达明显上调,发挥其促增殖作用。本研究结果表明,P2X7R在乳腺癌中高表达,这与JUBB等[5]的研究结果相一致,同时发现P2X7R在导管原位癌阶段也呈现高表达,说明P2X7R在乳腺癌肿瘤的早期就已经发挥其作用,提示P2X7R不仅能促进肿瘤生长,也可能有致癌作用。以往的研究未曾探讨过P2X7R与乳腺癌临床病理指标的关系及其预后价值,本研究发现P2X7R与乳腺癌患者淋巴结转移状态、TNM分期、ER和PR表达水平相关。另外有研究指出,ER可调控P2X7R表达,ER与P2X7R表达呈正相关,可促进肿瘤的增殖[17],这与本研究的分析结果一致。同时本研究发现,P2X7R高表达的乳腺癌患者较低表达患者DFS时间更短,预后更差,术后可能更易出现复发或转移。而在结直肠癌中,有研究指出P2X7R高表达的患者其生存期更短,预后更差,且P2X7R的表达也与淋巴结转移状态和TNM分期相关[7-9],这些研究结果都提示P2X7R高表达可能会促进肿瘤的迁移和侵袭,造成患者的预后不良。在本研究中P2X7R高表达的乳腺癌患者OS时间较低表达患者短,但差异无统计学意义,分析其原因可能与选择的对象有关,研究对象中未纳入TNM分期Ⅳ期乳腺癌患者,以至于患者术后5年生存期相对较长,死亡率相对较低。此外,乳腺癌患者大多定期复查并及时有效治疗,与其他肿瘤相比,乳腺癌的5年生存期也较长。研究P2X7R对乳腺癌患者OS的影响可能需要继续随访,进一步观察P2X7R是否影响患者的远期生存率。
本研究证实了,P2X7R在乳腺浸润性导管癌和导管原位癌中均高表达,其中P2X7R在导管原位癌中高表达,提示其具有促癌作用。由于乳腺癌的预后较差,容易复发转移,而临床上淋巴结可能出现跳跃转移现象,加上淋巴转移灶微小,可能导致一些有高转移风险的或隐匿的微小乳腺癌未被发现,而出现对乳腺癌的预后评估造成误判的情况。而本研究通过分析乳腺癌患者术后DFS时间,发现P2X7R高表达的患者发生不良预后的风险是低表达患者的2.742倍,提示P2X7R也可作为辅助判断乳腺癌预后风险的指标,可能对预测乳腺癌的预后具有重要的指导意义。
综上所述,P2X7R在乳腺癌中高表达,其表达水平与乳腺癌患者淋巴结转移状态、TNM分期、ER和PR表达水平存在相关性。P2X7R可预测乳腺癌复发转移的风险,可能是乳腺癌不良预后的潜在生物标志物。

