探讨肺动脉高压大鼠心肌损伤与氧化应激损伤的相关性研究
翟子敬 秦文娟 王 臻 郭雪婷 王 忠 芦桂林
1 石河子大学,石河子大学医学院(石河子 832008)2 石河子大学医学院第一附属医院超声医学科(石河子 832008)3 石河子大学医学院第一附属医院心内科(石河子 832008)
肺动脉高压(PAH)是由于肺血管的进行性改变而导致肺动脉压力的增加[1]。PAH时,右心室室壁代偿性增厚,加重时,右心室扩张,最终导致右心功能衰竭[2]。而PAH右心室心肌氧供—需失匹配是右心室重构及右心衰发展过程中的重要病理生理基础[3],所以氧化应激机制在疾病进展过程中有着重要的作用。同时超声心动图作为简便有效的检查手段可实现对心脏结构和功能的动态监测[4]。本文旨在探讨应用超声心动图评价PAH造成的右心损害的临床价值以及PHA造成右心损害的氧化应激机制,对临床诊断的进一步研究提供了有效的实验依据。
1 材料与方法
1.1 实验动物及分组
随机选择:48只雄性12周龄、且处于清洁级的SD大鼠,均来自于北京维通利华实验动物技术有限公司,[动物合格证号:SCXK(京)2012- 0001],并经石河子大学伦理委员会批准,同时提供:动物生存房间内:温度适宜20~25 ℃,湿度良好为50%~55%。各组大鼠分笼喂养,给予标准词料,自由进食水,环境安静。
1.2 主要使用试剂和仪器
野百合碱(Monocrota-line,MCT,美国,Sigma公司);GEVivid E9彩色多普勒超声诊断仪,超低温 4 ℃ 离心机(美国,Thermo公司);倒置相差显微镜(日本,Olympus公司),以及全自动Bio-rad酶标仪(美国,Biorad公司);购买超氧化物歧化酶(superoxidedismutase,SOD)试剂盒以及还原型谷胱甘肽(reducedglutathione,GSH)、丙二醛(malondialdehyde,MDA)试剂盒,各试剂盒均来自于南京建成生物工程研究所。
1.3 方法
1.3.1 动物分组随机取48只SD雄鼠,(220±20)g,分为PAH 2周组(1%的MCT溶液腹腔一次性注射60 mg/kg)、PAH 4周组(1%的MCT溶液腹腔一次性注射60 mg/kg)、NaCl对照组(腹腔注射生理盐水)及空白对照组(不做处理),普通喂养,自由进食,每组12只,每日观察,其中PAH组包括PAH 2周组及PAH 4组,对照组包括空白对照组及NaCl对照组。
1.3.2 超声检测采用GE Vivid E9彩色多普勒超声诊断仪,频率为:12 MHz,探头为:12S,其扫描速度为:100 mm/s。10%水合氯醛(0.35 mL/100 g)腹腔注射,麻醉大鼠,之后,于仰卧位的左胸缘,在大鼠心尖四腔心切面测量右心室室壁厚度(RVWT)、右心室舒张末期横径(RVEDD),并于大动脉短轴切面测得肺动脉瓣血流前向加速时间(PAAT)。大鼠心率较快,大约为300~400次/min,所以每组均需连续取10个心动周期而求取平均值。
1.3.3 记录左、右心室质量指数及右心室肥大指数大鼠处死后,取心肺组织,剥离除左、右心室外其它组织,之后分离右心室游离壁(right ventricular,RV)与室间隔+左心室(interventricular septum+left ventricular,IVS+LV),采用生理盐水冲洗,并用滤纸吸水,之后称重,计算右心室质量指数RVMI=RV/体质量(BW),右心室肥大指数RVHI=RV/(IVS+LV)。
1.3.4 大鼠肺脏病理的观察取左叶肺脏,进行常规HE染色,并在光学显微镜下观察肺脏改变。
1.3.5 取右心室心肌组织进行HE染色,经水洗、乙醇梯度脱水与二甲苯透明后,再通过浸蜡与包埋等制片过程之后由苏木精染色、分化、返蓝、梯度脱水和封片,最后分析由每只大鼠取得的右心室心肌各10张切片,观察右心室心肌。
1.3.6 右心室胶原纤维的Masson染色取出原固定于4%多聚甲醛溶液中的右心室组织,脱水之后,经过二甲苯透明,以及石蜡包埋等步骤后,再进行冠状位厚度为5 μm的切片固定,之后进行石蜡切片,随后脱蜡,并按顺序用自来水和蒸馏水水洗,之后采用Regaud苏木精染液,进行染核5~10 min,之后充分使用水洗,再将切片放在丽春红酸性复红液中,染色8 min后,浸洗在冰醋酸水溶液中,再之后放入磷钨酸,直接用苯胺蓝5 min,最后,经过脱水透明后封片。最终使用倒置显微镜观察各组心肌间质胶原纤维分布的情况。
1.3.7 心肌组织细胞中SOD活力和GSH、MDA水平取右室心肌组织剪碎,并由超声机粉碎,进而制备成10%的心肌组织匀浆液,然后经过1 000 r/min离心10 min;之后取上清液,重复3次检测超氧化物歧化酶(SOD)活力,还原型谷胱甘肽(GSH)和丙二醛(MDA)的水平。
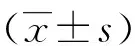
2 结 果
2.1 超声心动图检测结果
与对照组比较,PAH右心室结构及血流参数的变化:右心室壁显著增厚及肺动脉瓣血流前向加速时间缩短,同时PAH 4周期组较PAH 2周组变化明显。右心室横径在PAH 4周组变化明显(P<0.05)。见表1、图1、图2。
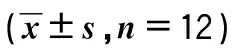
表1 超声心动图检测大鼠右心室心功能参数
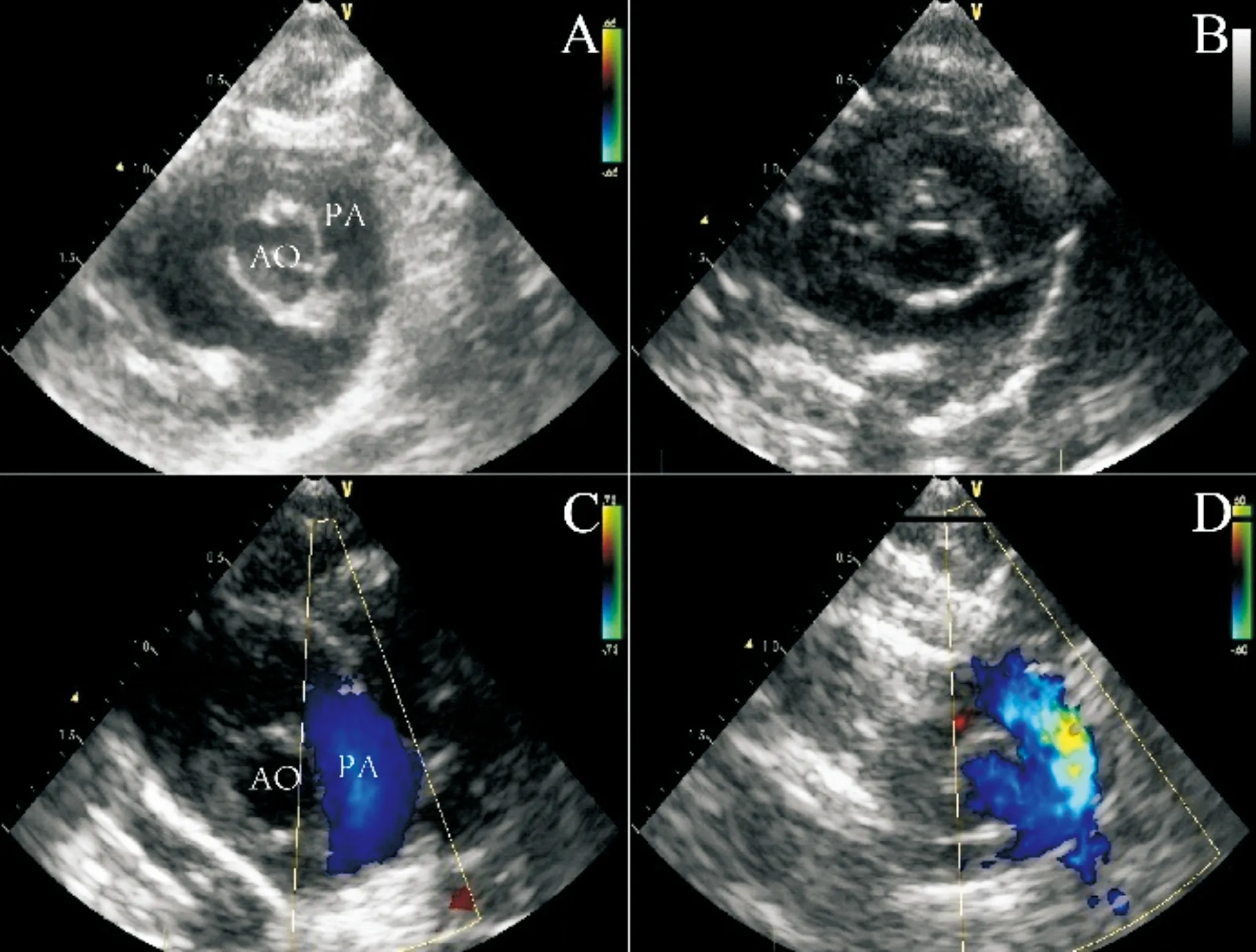
图1 大鼠胸骨旁大动脉短轴;PA 表示肺动脉;AO表示主动脉;A: 对照组;B: PAH 4周组
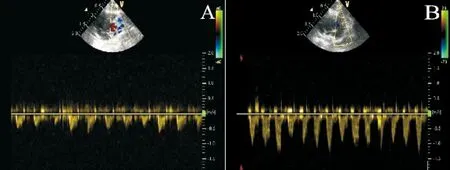
图2 大鼠肺动脉频谱;A: 对照组;B: PAH 4周组
2.2 各组大鼠一般状况及RVHI、RVMI的变化
对照组大鼠进食与饮水正常,毛发正常有光泽,体质量随时间逐渐增加,而PAH组大鼠较对照组进食饮水量减少,大鼠逐渐表现出体毛变暗淡、呼吸变急促、行动反应较迟钝等表现,体质量显著减轻且活动度显著减低,同时PAH 4周期组较PAH 2周期组变化明显。实验过程中均无大鼠死亡。经野百合碱干预4周后,与对照组比较,PAH周组RVHI与RVMI明显升高,造模成功,同时PAH 4周期组较PAH 2周期组变化明显,差异均有统计学意义(P<0.05)。见表2。
2.3 肺组织病理改变及大鼠肺中小型动脉比较
于光镜下观察HE染色后,肺组织中肺小型动脉结构可显示:在对照组大鼠肺小型动脉中,内皮细胞薄厚程度表现一致,其分布较为均匀且连续,周边未见明显炎性细胞;然而PAH组大鼠的肺小型动脉表现为:形态不规整,内皮细胞的连续性紊乱不整齐,部分内缘呈嵴状突向血管腔内,血管壁明显增厚,并且管腔面积明显变小,同时伴随血管周围的炎症改变,且PAH 4周组较为明显。
表2 对照组及PAH组大鼠LVHI、RVHI、RVMI的比较
2.4 右心室病理改变
PAH组心肌细胞较对照组明显肥大,心肌间隙明显较之前增宽,且PAH 4周组较为明显。
2.5 光镜下观察大鼠右心室心肌胶原纤维的变化
Masson染色显示,对照组大鼠心肌肌间隙较窄,并清晰可见,且心肌细胞紧密排列,间隙内可见到少量蓝染的胶原纤维,分布稀疏,且着色淡。PAH组大鼠右心室心肌间隙明显较之前增宽,且部分心肌间质与胶原纤维呈现出紊乱的栅栏样排列,纤维数量显著增多,且PAH 4周组较为明显。
2.6 大鼠右心室心肌组织细胞中SOD活力、GSH和MDA水平的变化
PAH组大鼠右心室心肌组织细胞中SOD活力、GSH和MDA水平的变化较对照组SOD活性和GSH水平降低,MDA水平上升,同时PAH 4周期组较PAH 2周期组变化明显,差异均有统计学意义(P<0.05)。见表3。
表3各组大鼠心脏组织细胞中SOD活力、GSH和MDA水平
2.7 超声心动图参数与氧化应激的相关性研究
RVWT与SOD呈极负相关(r=- 0.746,P<0.01),与GSH呈极负相关(r=- 0.746,P<0.01),与MDA呈极正相关(r=0.756,P<0.01)。RVEDD与SOD呈极负相关(r=- 0.848,P<0.01),与GSH呈极负相关(r=- 0.855,P<0.01),与MDA呈极正相关(r=0.825,P<0.01)。PAAT与SOD呈极正相关(r=0.980,P<0.01),与GSH呈极正相关(r=0.979,P<0.01),与MDA呈极负相关(r=- 0.980,P<0.01)。见表4。

表4超声心动图参数与氧化应激的相关性研究
3 讨 论
肺动脉高压(PAH)是由平滑肌细胞和基质蛋白的沉积等异常的结构改变,并且随着血管过度收缩,从而造成了肺血管的进行性改变,同时肺血管阻力及肺动脉压力的增加,继而出现了右心室的一系列病变,最终导致右心室出现衰竭[5]。目前,MCT诱导PAH大鼠已广泛应用于对PAH造成右心室损伤的研究中。本研究表明了MCT可特异性损伤肺动脉血管内皮细胞、毛细血管及肺小动脉壁,以及出现明显的炎性细胞大量浸润,从而造成了肺中小血管管壁增厚,并管腔狭窄,继而出现较为明显的血管重构及小动脉内血栓的形成,以及肺血管阻力增大,从而可造成右心室做功增加,研究结果与Liu等研究结果一致[6],同时表明造模成功。
超声心动图以其简便、快捷、可重复性的特点,在心脏损害的诊断过程中起着重要的作用。本实验表明,PAH组小鼠的右心室结构及血流变化较对照组变化明显,且PAH 4周组RVWT与PAAT变化明显于PAH 2周组,RVEDD仅在PAH 4周组变化明显,这与PAH病理变化表现一致,当发生PHA时,肺动脉血流速度明显加快,肺动脉瓣前向血流加速时间缩短,右心室后负荷增大,右心室结构的代偿性肥厚、扩张,将导致右心室搏出量的逐渐降低,甚至右心功能不全,因此超声心动图的对应参数可较准确评估PAH造成的心脏损害,对临床评估PAH造成的心脏损害有着重要价值[7]。
右心室随着PAH的进行性病变而出现了右心室重构现象,表现为右心室心肌细胞的体积变大,重量增加以及心肌间质纤维化,且胶原纤维出现增多积聚。本实验结果显示PAH组大鼠右心室随着时间延长,心肌细胞肥大,心肌肌间隙增宽,胶原纤维显著增多,并且呈栅栏样紊乱排列。同时RVHI与RVMI明显升高,都表明了PAH组大鼠心肌细胞在氧化应激、炎性细胞浸润等机制下随着右心室后负荷增加而出现了逐渐代偿性增大的现象,本研究结果与范志茹等研究结果相一致[5, 8]。
PAH形成后,随着右心室病变持续进展,右心室室壁会逐渐增厚,增厚的室壁会由于对氧的需求量明显改变,耗氧量会逐渐增加,而供氧量却逐渐减少,从而造成右心室的机械运动效率减少[9-10]。同时会诱发机体中氧化应激损伤活性氧(ROS)的过量产生,因而会造成多种细胞大分子出现损伤,从而会改变细胞信号的传导,最终将引起细胞的凋亡,因为ROS在体内会受到SOD、GSH-PX以及CAT的催化后失活而被机体清除,因此这些酶在一定程度上可以保护机体免受自由基的损伤[11]。SOD活性下降会导致细胞膜的脂质产生过氧化损伤,继而生成大量的MDA,与蛋白质和核酸交联,破坏其正常的结构构型,最终将会影响其原有特征和功能,从而加重细胞损伤[12]。本实验结果显示,PAH组大鼠右心室心肌细胞SOD、GSH、CAT活性出现了明显降低,MAD活性显著升高,且随着时间延长有升高的趋势。此结果进一步证明PAH会通过ROS的过量产生而对右心肌细胞造成一定损害,这与杨文莉等的研究一致,同时也表明了氧化应激机制在PAH造成右心功能不全进展中发挥着巨大的作用[13]。同时,通过对超声心动图的相关参数与氧化应激指标进行相关性分析,我们发现超声心动图与氧化应激有着显著的相关性。
目前对用超声评价右心室结构及功能尚处于早期,其临床应用价值仍需进一步证实,针对PAH患者右心室损伤机制的研究仍较少,缺乏指南指导。同时本实验的不足之处在于小鼠心率较快,超声心动图的测量值也依赖于检查医生的水平,主观差异性较大,同时标本量较少,需要进一步研究,为临床提供更大的应用价值。

