SEER数据库中晚期三阴性乳腺癌的危险因素及预后分析
叶 晔 费伟强 冯 冠
1 杭州职业技术学院 (杭州 310018) 2 浙江金融职业学院(杭州 310053)
乳腺癌是一种严重威胁女性健康的常见恶性肿瘤。相关统计显示,2019年在欧美等发达地区,预估新增的乳腺癌患者将达到27万人次[1]。三阴性乳腺癌(TNBC)由于缺乏雌激素受体(ER),孕激素受体(PR)和人表皮生长因子受体2(HER2)的表达[2- 3],尽管TNBC仅占BC的15%~20%,但与BC的其他亚型相比,TNBC的复发率更高[3- 5]。此外由于缺乏分子靶标,靶向治疗在TNBC患者中几乎无效[6- 7]。因此,全身性化疗仍是TNBC的最常用手段,但由于耐药性,TNBC在辅助治疗后很快复发[8]。由于TNBC高度异质性[9- 10],个体化治疗逐渐受到青睐,包括患者的年龄、性别、种族、手术、化学疗法等。
本研究中,我们从美国SEER(surveillance, epidemiology, and end results)数据库中提取了2011年至2016年的晚期TNBC患者的病例,分析了其临床特征和预后因素。进一步根据生存分析的结果,构建了晚期TNBC患者的预后列线图,预测了患者3年及5年的预后。
1 材料与方法
1.1 一般资料
本研究通过SEER*Stat软件(v8.3.5, http://seer.cancer.gov/seerstat/software)从SEER数据库(http://seer.cancer.gov/)中下载了2011年—2016年的所有乳腺癌患者病例。我们提取了患者的种族、年龄、分子分型、分化程度、组织学分类、分期、手术、放疗、化疗、生存时间等变量,分析了不同分子分型的临床特征及预后差异。
纳入标准:①诊断年份在2011—2016年间;②根据JACC指南,为原发性III、IV期三阴性乳腺癌;③年龄、种族、生存时间等基本信息完善者。
排除标准:①分子分型不明确者;②病理类型不明确者;③分化程度不明确者;④I、II期乳腺癌;⑤转移性乳腺癌。
1.2 统计分析
方差分析,卡方检验和秩和检验用于比较Luminal A,Luminal B,Her2和BC三阴性亚型的临床特征。 对数秩检验用于比较BC患者不同分子亚型的OS差异。 单变量分析用于分析TNBC的临床特征与OS之间的相关性,并使用Kaplan-Meier方法绘制生存曲线。 我们将单因素分析中P<0.05的危险因素纳入多因素分析。 多元逻辑回归分析用于通过Cox比例风险回归分析确定OS的独立预测因子。
应用单因素方差分析、卡方检验和秩和检验Kruskal-Wallis法比较Luminal A、Luminal B、 HER2+和TNBC之间的临床特征,应用Log-rank检验比较不同分子亚型乳腺癌患者之间OS差异,应用单因素和多因素Cox比例风险回归模型分析临床特征与总生存期(Overall survival,OS)之间相关性。根据多变量分析的结果,应用R(3.6.1)制定列线图,并通过校准曲线检验和C指数(C-index)评估已建立的列线图[11- 12]。本研究统计分析应用SPSS 22.0 和GraphPad Prism 6.0软件,所有分析采用双边95%可信区间,P<0.05为差异有统计学意义。
2 结 果
2.1 Luminal A、Luminal B、HER2+和TNBC之间的临床特征比较
经筛选后,我们共纳入晚期TNBC患者4 687例(图1),此外Luminal A 18 747例,Luminal B 4 871例,HER2+2 659例。经分析发现,各分子分型患者在种族、年龄、分化程度、病理类型、OS、手术、以及化疗、转移状况均存在统计学差异(表1)。其中在年龄上,Luminal A患者的发病年龄要大于其他三型;白种人在Luminal A中的发病率最高,而在TNBC患者中发病率最低,黑种人则在TNBC的发病率最高,而在Luminal A中发病率最低;分化程度上,HER2+和TNBC低分化的几率高于其他两型,而Luminal A的中分化和高分化的比例高于其他分子亚型;在原发灶手术和化疗上,TNBC接受手术治疗的程度更高,而HER2+接受化疗的程度较高;在肿瘤转移上,Luminal A易发生骨转移,HER2+易发生脑转移和肝转移,TNBC易发生脑转移和肺转移;在生存期上,生存分析进一步显示TNBC的生存期明显低于其他三型(图2),中位生存时间分别Luminal A为32.0个月(30.6~33.4)、Luminal B为44.0个月(40.5~47.5)、HER2+为32.0个月(28.5~39.5)、TNBC为12.0(11.3~12.7)个月,差异存在统计学意义(P<0.001)(表1)。
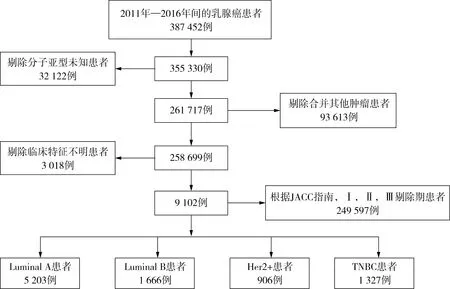
图1 晚期TNBC患者筛选流程图
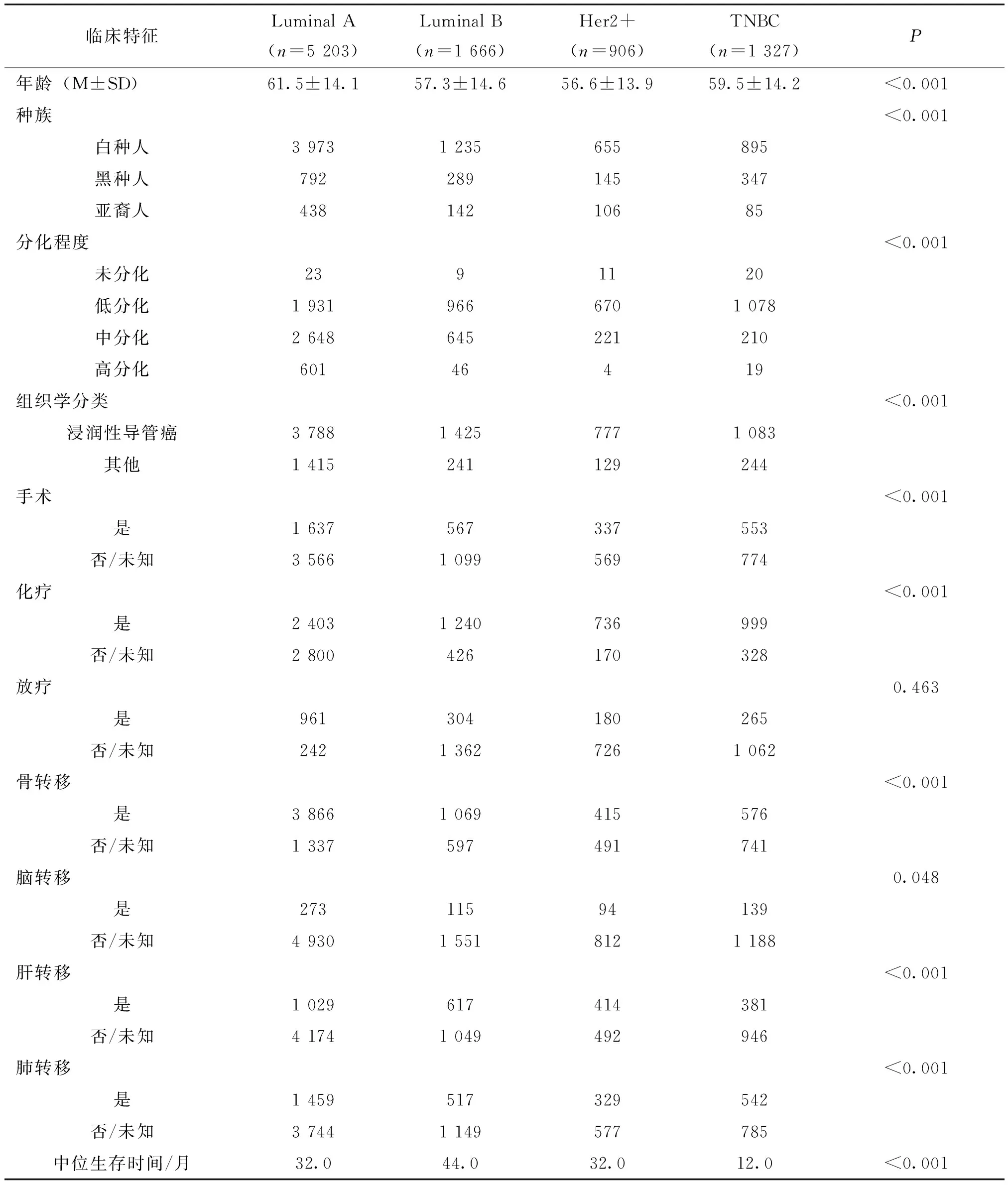
表1四种亚型乳腺癌的临床病理特征比较

图2 四种分子分型乳腺癌的生存曲线
2.2 晚期TNBC预后的单因素分析
采用单因素分析对晚期TNBC患者的预后影响因素进行研究发现,年龄、性别、分期、治疗方式和器官转移与预后的相关具有统计学差异(P均<0.05)(图3)。年龄越大,总分期越高,存在器官转移的患者预后较差。此外,单因素分析结果表明,接受放化疗的患者预后较未接受放化疗的患者预后更好,未接受手术的患者较接受手术的患者预后更差。而种族(P=0.138)、分化程度(P=0.407)与预后的相关性无统计学差异。
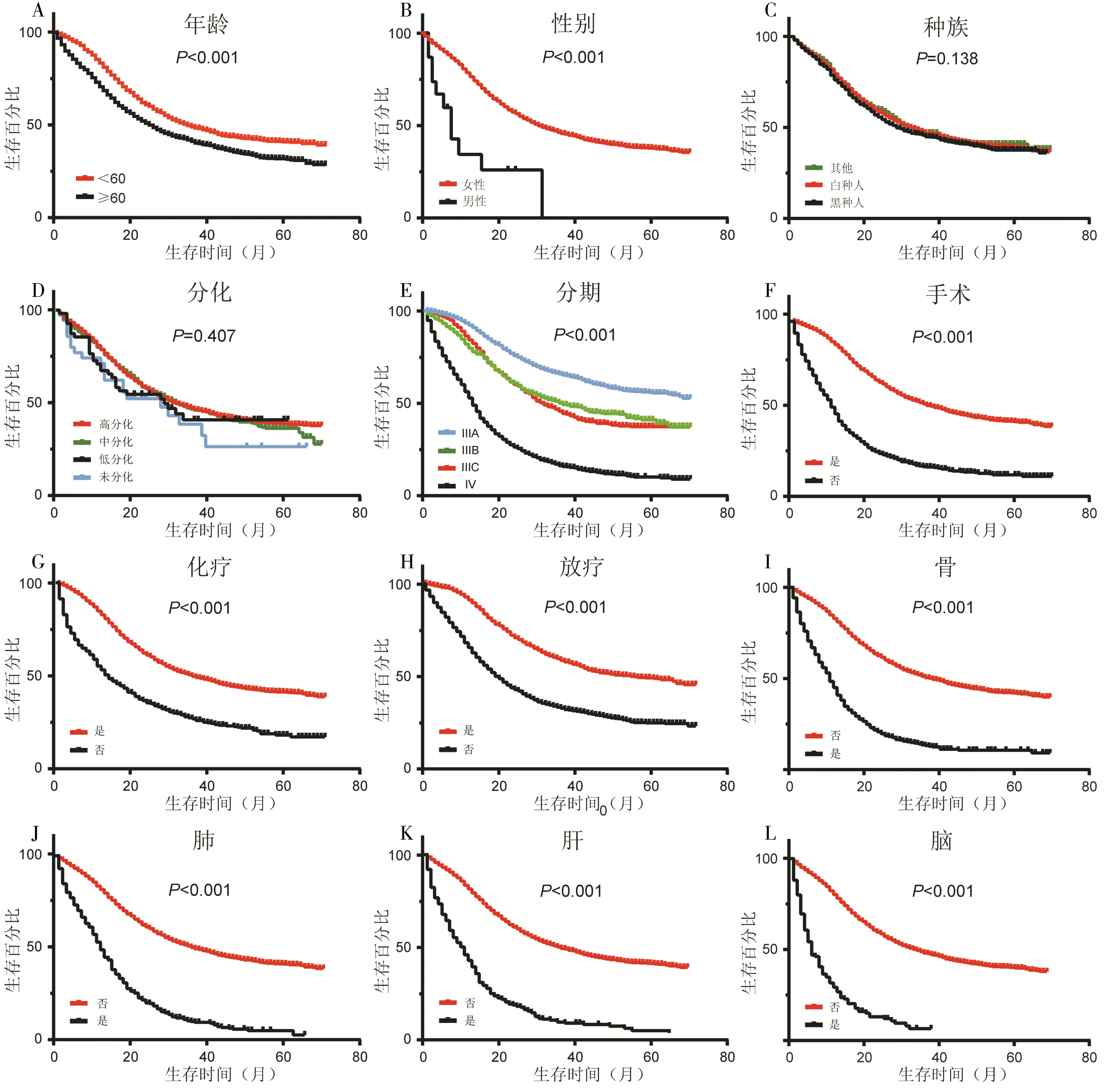
图3 晚期TNBC患者单因素分析
2.3 晚期TNBC预后的多因素分析
将单因素量分析的统计变量进行多因素分析,发现年龄、种族、性别、分期、手术、化疗、放疗和器官转移是患者的独立预后因素(P均<0.05),但分化程度除外(P=0.485)(表2)。多因素分析仍显示年龄越大,总分期越高,出现器官转移,未接受手术、化疗、放疗的患者预后较差。但不同的是,多因素分析结果显示种族是预后的独立影响因素,即与黑种人相比较,白种人和其他种族晚期TNBC人群的预后更好。

表2晚期TNBC患者预后的多因素分析
2.4 晚期TNBC列线图制作
最后,我们基于多因素分析中的所有独立影响因子构建了列线图(图4),每个独立因素对应一个数值,依据患者的实际状况,我们可计算出患者的3年及5年生存率。经区分度检验,这一列线图的C-index为0.75(95%CI,0.71~0.79)。一致性检验显示,列线图所预测的生存率与实际的生存率具有较好的一致性,其曲线斜率接近于1(图5)。

图4 晚期 TNBC 3年及5年生存率列线图
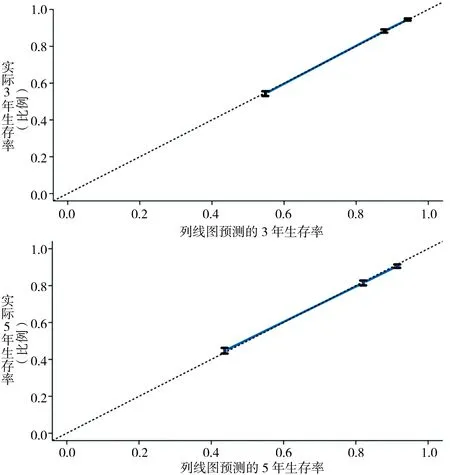
图5 晚期TNBC 3年及5年校准曲线
3 讨 论
乳腺癌是女性好发肿瘤之一,随着我国的生活饮食方式改变及环境的变化,乳腺癌的发病率正在逐年增加[13-14]。本研究中,我们对美国SEER数据库中2011年—2016年期间晚期TNBC乳腺癌患者的危险因素进行分析,并根据危险因素绘制诺模图。相关研究表明,列线图已用于多种肿瘤的预测[15-17]。Lin[15]等人把临床和实验室数据相结合,发现BC家族史、位置、组织学等级和实验室指标是TNBC患者的预测因素。Yang[17]等人根据基质TIL、肿瘤大小、淋巴结状态和Ki67指数构建了TNBC的预后。但是,所有这些研究均未包括器官转移和肿瘤分期的危险因素,因此我们将这些因素也考虑至构建列线图中。
图2中显示,与非TNBC相比,TNBC患者的预后最差,相关研究[5,18-19]也表明,TNBC患者与肿瘤侵袭性行为和较差的预后相关。由于TNBC患者缺乏有效标靶[6- 7,20],因此不存在特异性靶向治疗。此外,一项Meta分析[21]显示,TNBC患者更可能缺乏肿瘤抑制因子BRCA1[22](breast cancer 1 protein),这些特征可能是TNBC预后不良的原因。
患者确诊时的年龄是影响乳腺癌预后的一项重要因素[23],我们的研究表明,老年患者(≥60岁)较年轻患者(<60岁)的预后差(P<0.001),奇怪的是,与其他亚型相比,年龄在40岁以下的TNBC患者的OS较差[24- 25]。因此,可以考虑细化年龄分组,可能会有不同的预后结果,对患者起到评估和预测作用。众所周知,TNBC的非裔人群在所有人群中的预后最差[26- 27]。非裔人群的TNBC是否是一种与遗传相关的疾病是一个长期的热点,Telonis等人[28]发现TNBC和正常乳腺组织之间的转录的不同可能是造成存活率差异的主要原因。但是,Ademuyiwa等人[29]通过分析TNBC患者的临床特征、肿瘤细胞突变和基因表达,发现不同种族TNBC患者的分子特性和临床特征无差异。总之,改善TNBC非裔人群的预后需要更多的关注。
手术、全身化疗和放疗仍然是TNBC的主要治疗方法,我们的结果还表明,与未接受这些治疗的TNBC患者相比,这些治疗措施与更长的OS相关(P<0.001)。乳腺癌有多种手术方式,但是,其发展侧重于微创治疗和美学,以实现最小的创口和美观效果。保乳手术(BCS)是乳腺癌最具代表性的手术方式[30],但是,多项研究显示,将BCS应用于TNBC的治疗仍待商榷[31- 32]。一项回顾性研究分析了1 533例BSC患者的临床特征,无局部复发生存率(LRFS)和OS,发现与非TNBC患者相比,TNBC患者的局部复发率低且结局相似[33]。遗憾的是,我们的数据并没有记录具体的手术方式,因此,尚不能深入探讨术式对TNBC患者预后的影响。
化疗仍是全身疗法的主要方法,结果显示化疗是TNBC的独立危险因素,许多研究表明,化疗可以改善TNBC患者的预后[34- 35]。Lironne Wein和Sherene Loi发现,染色体不稳定性、遗传异质性、新辅助化疗、免疫微环境、Ras-MAPK途径和免疫逃逸是导致TNBC耐药的原因[8],因此对于TNBC患者的治疗充满挑战。放疗可以有效控制局部症状并降低局部复发可能性,其主要应用于BCS术后,根治性乳房切除术后,远端转移的姑息性治疗等[36]。 Chen等人[37]评估了放疗与TNBC患者预后之间的相关性,发现乳房切除术后放疗对4个以上阳性淋巴结的TNBC患者有益。此外,Wang等人[38]的一项临床试验比较了乳腺切除术后接受放疗和未接受放疗的TNBC患者之间的生存差异,结果表明与仅接受新辅助化学疗法的患者相比,接受新辅助化疗和放疗的患者与更长的OS相关。尽管放疗能改善TNBC患者的预后,但仍需要更多高质量的研究来支持这些结果。因此,对于临床医生而言,正确评估患者的病情以确定最适合患者的治疗方法显得格外重要。
骨、肝、肺和脑是乳腺癌最常见的远处转移部位[4,39],在癌症的晚期阶段,与患者的预后密切相关。因此,对早期诊断的BC的进展预测和管理非常重要。 Nicolini A等人[40- 41]认为血清肿瘤标志物是BC患者术后监测的重要因子,定期影像学检查也是常见的手段。近期,有种新技术通过检测循环肿瘤细胞(CTC),可预测早期肿瘤的发生和转移[37,42]。由于CTC来源肿瘤原发部位或转移的肿瘤组织,在健康人中很少检测到[43- 44]。此外,一项前瞻性研究显示,CTC与是无复发生存期(RFS)和OS相关的独立影响因素[45]。
然而,此项研究中也存在一些局限性。首先,虽然能在SEER数据库中获得有关放疗和化疗的信息,但放化疗的具体方案并不完善;其次,此数据库缺乏肿瘤标志物,影像学检查和重要分子因素(BRCA1 / 2突变)的信息,导致我们的列线图未能纳入这些重要因素;最后,我们的数据仅来自一家机构,不可避免地造成了内在的偏倚,可进一步收集多中心数据并结合其他因素用于改进此模型。
SEER数据库是美国的肿瘤流行病学数据库,本文对SEER数据库中2011年—2016年晚期三阴性乳腺癌的临床特征及预后进行分析,并为TNBC患者的OS提供了多个预后因素,并以此构建了预后列线图,可预测晚期TNBC患者3年和5年的生存率,帮助临床医生进行风险管理并选择TNBC患者的长期生存策略。

