MiR-144-3p对口腔鳞癌Cal27细胞增殖、侵袭、凋亡和PTEN/PI3K/AKT信号通路的影响
李玉兰,陈晓霞,魏天祥
(陕西省康复医院 口腔科,陕西 西安710065)
微小RNA(microRNAs,miRNAs)是一类短小的内源性非编码RNA,可通过与靶mRNA的3’非编码区(UTR)结合抑制mRNA的翻译;部分miRNAs被证实在口腔鳞癌组织或细胞中异常表达,与口腔鳞癌的发生和转移密切相关,可作为早期检测的潜在生物标志物和潜在治疗靶点[1-3]。miR-144-3p与肿瘤发生、发展关系密切。研究显示,前列腺癌、胃癌和肾癌等肿瘤组织或细胞中miR-144-3p表达降低,过表达miR-144-3p通过诱导细胞凋亡和周期阻滞、抑制上皮间充质转化具有抗肿瘤作用[4-6]。口腔鳞癌组织中miR-144-3p异常高表达,且与肿瘤分化程度、TNM分期、淋巴结转移和生存率有关[7];然而,miR-144-3p在口腔鳞癌发生发展中的作用并不清楚。本研究通过常规生物学手段观察miR-144-3p对口腔鳞癌CAL27细胞增殖、侵袭和凋亡的影响,并探讨其可能的分子机制,以揭示miR-144-3p在口腔鳞癌中的调控作用。
1 材料与方法
1.1 主要试剂与仪器RPMI-1640培养基、胎牛血清、青链霉素双抗和二甲基亚砜(美国Gibco),Trizol试剂、lipofectamineTM2000(美国Invitrogen),miR-144-3p 模拟物(mimics)、miR-144-3p 抑制剂(inhibitor)及其相应的阴性对照(negative control,NC)mimics-NC、inhibitor-NC(广州锐博生物),Matrigel胶和噻唑蓝(Methylthiazolyldiphenyl-tetrazolium bromide,MTT)试剂(美国Sigma),兔抗人第10号染色体同源缺失性磷酸酶-张力蛋白(phosphatase and tensin homolog deleted on chromosome 10,PTEN)、蛋白激酶B(protein kinase B,AKT)AKT和磷酸化AKT(p-AKT)多克隆抗体(美国Abgent),兔抗人磷脂酰肌醇-3-激酶(phosphatidylinositol-3-kinase,PI3K)单克隆抗体和鼠抗人β肌动蛋白(β-actin)单克隆抗体(美国Abcam),辣根过氧化酶标记的羊抗兔/鼠二抗(美国Thermo)。蛋白浓度检测试剂盒(北京索莱宝),蛋白提取试剂盒和miRNA反转录试剂盒(美国Thermo scientific),膜联蛋白 V-FITC(Annexin V-FITC)/碘化丙啶(Propidium Iodide,PI)细胞凋亡检测试剂盒和双荧光素酶报告基因检测试剂盒(上海碧云天)。CO2细胞培养箱(美国ThermoFisher),逆转录-聚合酶链反应 (Reverse Transcription-Polymerase Chain Reaction,RT-PCR)仪(日本TaKaRa),全自动化酶标仪(美国Bio-Rad),流式细胞分析仪(美国BD),凝胶成像分析系统(美国UVP)。
1.2 细胞来源及其培养人口腔鳞癌CAL27细胞购于中科院上海细胞库。使用添加100 ml/L胎牛血清和100 U/mL青链霉素双抗的RPMI-1640培养基在饱和湿度、37℃、5%CO2细胞培养箱中常规培养CAL27细胞。待细胞贴壁80%左右时,加入0.25%胰蛋白酶消化,并以1∶3比例传代。实验所有细胞为生长良好的第3代对数生长期细胞。
1.3 实验分组与转染实验分为NC-mimics组(转染mimics-NC)、miR-144-3p mimics组(转染miR-144-3p mimics)、NC-inhibitor组(转染inhibitor-NC)和miR-144-3p inhibitor组(转染miR-144-3p inhibitor组)。将对数生长期的CAL27细胞以每孔250000个细胞接种至6孔细胞板上,置于细胞培养箱内常规培养。待细胞汇合度达75%左右时,参照转染试剂lipofectamineTM2000说明书步骤根据实验分组将miR-144-3p mimics、miR-144-3p inhibitor及其相应的mimics-NC、inhibitor-NC转染至CAL27细胞中;分别将miR-144-3p inhibitor 与si-con,miR-144-3p inhibitor 与si-PTEN共转染至CAL27细胞中,分别记作miR-144-3p inhibitor加si-con组、miR-144-3p inhibitor加si-PTEN组。每组设置3个复孔。转染5 h后更换新鲜培养基,继续培养48 h后胰酶消化收集各组细胞,采用RT-PCR检测细胞中miR-144-3p的表达以评价转染效果。
1.4 miR-144-3p表达的检测采用RT-PCR检测。运用Trizol试剂提取CAL27细胞中总RNA后,采用紫外分光光度计检测总RNA的浓度。参照miRNA反转录试剂盒说明书将RNA进行逆转录后,将1 μl逆转录产物cDNA与10 μl 2×SYBR Premix、各0.5 μl上下游引物及8 μl ddH2O2混合,制成20 μl PCR反应体系。PCR反应条件:94℃ 预变性3 min;94℃ 变性15 min、60℃ 退火 30 s、72℃ 延伸30 s,循环40次。以U6为内参,2-△△CT法计算CAL27细胞中miR-144-3p的表达水平。其中,miR-144-3p和U6引物参照文献[7]。实验重复3次。
1.5 细胞增殖能力的检测采用MTT法检测。分别收集转染48 h的NC-mimics组、miR-144-3p mimics组、NC-inhibitor组和miR-144-3p inhibitor组细胞,以每孔10000个接种至96孔细胞板上,每组设置3次重复。置于细胞培养箱内分别培养48 h、72 h和96 h后,弃培养液,每孔加入浓度为5 g/L MTT试剂 20 μl。孵育4 h后,再向每孔中加入150 μl二甲基亚砜溶液震荡至MTT结晶溶解。采用全自动化酶标仪在490 nm波长处检测各组细胞的光密度值(OD值)。实验重复3次。
1.6 细胞侵袭能力检测采用Transwell小室检测。将Transwell小室放入24孔细胞板中,在小室聚碳酸酯膜上铺一层浓度为1 mg/ml Matrigel基质胶,常温下充分聚合。取胰酶消化收集转染48 h后的各组细胞悬液100 μl(含1000个细胞)加入到小室上层中,每组设3个重复,并在下层中加入600 μl含血清的培养基。置于细胞培养箱内孵育24 h后,取出小室,轻轻拭去上层内残留的细胞,分别以4%多聚甲醛和0.5%结晶紫固定、染色。洗去染色液后,晾干。采用显微镜观察统计各组中的穿膜细数,结果以随机选取的3个视野内细胞数的均值表示。实验重复3次。
1.7 细胞凋亡检测采用Annexin V-FITC/PI双染法检测。使用预冷的磷酸缓冲液将收集转染48 h后的各组CAL27细胞漂洗2次后,加入300 μl结合缓冲液调整细胞浓度。取细胞悬液100 μl(含10000个细胞),依次加入5 μl Annexin V-FITC和5 μl PI,混匀后避光孵育15 min。补加200 μl上样缓冲液后,1 h内上流式细胞仪检测各组细胞的凋亡情况。实验重复3次。
1.8 PTEN/PI3K/AKT信号通路相关蛋白表达的检测采用Western blot检测。胰酶消化收集转染48 h后的各组CAL27细胞,参照蛋白提取试剂盒说明书提取CAL27细胞总蛋白,并参照蛋白浓度检测试剂盒说明书检测总蛋白的浓度。将热变性的蛋白样品以每孔20 μl上样至SDS-PAGE凝胶中行电泳分离。转膜后,以5%脱脂奶粉的封闭液封膜2 h后,以PTEN(1∶1000)、PI3K(1∶300)、AKT(1∶200)、p-AKT(1∶200)和β-actin(1∶1000)一抗在4℃下孵育24 h后,再以辣根过氧化酶标记的二抗(1∶5000)室温孵育1 h。经化学发光液暗室内显影后,以β-actin为内参,采用凝胶成像分析系统分析各组细胞中PTEN、PI3K和AKT的磷酸化水平。实验重复3次。
1.9 miR-144-3p与PTEN靶向关系的验证使用生物信息学软件Targetscan预测到PTEN 3’UTR与miR-144-3p存在互补的结合位点。为了验证miR-144-3p与PTEN是否存在靶向关系,通过将PTEN的3′UTR 片段克隆到pmirGLO质粒上,构建野生型PTEN-WT 报告基因质粒,并利用Takara点突变试剂盒突变PTEN 3′UTR 上 miR-144-3p 结合位点后克隆至pmirGLO 质 粒 上,构建突变型PTEN-MUT质粒。将构建的PTEN-WT、PTEN-MUT质粒按照Lipofectamine TM2000说明书分别与NC-mimics、miR-144-3p mimics、miR-144-3p inhibitor、NC-inhibitor共转染至CAL27细胞中,每个处理设置3个复孔。转染48 h后,胰酶消化收集各处理组细胞,参照双荧光素酶报告基因检测试剂盒说明书检测细胞的荧光素酶活性。实验重复3次。

2 结果
2.1 miR-144-3p对Cal27细胞增殖的影响RT-PCR检测NC-mimics组、miR-144-3p mimics组、NC-inhibitor组和 miR-144-3p inhibitor组细胞中miR-144-3p的表达水平分别为1.00±0.00、4.76±0.48、0.92±0.09和0.23±0.02,4组中miR-144-3p的表达水平存在明显差异(F=608.431,P=0.000<0.05)。与NC-mimics组相比,转染miR-144-3p mimics后CAL27细胞中miR-144-3p的表达水平明显升高(4.76±0.48 vs 1.00±0.00,*P<0.05);与NC-inhibitor组相比,转染miR-144-3p inhibitor后CAL27细胞中miR-144-3p 的表达水平明显降低(P<0.05)。不同组间、不同时间点间、组间×时间交互作用下的细胞活力(OD490)差异均有统计学意义(P<0.05);转染48 h、72 h和96 h后miR-144-3p mimics组细胞的增殖活力相对于NC-mimics组明显升高(P<0.05),而miR-144-3p inhibitor组细胞的增殖活力相对于NC-inhibitor明显降低(P<0.05),见表1。

表1 转染miR-144-3p模拟物或抑制物对Cal27细胞活力的影响
2.2 miR-144-3p对Cal27细胞侵袭的影响与NC-mimics组相比,miR-144-3p mimics组细胞侵袭能力明显增强(P<0.05);而miR-144-3p inhibitor组细胞的侵袭能力较NC-inhibitor组明显减弱(P<0.05),见图1和表2。

图1 Transwell检测转染miR-144-3p模拟物或抑制物细胞侵袭

表2 转染miR-144-3p模拟物或抑制物细胞侵袭能力的比较
2.3 miR-144-3p对Cal27细胞凋亡的影响与NC-mimics组相比,miR-144-3p mimics组细胞凋亡率明显降低(P<0.05);与NC-inhibitor组相比,miR-144-3p inhibitor组细胞凋亡率明显升高(P<0.05),见图2、表3。

图2 流式细胞仪检测转染miR-144-3p模拟物或抑制物细胞凋亡

表3 转染miR-144-3p模拟物或抑制物细胞凋亡能力的比较
2.4 miR-144-3p与PTEN靶向关系的验证运用Targetscan靶基因预测软件得到PTEN 3' UTR与miR-144-3p存在互补结合位点。见表4。与NC-mimics组相比,miR-144-3p mimics使转染PTEN-WT质粒细胞的荧光素酶活性明显降低(P<0.05);与NC-inhibitor组相比,miR-144-3p inhibitor可使转染PTEN-WT质粒细胞的荧光素酶活性明显升高(P<0.05);但miR-144-3p对转染PTEN-MUT质粒细胞的荧光素酶活性无明显影响(P>0.05),见表5。

表4 PTEN 3′ UTR与miR-144-3p互补结合位点

表5 转染miR-144-3p模拟物或抑制物细胞荧光素酶活性的比较
2.5 miR-144-3p对Cal27细胞中PTEN/PI3K/AKT信号通路的影响与NC-mimics组相比,miR-144-3p mimics组细胞中PTEN蛋白的表达水平明显降低,而PI3K蛋白的表达水平和AKT磷酸化水平明显升高(P<0.05);miR-144-3p inhibitor组细胞中PTEN蛋白的表达水平较NC-inhibitor组明显升高,而PI3K蛋白的表达水平和AKT磷酸化水平较NC-inhibitor组明显降低(P<0.05),见图3和表6。

图3 Western blot检测PTEN、PI3K蛋白和AKT磷酸化水平
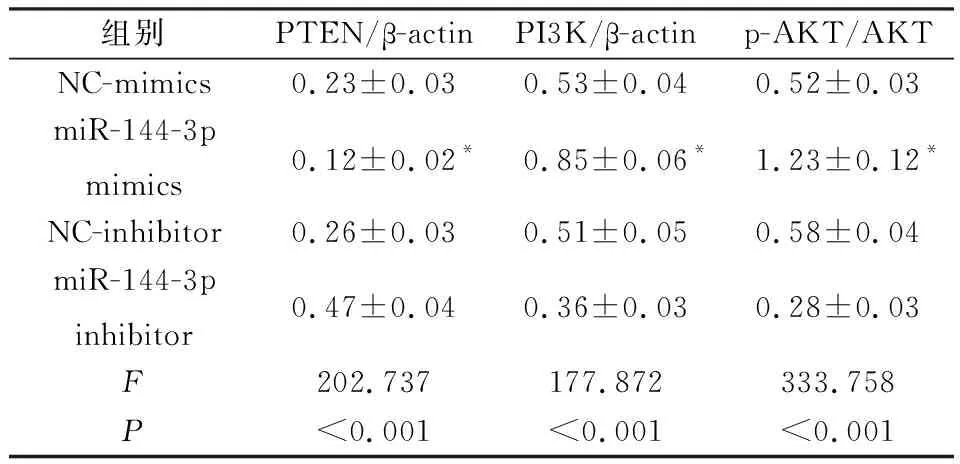
表6 转染miR-144-3p模拟物或抑制物细胞中PTEN、PI3K蛋白和AKT磷酸化水平的比较
2.6 沉默PTEN部分逆转干扰miR-144-3p 对Cal27细胞的影响
与miR-144-3p inhibitor+si-con组比较,miR-144-3p inhibitor+si-PTEN组细胞活力显著升高(P<0.05),侵袭细胞数显著增加(P<0.05),细胞凋亡率显著降低(P<0.05),PTEN蛋白水平显著降低(P<0.05),PI3K、p-AKT蛋白水平显著升高(P<0.05),见图4、表7。

图4 Western blot检测共转染miR-144-3p inhibitor 和si-PTEN细胞PTEN、PI3K蛋白和AKT磷酸化水平
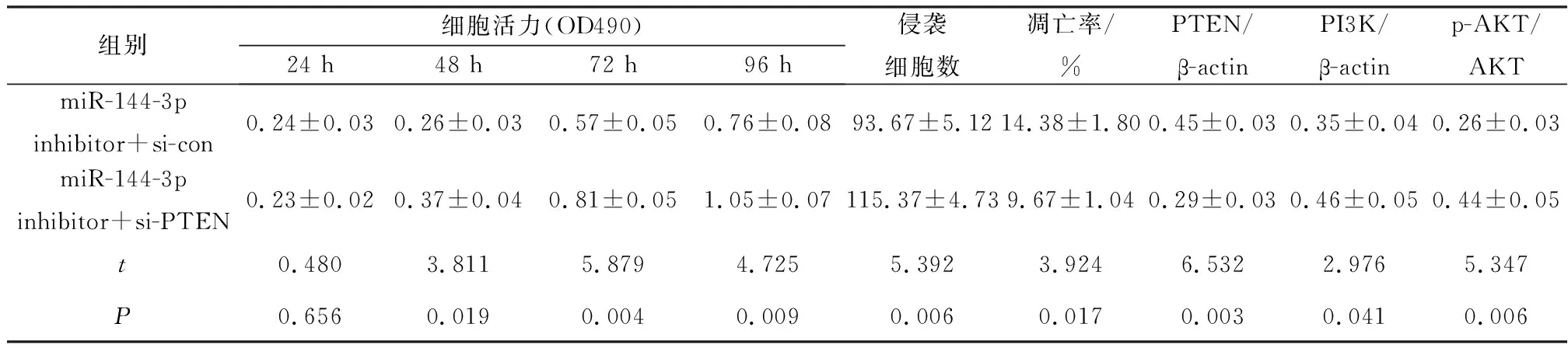
表7 共转染干扰miR-144-3p和沉默PTEN对Cal27细胞增殖、迁移和凋亡的影响
3 讨论
口腔鳞癌是口腔癌的主要病理类型,具有易转移、手术切除困难和术后易复发等特点。尽管放化疗和修复重建技术使口腔鳞癌患者的治疗效果明显改善,但中晚期患者的生存率并不理想[8-9]。目前认为,口腔鳞癌的发生与人乳头瘤样病毒、吸烟、喝酒和咀嚼槟榔等因素有关,但其发生发展的分子生物学机制并不明确。研究[10-12]显示,miRNAs可通过调控相关基因的表达、细胞增殖和转移等参与口腔鳞癌的发生与发展。随着研究的不断深入,越来越多的miRNAs如miR-655、miR-545和miR-199a-5p等在口腔鳞癌中的作用被揭示[13-15],但还有部分miRNAs的作用尚不清楚。
miR-144-3p是近年来发现的一种与肿瘤发生发展关系密切的miRNA,在不同肿瘤组织中表达不尽相同,其发挥的作用也有很大差别。例如:miR-144-3p在胰腺癌和人胶质母细胞瘤等组织中表达下调,且可通过诱导癌细胞凋亡并抑制细胞增殖、侵袭和迁移等发挥着类似抑癌基因的作用[5,16];而miR-144-3p在透明细胞肾癌和甲状腺乳头状癌等组织中表达上调,且可通过促进肿瘤细胞增殖、侵袭并抑制细胞凋亡等发挥着类似促癌基因的作用[17-18]。与上述结果相似,本研究结果表明上调miR-144-3p表达可促进口腔鳞癌CAL27细胞增殖、侵袭并抑制细胞凋亡,而下调其表达则可抑制CAL27细胞增殖与侵袭并促进细胞凋亡。提示miR-144-3p在口腔鳞癌发生发展过程中可能发挥着重要的促癌作用。但关于其如何调控下游基因尚未阐明。
本研究通过双荧光素酶报告实验证实miR-144-3p可靶向结合PTEN,并可负向调控PTEN的表达。PTEN是一种抑癌基因,可通过其脂质磷酸活性使PI3K/AKT信号通路上游PI3K去磷酸化而阻断PI3K/AKT信号通路的活化,进而影响细胞生物学功能发挥抑癌作用[19-20]。已有研究[21]指出,PTEN在口腔鳞癌组织中低表达,可使PI3K/AKT信号通路活化,促进肿瘤细胞增殖、侵袭。为了探讨miR-144-3p在口腔鳞癌中的致癌机制,本研究进一步检测发现,上调miR-144-3p表达可使PTEN表达降低,而PI3K蛋白表达和AKT磷酸化水平明显升高;反之,下调miR-144-3p可得到相反的结果。提示上调miR-144-3p表达可能通过负向调控PTEN的表达从而参与口腔鳞癌发生发展过程。该结果与Song L等[22]得出的miR-144-3p可通过靶向调控PTEN介导PI3K/AKT信号传导促进鼻咽癌细胞增殖、侵袭并抑制细胞凋亡的分子机制相似。同时本研究将miR-144-3p inhibitor与si-PTEN共转染至口腔鳞癌CAL27细胞,结果显示细胞活力显著升高,侵袭细胞数显著增加,细胞凋亡率显著降低,PTEN蛋白水平显著降低,PI3K、p-AKT蛋白水平显著升高,提示,miR-144-3p可能通过抑制PTEN表达进而促进PI3K/AKT信号通路活化导致口腔鳞癌的恶性进展。
综上所述,在口腔鳞癌CAL27细胞中miR-144-p可促进细胞增殖、侵袭并抑制细胞凋亡,这可能是通过靶向调控PTEN/PI3K/AKT信号传导实现的。

