蛹虫草遗传多样性分析
李 跃 刘 娜 宋 莹 张季军 李 红 肖千明
(辽宁省农业科学院食用菌研究所/辽宁省食用菌优质栽培重点实验室,辽宁沈阳110161)
蛹虫草(Cordyceps militaris)属子囊菌门,肉座菌目,虫草科,虫草属,又名北冬虫夏草、北虫草,是虫草属的模式种[1]。研究证明,蛹虫草含有虫草素、虫草酸及多糖等特殊活性物质,具有抗菌、抗病毒、抗肿瘤、抗氧化、抗炎和免疫调节等诸多生理功效,被用作冬虫夏草的替代品[2]。酯酶同工酶是食用菌种质资源研究的生化指标之一,可反映出生物间的遗传信息和进化关系,可作为传统生物学分类的辅助依据[3]。笔者用酯酶同工酶技术对12个蛹虫草菌株的亲缘关系进行分析,旨在为蛹虫草菌种管理和种质资源遗传多样性的研究提供理论依据。
1 材料与方法
1.1 供试菌株与培养基
供试的12个蛹虫草菌株采用组织分离获得,编号为C1~C12。
固体培养基配方:马铃薯200 g,葡萄糖20 g,磷酸二氢钾3 g,硫酸镁1.5 g,琼脂20 g,蛋白胨10 g,水1 000 mL。
液体菌种培养基配方:马铃薯200 g,葡萄糖20 g,磷酸二氢钾3 g,硫酸镁1.5 g,维生素B110 mg,蛋白胨3 g,牛肉膏5 g,水1 000 mL。

表1 供试蛹虫草菌株编号及来源
栽培种培养基配方:每瓶装40 g小麦,加入营养液60 mL。
1.2 试验方法
1.2.1 菌丝培养特性试验
用直径6 mm 打孔器取活化后的菌种块接种于直径9 cm 的固体培养基平板上,置于培养箱内(23±1)℃避光培养。观察菌丝长势以及菌丝转色后的颜色,并计算菌丝平均生长速度[4]。
菌丝平均长速(mm/d)=([菌落直径-6)÷2]÷培养时间
1.2.2 收集菌丝
将活化后的菌种在无菌条件下接入20 mm×200 mm的试管中,每个菌株8支,置于(23±1)℃培养箱内,避光培养,待菌丝长满试管后将菌丝慢慢刮下,注意菌丝不带有培养基,以免影响后期的试验数据。每个菌株取0.5 g菌丝,-20 ℃冰冻24 h后备用[5]。
1.2.3 同工酶电泳
采用垂直平板聚丙烯酰胺凝胶电泳方法。将收集的菌丝放入液氮中研磨,并加入0.5 mL 的提取液,研磨后将样品收集于1.5 mL离心管中,14 938×g离心20 min,取上清液。将上清液与蔗糖溶液按体积比1∶1 混合作为电泳样品,点样量45 μL,溴酚蓝作为指示剂。4 ℃电泳,初始电压为100 V/板,进入分离胶后电压为150 V/板。当溴酚蓝指示剂迁移距末端1 cm左右时,停止电泳,染色并保存备用。
1.2.4 酶谱分析
测量相对迁移率(Rf):相对迁移率Rf=X/Y,X为点样孔下沿到指示剂前沿的迁移距离,Y为点样孔下沿到凝胶中酶带的迁移距离[6]。
菌株间联合系数(S)分析:两个菌株之间共同具有的酶带数与两菌株所具有的酶带数之和减去共有酶带数的比值。S=c(/a+b-c),式中,a和b分别为菌株各自的酶带总数,c为a、b菌株共有的酶带数[7-8]。
聚类分析:在相同迁移率位置上,有酶带记为1,无酶带记为0,并用DPS 数据处理系统软件进行聚类分析[9]。
1.2.5 出草比较试验
栽培容器为750 mL 透明罐头瓶,每个菌株接种100 瓶。子实体成熟后,供试的12 个蛹虫草菌株分别随机选取20瓶,观察子实体颜色,测定鲜重、干重等,考察蛹虫草子实体农艺性状。
2 结果与分析
2.1 供试蛹虫草菌株菌丝培养特性
由表2 可以看出,菌丝平均长速最快的是C6,其次是 C1,最慢的是 C11;C3、C9、C10 菌丝体浓密,C1、C2、C5、C6、C7、C8 菌丝体较浓密,C4、C11、C12 菌丝体稀;C3、C9、C10 为气生菌丝且旺盛,C7也为气生菌丝,其他菌株都是匍匐菌丝;大部分菌株菌丝是橙黄色,只有C2、C3、C11 是浅黄色。

表2 供试12个蛹虫草菌株菌丝生长情况
2.2 供试蛹虫草菌株子实体农艺性状
由表3 可以看出,多数菌株子实体颜色是橙黄色,只有C2、C3、C8、C11 是橘黄色。子实体干重依次为C6>C1>C5>C4>C2>C8>C12>C9>C7>C10>C3>C11,鲜品较重的是 C6、C1。C1、C2、C4、C5、C6、C8 菌株子实体整齐,C3、C7、C9、C10、C11 菌株子实体不整齐,C12 子实体较整齐。C1、C11 菌株子实体形态为尖头,C2、C8菌株为孢子头,其他菌株为棒状。

图1 供试12个蛹虫草菌株子实体形态
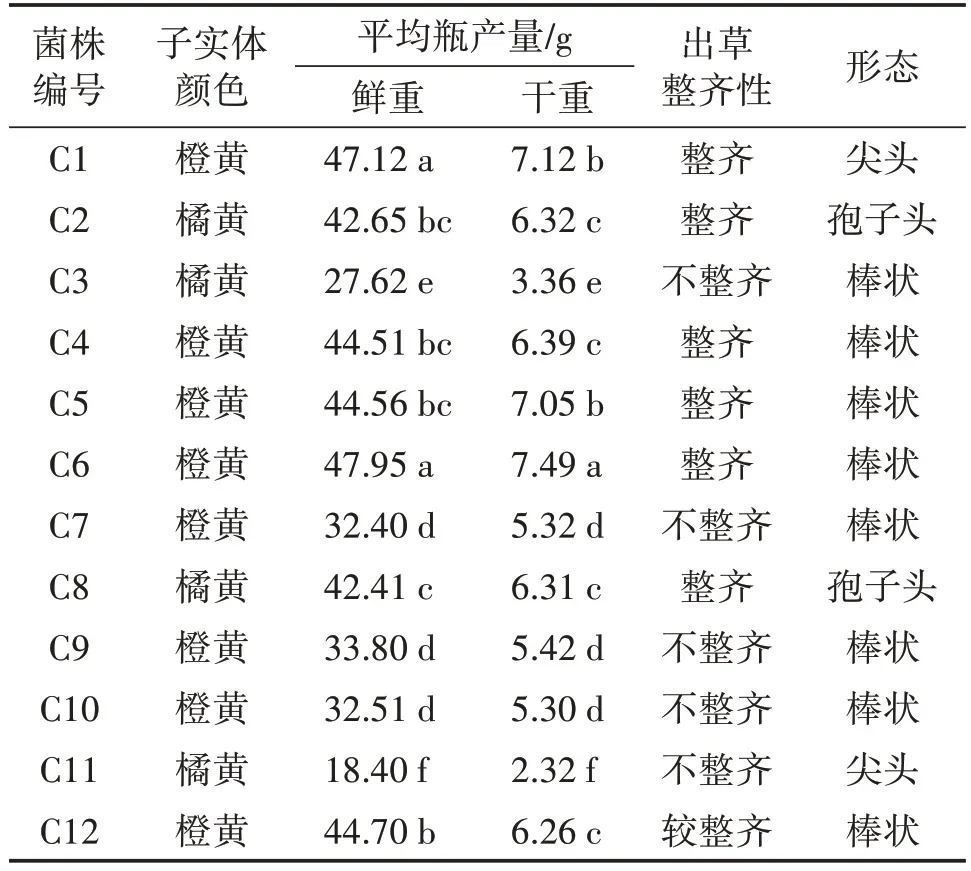
表3 供试12个蛹虫草菌株农艺性状比较
2.3 酯酶同工酶酶带分析
由图2、图3 及表4 可以得出,所有菌株共分离出49 条酶带。按其电泳迁移率(Rf)集中程度由负极向正极可分为A、B 两个区,各菌株有2~5 条不同的酶带,多数为 4~5 条,Rf在 0.178~0.680,其中 A 区Rf在0.178~0.296,B区Rf在0.538~0.680。
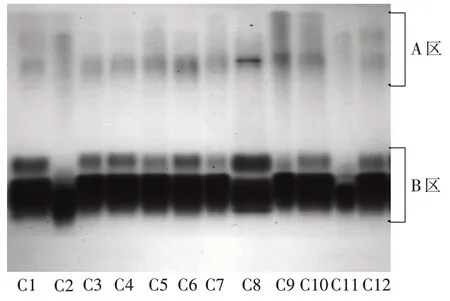
图2 供试蛹虫草菌株的酯酶同工酶图谱

图3 供试蛹虫草菌株的酯酶同工酶模式图

表4 供试12个蛹虫草菌株同工酶的谱带Rf值
12 个蛹虫草菌株中部分菌株酶带基本相同,只是酶带深浅宽窄有所不同,这可能与酶浓度、酶活性有关[10]。在A 区中共有15 条酶带,酶带颜色浅,说明酶的活性弱。B 区中共有34 条酶带,在Rf为0.538、0.550 处酶带较深,在Rf为 0.601~0.680 处酶带最深,说明酶的活性强。在 A 区,C9、C10 在Rf为0.178 处有相同的酶带;C2、C11、C12 在Rf为 0.237处有相同的酶带;除了C2、C11,其他菌株在Rf为0.296处都有相同的酶带。在B区,多数菌株在Rf为0.538、0.601、0.630 处有相同的酶带,说明这些菌株之间有同源性,在主要代谢过程中具有相似的生理性 状[10]。C1 有 2 条 特 殊 酶 带 ,Rf分 别 为 0.550、0.604;C2 有 2 条特殊酶带,Rf分别为 0.621、0.645;C8 有1 条特殊酶带Rf为0.680,说明这三个菌株与其他菌株亲缘关系较远。
2.4 菌株间亲缘关系分析
由相对迁移率可以看出各菌株间亲缘关系的远近,为了更直观,利用联合系数(S)可更清楚地反映供试菌株间的亲缘关系。由表5 可见,12 个蛹虫草菌株的遗传联合系数在0~1 变化,两个菌株间联合系数越小,说明两者亲缘关系较远,联合系数越大,说明两者亲缘关系越近[11]。其中菌株C1 与C2、C11 之间,C2 与 C3、C4、C5、C6、C7、C8、C9、C10 之间,菌株C11 与C1、C3、C4、C5、C6、C7、C9、C10 之间S 为0,说明它们之间亲缘关系较远;菌株C3、C4、C5、C6、C7 之间,C9 与 C10 之间 S 为 1,它们都有 4 条酶带,位置相同,宽窄不同,颜色深浅稍有差异,说明亲缘关系十分相近。
2.5 酯酶同工酶聚类分析
由图4 可以看出,所有菌株在聚类为0.58 处分为4个类群:第1个类群为C1,与其他菌株亲缘关系较远;第2 个类群包括 C3、C4、C5、C6、C7、C9、C10、C12、C8,其中C3、C4、C5、C6、C7 相异系数(距离系数)为0,C9与C10相异系数为0,说明每组菌株的遗传背景相似或为同一菌株;第3个类群为C2;第4个类群为C11。在聚类为0.78 时,菌株C1 与第2 个类群归为一类;C2、C11 归为一类,说明菌株 C1、C2、C11与其他类群亲缘关系较远。

图4 供试蛹虫草菌株的聚类分析

表5 供试12个蛹虫草菌株同工酶的联合系数(S)
3 小结与讨论
菌丝长势包括菌丝生长的状态和速度。优良菌种菌丝长速正常、整齐、浓密、健壮;劣质菌种菌丝生长缓慢、稀、参差不齐、易衰老[12]。供试12 个蛹虫草菌株的菌丝生长速度、菌丝密度和菌丝形态有一定差异,在生产中匍匐状菌丝更有利于现蕾;这与秦俊哲的菌株活力较强能出草,其菌丝基本都为白色圆环匍匐状的研究结果相一致[13];子实体鲜品、干品较重的为C6、C1 菌株,C1、C2、C4、C5、C6、C8 菌株子实体整齐,子实体的整齐度直接影响到干品的外观。C1、C11 是尖头,C2、C8 是孢子头,其他菌株都是棒状。综合比较表现突出的是菌株C6、C1。
酯酶同工酶分析弥补了以子实体形态等特征分类方法的不足[14]。试验酯酶同工酶酶带分析共检测出49条酶带,Rf在0.178~0.680,从中可以看出,尖头菌株C1、野生菌株C11、孢子头菌株C2 与其他菌株亲缘关系较远;C3、C4、C5、C6、C7 菌株相异系数为0,菌株C9 与C10 相异系数为0,说明沈阳当地蛹虫草种质资源并不丰富,多为相似或为同一菌株,急需选育新品种,这与何华奇收集的4 株沈阳蛹虫草菌株,遗传相似系数也在0.88 以上结果基本一致[15]。聚类分析结果与形态特征分析结果基本一致,而聚类分析、同工酶酶谱结果更为直观、客观和规范。

