20组心内科常用口服药原研药及仿制药说明书统计分析
马红,张凤怡,钱巧
药品作为一种特殊商品,用于预防、治疗、诊断疾病,其说明书包含药品安全性、有效性的重要科学数据、结论和信息,是指导临床安全合理用药的基础。虽然《中华人民共和国药品管理法》《药品说明书和标签管理规定(局令第24号)》等相关的法律法规,为说明书的管理提供法律依据。工作中发现仍然有些药品说明书存在问题。本研究比较分析心内科常用的20组口服药原研药及仿制药40份说明书,为提高说明书的质量提供参考,同时促进临床安全合理用药。现报道如下。
1 资料与方法
1.1 资料来源 收集心血管病患者常用20组口服药原研药及仿制药说明书,每种药品说明书为1组,每组有原研药和仿制药说明书各1份,共计40份说明书。31份说明书来源于南京医科大学第四附属医院,9份药品说明书来自合理用药信息支持系统(上海大通医药信息技术有限公司),最新更新时间2019年4月23日。
1.2 方法 通过查找国家食品药品监督管理局(CFDA)官网[1]、美国食品药品监督管理局(food and drug administration,FDA)官网[2]及其他相关参考资料,使用Microsoft Excel 2007软件,对20组药品说明书40份进行列表统计分析。
2 结 果
2.1 40份说明书项目对比分析结果 通过对比分析40份说明书中的警示语、适应证、用法用量、不良反应、禁忌、注意事项、特殊人群用药、药物相互作用、药物过量、药理毒理、药代动力学、说明书修订和有效期等内容,总结发现仿制药与原研药说明书各项目存在差异。见表1。
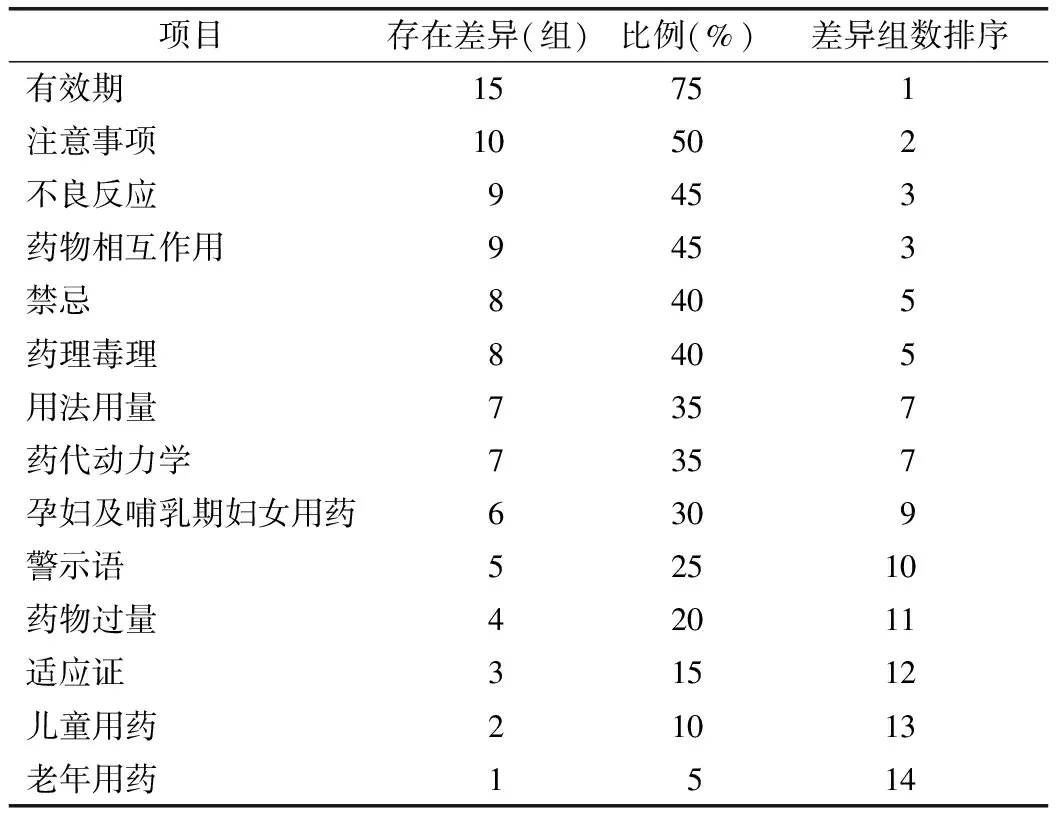
表1 原研药与仿制药说明书各项目存在差异对比统计
2.2 说明书警示语标注情况 40份说明书中,警示语标注率为32.5%,原研药与仿制药说明书标注数量分别为7份、6份,其中有5组说明书警示语标注内容存在差异。见表2。

表2 5组说明书警示语项差异情况比较
2.3 说明书修改日期次数对比 原研药药品说明书修订总次数为137次,平均每种药品修订6.85次,仿制药药品说明书修订总次数为98次,平均每种药品修订4.9次。原研药是仿制药说明书修订次数1.4倍。见表3。
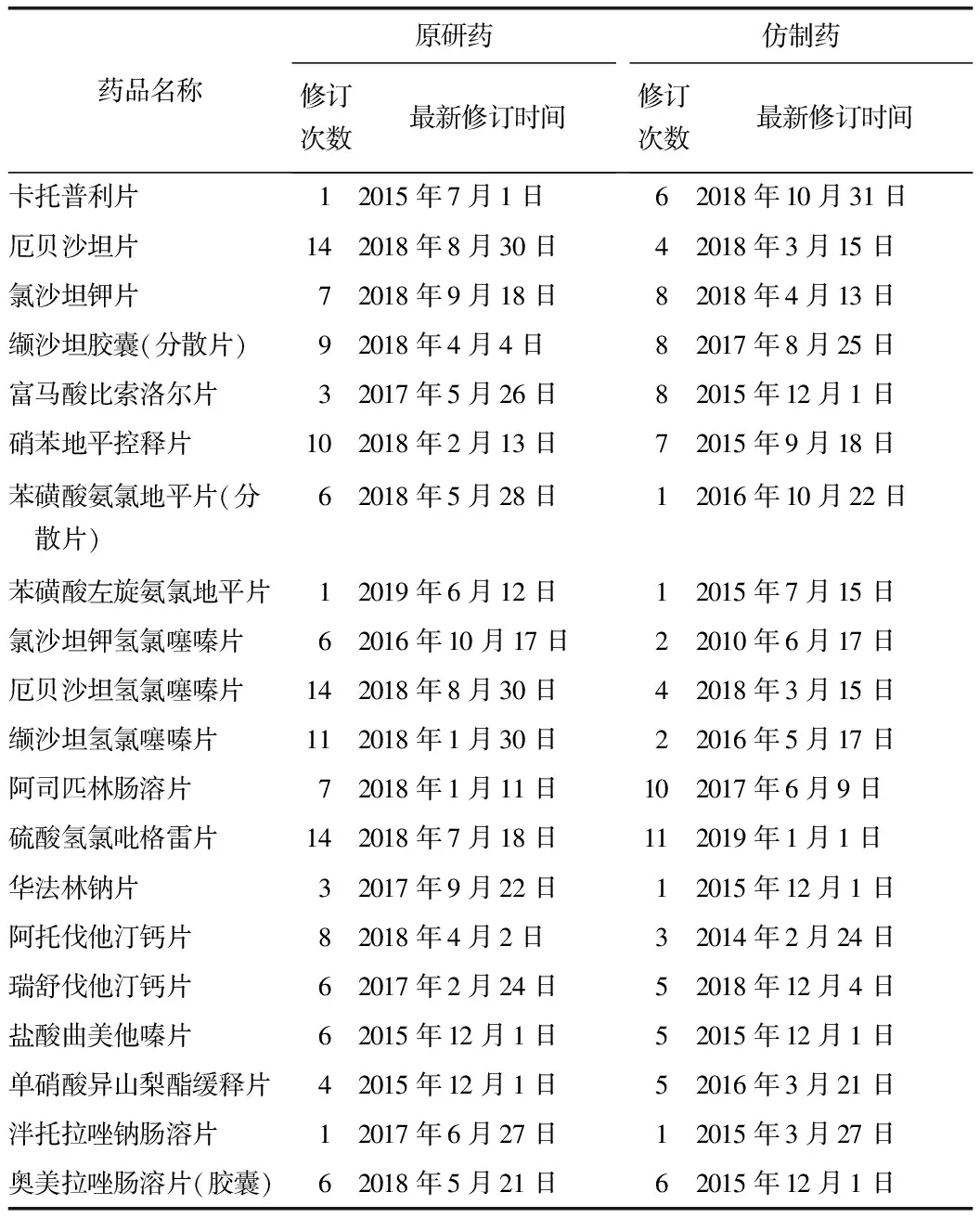
表3 20组说明书修订情况比较
3 分析与讨论
3.1 警示语 警示语是对药品严重不良反应及其潜在的安全性问题的警告,一般包括药品禁忌、注意事项及剂量过量等需提示用药人群特别注意的事项[3]。有该方面内容的应在说明书标题下以醒目的黑体字注明。无该方面内容不列该项。《药品说明书和标签管理规定》[4]中也明确提出:药品生产企业可主动提出在药品说明书或标签上加注警示语,国家食品药品监督管理局也可要求药品生产企业在说明书或标签上加注警示语。此次调查40份说明书,警示语标注率为32.5%,为保障临床用药安全,警示语标识应及时标注与更新。
3.2 用法用量 用法用量项是设计给药方案的主要参考标准,数据来源于上市前的临床试验,以获益/风险比为基本原则,其内容应该严谨准确[5]。在用法用量方面,原研药与仿制药存在较大差异。大多数原研药用法用量内容更详细,包括服用方式、疗程、空腹与否及食物影响(葡萄柚汁)等方面。
3.3 不良反应、注意事项和禁忌 美国FDA颁布的“人用处方药和生物制品说明书的不良反应部分指导原则”中对说明书不良反应部分的资料选择、特有不良反应的选择、资料的表达形式和内容更新均有详尽的要求,而我国相关的法律法规不完善,缺乏约束力[6]。大多数仿制药说明书在不良反应、禁忌及注意事项表现形式各异、内容简略。如:原研药华法林钠片提示以下不良反应:香豆素坏死、紫趾综合征、阴茎异常勃起,而华法林钠片(信宜)不良反应未见描述。
3.4 药物相互作用和药物过量 药物相互作用是药物开发期间,可充分评价药物安全性和有效性的重要信息。2012 年美国FDA公布了“药物相互作用——研究设计、资料分析、对给药的影响和对说明书的建议”的指导原则(草案),目前国内尚无类似的指导原则[7]。调查发现,大多数原研药在药物相互作用和药物过量方面更严谨、详细。例如:单硝酸异山梨酯缓释片(依姆多)提示与同时服用降压作用的药物或合用治疗勃起功能障碍的5型磷酸二酯酶抑制剂,均会增强本品的降压作用,可能引起致命的心血管并发症;单硝酸异山梨酯缓释片(欣康)在药物相互作用项为未进行该项实验且无可靠参考文献。
特别提醒,笔者发现仿制药阿司匹林肠溶片(阿溶)说明书中药物过量项提示血浆浓度为150~300 mg/ml可出现耳鸣。血浆浓度>300 mg/ml可发生更严重的不良反应。原研药阿司匹林肠溶片说明书提示血浆浓度超过150~300 μg/ml可出现耳鸣,血浆浓度>300 μg/ml时,可发生更严重的不良反应。前者提示血浆浓度是后者的1 000倍,阿溶说明书的血浆浓度不符合客观实际情况,考虑是药品说明书的书写失误。
3.5 特殊人群用药 特殊人群指孕妇及哺乳期妇女、儿童及老年患者等人群。因为该类人群生理特殊性,获得准确的用药信息很困难,因为不同的厂家科研技术差异,从而导致特殊人群用药内容存在差异[8]。本次调查发现,原研药特殊人群用药信息更详细。如苯磺酸氨氯地平片(络活喜)提示本品在6~17岁儿童患者有效,推荐剂量为2.5~5 mg,每天1次;仿制药苯磺酸氨氯地平片(久和)提示尚无用于儿童患者的资料。
3.6 有效期 40份说明书中,有效期标注率为100%,存在差异的15组药品说明书,均为原研药有效期长于仿制药。药品有效期是指在给定的贮存条件下,该产品在市售包装下各关键质量指标预期可持续保持在检验标准内的时期。分析原研药与仿制药有效期的差异:(1)给定的贮存条件:大多数原研药为国外进口药品,不同国家地区的气候带不同,所以要求长期稳定性试验时的温湿度有差异;(2)关键质量检测标准,国内药典的要求比国际现行的量化方法(ICH Q1E)更有弹性,并且可能比国际法规更保守(更倾向于低估真实有效期)[9]。另外,工作中常遇到开启后药品的保存期限问题。本调查的40份药品说明书,均未有标识开启后药品的保存时间。缺失该项内容不利于临床医师及药师指导患者安全用药,将成为影响公众安全用药的重要隐患。
3.7 说明书修改日期及次数 由表3可见,原研药说明书的修订更频繁,大多数国产仿制药说明书不能及时更新。CFDA的要求药品生产企业根据药品不良反应监测、药品再评价结果和药品上市后的安全性、有效性情况等信息,对药品书进行修改,生产原研药的外资企业更注重规避风险,将发现的潜在药物风险尽可能写入药品说明书[10]。由此可见,原研药的说明书更加全面,有利于降低药物治疗风险。
从法律法规方面分析原因有[11]:(1)我国药品说明书相关的法律法规缺乏清晰的处罚条款,监管部门难以强力有效地监管企业。(2)制药企业修改药品说明书的行为存在制约因素。在实际说明书审批中,企业只能增加说明书内容,不能减少内容,不利于企业主动跟踪药品不良反应及更新说明书。建议制定有效的法律法规,激励企业主动修改说明书,降低因未及时修改说明书产生的用药风险。
4 结 语
本调查分析发现,仿制药品的说明书与原研药品说明书规范性、严谨性及详细程度存在差异。与原研药相比,仿制药说明书普遍存在缺项、内容描述简略、临床试验数据不足,甚至个别药品说明书存在错误,从而给临床安全用药增加隐患。为更好地指导临床安全合理用药,药品监管部门应加强对药品说明书的管理和规范,药品生产企业应及时更新药品说明书。
临床医护人员及药学人员应明确药品说明书的重要性,作为药学人员,需掌握最新的药品说明书信息,重视对医务人员及患者的宣传,发现药品不良反应及时上报,促进安全用药,减少医患矛盾。

