一株产高活性多酚氧化酶菌株筛选鉴定及其酶学性质
孙会刚,俞晓丹,陈志轩,张传丽,汤 薇,李同祥*
(徐州工程学院食品与生物工程学院,江苏徐州 221018)
多酚氧化酶(polyphenol oxidase,PPO)是自然环境中很常见的一类氧化还原酶,是存在于各种动植物及微生物体内参与其代谢反应的一类金属蛋白酶[1-3],它能针对性地催化多酚类化合物氧化形成与之相对应的醌类物质。无论是在工业的生产过程中还是在微生物研究中,多酚氧化酶都有着极其特殊的地位,其在食品加工、茶叶加工[4-7]过程中具有重要的应用,主要涉及到了啤酒酿造、果汁生产过程中的澄清过程以及食用菌的栽培等各个领域[8-9]。
多酚氧化酶在广义上可以分为三种类型,即单酚氧化酶、双酚氧化酶和漆酶[10-12]。而微生物中主要的多酚氧化酶是漆酶。漆酶因首次在日本紫胶漆树中发现而得名。产漆酶的微生物主要集中在担子菌亚门、子囊菌亚门及半知菌亚门等高等真菌,其中被研究最多的是担子菌亚门的白腐真菌[13]。另外,也有发现一些细菌如芽孢杆菌产较高活性漆酶的报道[14]。尽管产多酚氧化酶的真菌在自然界中较多,关于竹黄菌产多酚氧化酶的报道很少,目前国内仅有江南大学胡艳报道筛选到一株产多酚氧化酶的竹黄菌,经过发酵条件优化后酶活达到120 U/mL[15-16]。但也有筛选到产漆酶酶活较高的其他属菌株,如陈中维等[17]筛选要一株黄孢原毛平革菌,经过发酵条件优化后,酶活最高达到1 459.1 U/mL。国外报道产多酚氧化酶活性比较高的真菌也多集中于担子菌类,如JASIM A[18]报道菇类含有丰富的多酚氧化酶,具有很高的药用价值;DONG S J等[19]报道毛革盖菌产生的多酚氧化酶具有很高降解木质素的能力;WIKEE S等[20]报道了来源于海洋的真菌拟盘多毛孢菌产生的多酚氧化酶具有较强的脱色能力。虽然目前筛选到的产多酚氧化酶的菌种很多,但普遍存在酶活较低或者发酵周期长的缺点。
为了获得产酶活性高、发酵周期短的优良菌株,本研究采用变色圈法从土壤样品中分离筛选产多酚氧化酶的菌株,进一步对筛选菌株进行形态学观察、分子生物学鉴定,并对筛选菌株所产多酚氧化酶的酶学性质进行研究,为下一步多酚氧化酶的实际推广应用奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 原料
土样:采集于江苏溧阳天目湖山水园景区绣球岛茶树下土壤(CY)、江苏太仓弇山园内竹林中腐叶下土壤(ZL)、江苏徐州工程学院内绿化带内土壤(XN)。
1.1.2 化学试剂
α-萘酚:上海展云化工有限公司;L-多巴、对苯二酚、间苯二酚、十二烷基硫酸钠(sodium lauryl sulfate,SDS):合肥博美生物科技有限公司;愈创木酚、焦性没食子酸、D-山梨醇、硫酸镁:国药集团化学试剂有限公司;无水柠檬酸:生工生物工程(上海)股份有限公司;亚硫酸氢钠:天津市大茂化学试剂厂;硫酸锰:天津市恒兴化学试剂制造有限公司;无水硫酸铜:无锡市亚泰联合化工有限公司;乙二胺四乙酸二钠:天津市福晨化学试剂厂;L-抗坏血酸:西陇科学股份有限公司。实验所用试剂均为分析纯。DL2000 DNA Plus Marker:南京诺唯赞生物技术有限公司;真菌基因组提取试剂盒:南京钟鼎生物技术有限公司。
1.1.3 培养基
马铃薯葡萄糖肉汤(potato dextrose broth,PDB):上海博微生物科技有限公司。
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:为上述PDB培养基添加琼脂粉15 g/L。121 ℃灭菌20 min。
愈创木酚、α-萘酚PDA培养基:分别在灭菌PDA培养基中加入经过无菌针式过滤器(孔径0.22 μm)过滤的愈创木酚、α-萘酚乙醇溶液,使培养基中愈创木酚、α-萘酚的最终含量为0.04%。
液体种子培养基:PDB培养基25.0 g,酵母浸粉5.0 g,KH2PO43.0 g,MgSO4·7H2O 3.0 g,蒸馏水1 000 mL,pH值自然。120 ℃下灭菌20 min。
液体发酵产酶培养基:葡萄糖20.0 g,氯化铵2.5 g,K2HPO43.2 g,MgSO4·7H2O 0.2 g,CuSO4·5H2O 0.006 g,蒸馏水1 000 mL,pH值自然。120 ℃下灭菌20 min。
1.2 仪器与设备
5417R低温台式离心机:德国艾本德股份公司;TU-1810紫外-可见分光光度计:北京普析通用仪器有限责任公司;Synergy H1多功能酶标仪:美国BioTek公司;IS-RDD3台式恒温振荡器:美国晶钻仪器公司;303-1电热恒温培养箱:绍兴市银河机械仪器有限公司;FlexCycler2聚合酶链式反应(polymerase chain reaction,PCR)仪:德国耶拿分析仪器股份公司。
1.3 方法
1.3.1 菌株的初筛
初筛:取10-4、10-5、10-6三个梯度的土壤稀释液各100 μL涂布于愈创木酚PDA平板上,于28 ℃恒温培养6~8 d,每个梯度3个平行,仔细观察菌落周围有无紫红色的变色圈产生,有紫色变色圈产生说明该菌株可能产生多酚氧化酶,多酚氧化酶将其底物愈创木酚氧化成紫红色的物质。变色圈直径(D)和菌落直径(d)之比(D/d)越大说明多酚氧化酶酶活越高,挑选出(D/d)值较大且变色圈颜色较深的菌株进行划线分离直至获得纯菌株;将分离得到的纯菌株点接到α-萘酚PDA培养基平板,28 ℃恒温培养6~8 d,观察菌落周围有无紫色的变色圈产生,每个菌株3个平行,将有紫色变色圈的菌株接种于PDA斜面培养基,28 ℃恒温培养6~8 d,4 ℃保存备用[21]。
1.3.2 菌株的复筛
(1)粗酶液的制备[22]
将复筛得到的产多酚氧化酶菌株接种于装液量为100 mL/250 mL液体种子培养基中,28 ℃、150 r/min振荡培养4 d,保存备用。将种子培养液以1%(V/V)的接种量接种至装液量为100 mL/250 mL液体发酵产酶培养基中,28 ℃、150 r/min振荡培养6~8 d,经10 000 r/min、4 ℃离心10~20 min,去除沉淀,上清液即为粗酶液,4 ℃保存备用。
(2)多酚氧化酶酶活测定方法[23-24]
在反应体系中加入0.1 mol/L,pH 6.0的磷酸盐缓冲液3mL,后加入1 mL浓度为0.1 mol/L邻苯二酚溶液以及0.1 mL粗酶液,混合均匀后于波长600 nm处测定吸光度值(OD600nm值)。每隔30 s记录一次吸光度值变化,连续测定10 min。以pH 6.0磷酸盐缓冲液3 mL和0.1 mol/L邻苯二酚溶液1 mL作为对照。多酚氧化酶酶活计算公式如下:

多酚氧化酶酶活定义[25]:1 mL粗酶液在1 min内使得吸光度值变化0.001定义为1个酶活力单位(U/mL)。
1.3.3 菌株鉴定
形态学观察:直接肉眼观察菌株ZL-2在愈创木酚、α-萘酚PDA培养基上的菌落及其表面菌丝的颜色、形状,用接种环挑起菌落观察其疏松或紧密情况。
采用真菌基因组提取试剂盒提取真菌ZL-2基因组,采用引物ITS1(5'-TCCGTTGGTGAACCTGCGG-3'),ITS4(5'-TCCGTTGGTGAACCTGCGG-3')扩增其ITS序列,PCR体系及扩增条件参考文献[26]。
1.3.4 发酵时间对菌株ZL-2多酚氧化酶活性的影响
参考文献[13]中的方法并加以修改。将保藏的筛选菌种以1%(V/V)的接种量接种至装液量为100 mL/250 mL液体发酵产酶培养基中,28 ℃、150 r/min振荡培养15 d,每天定时取样测定多酚氧化酶酶活。
1.3.5 多酚氧化酶的酶学性质[27-30]
(1)多酚氧化酶的最适温度及热稳定性
将磷酸盐缓冲液、底物和多酚氧化酶粗酶液分别置于4 ℃、9 ℃、20 ℃、30 ℃、40 ℃、50 ℃、60 ℃、70 ℃、80 ℃中水浴加热10 min后测定酶活,以所测最大酶活为100%,计算相对酶活,确定多酚氧化酶的最适温度。
在20 ℃、30 ℃、40 ℃、50 ℃、60 ℃温度条件下,将粗酶液分别处理1 h、2 h、3 h、4 h、5 h后测定酶活,考察多酚氧化酶的热稳定性。
(2)多酚氧化酶的最适pH及酸碱稳定性
分别配制pH值为3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0的11个不同pH的磷酸盐缓冲溶液,按照前述方法测定多酚氧化酶活性,以最大酶活记为100%,计算相对酶活力,确定多酚氧化酶的最适pH。
将粗酶液放入pH值为3.0、4.0、5.0、6.0、7.0、8.0的缓冲液中,密封过夜后,按照前述方法测定酶活,考察多酚氧化酶pH稳定性。
(3)多酚氧化酶最适底物
分别配制0.10 mol/L的邻苯二酚、没食子酸、焦性没食子酸、间苯二酚、对苯二酚、L-多巴溶液为底物,测定多酚氧化酶酶活。以最大酶活为100%,计算相对酶活,确定多酚氧化酶的最适底物。
(4)金属离子对酶活性的影响
分别配制6 mmol/L 的MgCl2·6H2O、ZnSO4·7H2O、MnSO4·H2O、CaCl2、CuSO4、Al(NO3)3·9H2O、FeCl3·6H2O溶液,分别取上述溶液0.5 mL,其他条件不变,测定酶活。以不添加金属离子的体系所得的酶活为100%,计算相对酶活,考察金属离子对酶活性的影响。
(5)抑制剂对酶活性的影响
分别配制10 mmol/L、20 mmol/L、40 mmol/L、60 mmol/L、80 mmol/L、100 mmol/L的SDS、柠檬酸、D-山梨醇和L-抗坏血酸溶液,分别取上述溶液0.5 mL,其他条件不变,按照上述酶活测定方法测定酶活。以不添加抑制剂的体系所测得的酶活记为100%,计算相对酶活,考察抑制剂对酶活性的影响。
2 结果与分析
2.1 产多酚氧化酶菌株的初筛和复筛
从采集的样品中筛选到三株菌落周围形成紫红色变色圈的菌株,分别命名为CY-2、ZL-1、ZL-2,其变色圈直径(D)和菌落直径(d)之比(D/d)、颜色强度及变色圈分别见表1和图1。由表1可知,菌株CY-2、ZL-1、ZL-2的D/d值分别为0.84、1.59、2.38,说明ZL-2菌株产生的多酚氧化酶活性可能较高。由图1可知,菌丝为白色,菌落质地疏松呈绒状。采用分光光度法测定三株菌多酚氧化酶的酶活,结果见表2。由表2可知,其中菌株ZL-2产多酚氧化酶活最高,可达393 U/mL。根据文献报道[15],菌株ZL-2产多酚氧化酶酶活较高。因此,选择菌株ZL-2进行分子生物学鉴定。

表1 3株产多酚氧化酶菌株变色圈大小和颜色强度Table 1 Color-changing circle size and intensity of 3 strains producing polyphenol oxidase
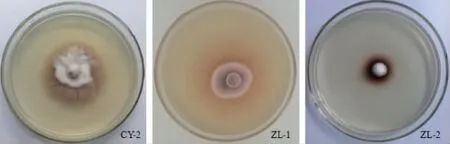
图1 多酚氧化酶产生菌株初筛结果Fig. 1 Preliminary screening results of strains producing polyphenol oxidase

表2 产多酚氧化酶菌株复筛结果Table 2 Rescreening results of strains producing polyphenol oxidase
2.2 菌株ZL-2分子生物学鉴定
以真菌ITS序列通用引物ITS1和ITS4为引物,菌株ZL-2基因组脱氧核糖核酸(DNA)为模板扩增ITS序列,电泳检测结果见图2。由图2可知,以真菌PCR基因组DNA为模板扩增ITS序列,通过真菌的特异性PCR扩增,用1%琼脂糖凝胶电泳检测产生了单一DNA片段条带,与DNA Marker对比显示,PCR扩增的DNA片段长度约为600 bp,与设计的扩增序列长度一致。
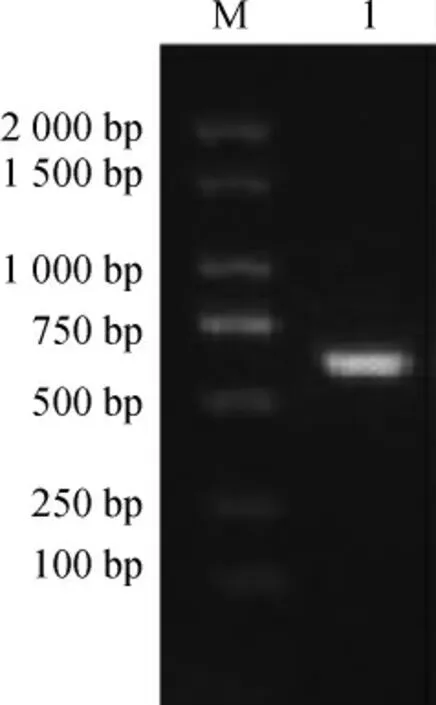
图2 菌株ZL-2基于ITS序列PCR扩增产物电泳图Fig. 2 Electrophoresis of PCR amplification products of strain ZL-2 based on ITS sequence
扩增产物送南京钟鼎生物技术有限公司进行测序,将所得序列在美国国家生物技术信息中心(national center of biotechnology information,NCBI)网站上进行基本局部比对搜索工具(basic local alignment search tool,BLAST)分析,并用MEGA-X软件以邻接(neighbor-joining,NJ)法构建系统发育树见图3。由图3可知,菌株ZL-2与竹黄菌属(Shiraiasp.)进化亲缘关系最近(达到99%)。根据该菌株的菌落及菌丝特征,鉴定菌株ZL-2为竹黄菌属(Shiraiasp.)。

图3 菌株ZL-2基于ITS序列的系统发育树Fig. 3 Phylogenetic tree of strain ZL-2 based on ITS sequence
2.3 发酵时间对酶活性的影响
由图4可知,随着培养时间在0~15 d范围内的增加,多酚氧化酶活性呈现先增大后减少的趋势。在培养的第4天产生胞外的多酚氧化酶,才能测出多酚氧化酶活性,第8天达到酶活最大值521 U/mL,之后酶活开始逐渐下降,发酵第15天时酶活为226 U/mL,仅为最高酶活的43.37%。结果表明,最佳发酵产酶时间为8 d。
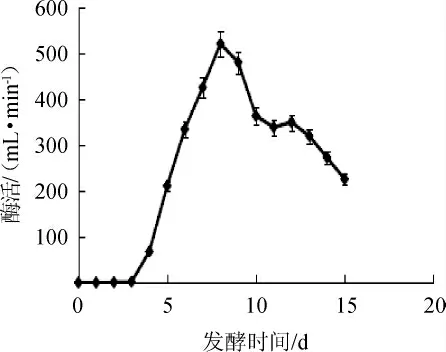
图4 发酵时间对菌株ZL-2产多酚氧化酶活性的影响Fig. 4 Effect of fermentation time on activity of polyphenol oxidase produced by strain ZL-2
2.4 多酚氧化酶酶学性质分析
2.4.1 多酚氧化酶的最适温度和热稳定性
对菌株ZL-2产多酚氧化酶在反应温度4~80 ℃范围内酶活变化进行了分析,结果见图5。由图5可知,在反应温度4~30 ℃范围内,酶活随反应温度升高逐步增加,并在30 ℃时达到最高。反应温度>30 ℃之后,酶活开始降低。因此,该酶的最适反应温度为30 ℃。

图5 反应温度对菌株ZL-2产多酚氧化酶活性的影响Fig. 5 Effect of reaction temperature on activity of polyphenol oxidase produced by strain ZL-2
进一步研究菌株ZL-2产多酚氧化酶的热稳定性,结果见图6。由图6可知,在反应温度20 ℃、30 ℃及40 ℃的条件下,3 h内酶活较为稳定,均可保持初始酶活80%左右,5 h内仍然能保持初始酶活的60%以上;反应温度为50 ℃时,多酚氧化酶热稳定性出现降低,2 h内剩余酶活为初始酶活的42.31%,4 h后降为初始酶活的14.26%,其半衰期约为1.5 h;反应温度在60 ℃时,该酶不稳定,约0.5 h即达到该多酚氧化酶的半衰期,5 h后剩余酶活仅为初始酶活2.15%。结果表明,该酶在反应温度20~40 ℃时具有较好的热稳定性,适合应用于食品等相关行业。
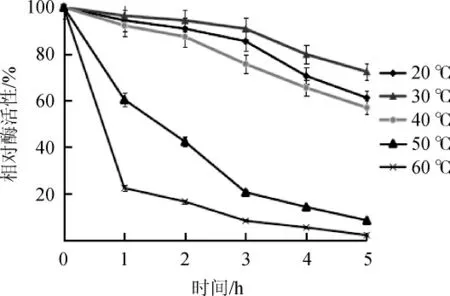
图6 菌株ZL-2产多酚氧化酶的温度稳定性Fig. 6 Temperature stability of polyphenol oxidase produced by strain ZL-2
2.4.2 多酚氧化酶的最适pH和酸碱稳定性
pH值对菌株ZL-2产多酚氧化酶催化活性的影响结果见图7。由图7可知,pH值为3~6时,酶活逐渐增高,在pH值为6时达到最高,为最适pH值,pH值>6之后,酶活开始逐步下降。结果表明,该酶的最适pH值为6。

图7 pH值对菌株ZL-2产多酚氧化酶活性的影响Fig. 7 Effect of pH on activity of polyphenol oxidase produced by strain ZL-2
菌株ZL-2产多酚氧化酶pH值稳定性试验结果见图8。由图8可知,菌株ZL-2产多酚氧化酶经pH值为3~6的缓冲溶液处理过夜后,酶活性较稳定,剩余酶活能达到初始酶活的80%以上;在pH值为7~8时,酶活下降明显。结果表明,菌株ZL-2产多酚氧化酶的酶活性在pH酸性范围内(pH3~6)稳定性较好。

图8 菌株ZL-2产多酚氧化酶的pH稳定性Fig. 8 pH stability of polyphenol oxidase produced by strain ZL-2
2.4.3 多酚氧化酶的最适底物
由图9可知,多酚氧化酶对底物的催化能力由大到小分别为邻苯二酚>愈创木酚>焦性没食子酸>没食子酸>对苯二酚>间苯二酚>L-多巴。因此,该菌株多酚氧化酶最适底物为邻苯二酚,其次为愈创木酚,对焦性没食子酸和没食子酸有一定催化作用,对对苯二酚、间苯二酚和L-多巴而言几乎没有催化作用,说明该多酚氧化酶属于漆酶。
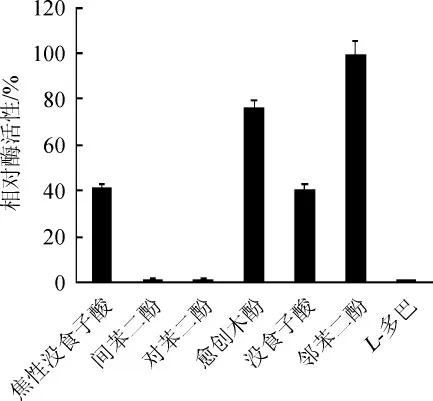
图9 不同底物对菌株ZL-2产多酚氧化酶活性的影响Fig. 9 Effects of different substrates on activity of polyphenol oxidase produced by strain ZL-2
2.4.4 金属离子对多酚氧化酶活性的影响
由表3可知,Cu2+、Mg2+、Mn2+、Fe3+、Zn2+对该酶都有促进作用,其中Cu2+的促进作用较明显,相对酶活达到了150.76%,文献报道漆酶是一种含铜的氧化酶,铜离子对其有激活作用[6]。而Ca2+、Al3+对该菌株酶活具有一定抑制作用。

表3 金属离子对菌株ZL-2产多酚氧化酶酶活影响Table 3 Effects of metal ions on activity of polyphenol oxidase produced by strain ZL-2
2.4.5 抑制剂对酶活性的影响
由图10可知,抑制剂SDS、EDTA-2Na、D-山梨醇、柠檬酸、L-抗坏血酸、亚硫酸氢钠对多酚氧化酶都有抑制作用,其中抑制作用最强的分别为L-抗坏血酸和亚硫酸氢钠。该结果与文献报道的抑制剂对多酚氧化酶的抑制也基本一致[13]。


图10 不同抑制剂对菌株ZL-2产多酚氧化酶活性的影响Fig. 10 Effects of different inhibitors on activity of polyphenol oxidase produced by strain ZL-2
3 结论
通过初筛和复筛,获得一株产多酚氧化酶活性较高的竹黄菌属真菌(Shiraiasp.),发酵8 d其酶活达到521 U/mL。多酚氧化酶最适底物为邻苯二酚;最适pH值为6.00;最适温度为30 ℃;酶活在温度20~40 ℃及pH 3~6范围稳定。金属离子Cu2+激活作用最强,Ca2+、Al3+对酶活有一定抑制作用;L-抗坏血酸和亚硫酸氢钠对该酶抑制作用较强。菌株产ZL-2多酚氧化酶酶学性质与文献报道的漆酶的性质基本一致,适合应用于食品等相关行业;该竹黄菌含有优良的多酚氧化酶基因,但其发酵周期较长,下一步可以通过克隆其基因,在原核中进行表达,大大缩短其发酵周期,有望得到优良的产多酚氧化酶基因工程菌。

