刺梨-红枣果渣可溶性膳食纤维的制备工艺优化及特性分析
覃 引,龙凤媛,张才贵,卢 丽,熊音如,邱树毅*
(1.贵州理工学院食品药品制造工程学院,贵州 贵阳 550003;2.贵州大学酿酒与食品工程学院,贵州 贵阳 550025;3.贵州大学生命科学学院,贵州 贵阳 550025)
刺梨(Rosa roxburghiiTratt)属蔷薇科植物,广泛种植于我国西南高原地区。刺梨果实中富含多种营养物质和功能性成分,如多糖、超氧化歧化酶(superoxide dismutase,SOD)、维生素B(vitamin B,VB)、VC、黄酮、多酚和矿物质等,常被用于开发成饮料、果酒、药茶和果酱等产品[1]。将成熟的刺梨果实进行压榨,残留的果渣量可达到50%[2],而刺梨果渣富含膳食纤维(dietary fiber,DF)、维生素等物质,且来源丰富,廉价易得。红枣(jujube)属鼠里科植物枣树的果实,广泛种植于热带或亚热带地区。红枣果实中含有大量的生物活性物质,除三萜酸、酚酸、氨基酸、皂苷、脑苷脂、黄酮类化合物、多糖和矿物质等外,还富含膳食纤维[3-4]。红枣在被加工为红枣果汁、红枣果酒等产品过程中常伴有大量枣渣产生,枣渣多作为废弃物或直接用作饲料处理,但枣渣中除含有丰富的蛋白质、淀粉、天然红色素外,还含有3.1%的粗纤维[5]。
膳食纤维是一种不能被人体消化道酶分解的一种多糖类及木质素,根据其在水里的溶解性分为水溶性膳食纤维(soluble dietary fiber,SDF)与非水溶性膳食纤维(insoluble dietary fiber,IDF)[6]。增加膳食纤维摄入量可以降低某些慢性疾病的风险,如糖尿病、胃肠道疾病和心血管疾病[7]。此外,膳食纤维的强吸水性可在人体进食后在小肠溶胀成胶状物,增加饱腹感,从而有效控制肥胖[8]。膳食纤维生理功能与可溶性膳食纤维密切相关,通常天然纤维中SDF含量较低,无法达到膳食平衡,此时需从外界主动补充SDF,以保证人体正常工作状态。
本研究利用贵州黔宝食品有限公司提供的刺梨果渣和红枣果渣为原料,采用混合菌种嗜热链球菌(Streptococcus thermophilus)∶保加利亚乳酸杆菌(Lactobacillus bulgaricus)(1∶1)发酵制备水溶性膳食纤维,通过单因素试验及响应面法对其发酵工艺进行优化,并考察水溶性膳食纤维的品质及特性,以期为刺梨果渣和红枣果渣后续深加工和高效开发提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
刺梨果渣、红枣果渣:贵州黔宝食品有限公司。
1.1.2 菌种
德氏乳杆菌保加利亚亚种(Lactobacillus delbrueckiisubsp.bulgaricus)(保藏编号CICC 6047)、嗜热链球菌(Streptococcus thermophilus)(保藏编号CICC 20673):中国工业微生物菌种保藏管理中心。
1.1.3 试剂
MRS液体培养基:上海博微生物科技有限公司;无水乙醇(分析纯):天津市富宇精细化工有限公司;大豆油(食品级):市售。
1.2 仪器与设备
JS3-005电子分析天平:上海浦春计量仪器有限公司;YB-400型高速多功能粉碎机:永康市速锋工贸有限公司;HR/T16M高速离心机:湖南赫西仪器设备有限公司;DHG-9070B恒温鼓风干燥箱:上海琅玕实验设备有限公司;LDZX-50L立式自动压力蒸汽灭菌器:致微(厦门)有限公司;LRH-70生化恒温培养箱:成都瑞昌仪器制造有限公司;JB-CJ-2FXS洁净工作台:无锡优派科技有限公司;Nova Nano SEM 450热场发射扫描电子显微镜:美国FEI公司。
1.3 实验方法
1.3.1 发酵菌种的制备
取保加利亚乳酸杆菌接种于MRS液体培养基中,37 ℃条件下静置活化培养36 h;取嗜热链球菌接种于MRS液体培养基中,37 ℃条件下静置活化培养24 h;按菌种量1∶1取两种菌种接种于MRS液体培养基中,37 ℃条件下混合培养2~3d,采用平板计数法计数,调整菌体浓度在107CFU/mL~108CFU/mL,备用。
1.3.2 可溶性膳食纤维的制备工艺
参考文献[9-10]的方法稍作修改,取红枣果渣10 g和刺梨果渣10 g,放入80 ℃烘箱中烘干至恒质量,取烘干后的混合果渣过100目筛,按料液比1∶20加入适量蒸馏水,混合均匀后于120 ℃条件下灭菌25 min,待冷却至室温后,按10%的接种量接入40mL的发酵菌种,在40℃条件下发酵66h。
1.3.3 可溶性膳食纤维得率的计算
发酵结束后,转移至50mL离心管,并在25 ℃、8000r/min的条件下离心20 min,离心后取上清液于20 ℃下静置24 h,加入体积分数95%的无水乙醇200 mL转入锥形瓶中进行醇析,醇析1 h后再次以相同条件离心,弃上清,收集沉淀,放入105 ℃烘箱中烘干至恒质量,即得SDF,计算SDF得率,其计算公式如下:

1.3.4 可溶性膳食纤维制备工艺优化单因素试验
以可溶性膳食纤维得率为评价指标,采用单因素轮换法依次考察料液比(1∶15、1∶20、1∶25、1∶30、1∶35)、接种量(6%、8%、10%、12%和14%)、发酵温度(31 ℃、34 ℃、37 ℃、40 ℃、43 ℃)、培养时间(48 h、54 h、60 h、66 h、72 h)、原料粒度(0.27 mm、0.25 mm、0.18 mm、0.15 mm、0.125 mm)对可溶性膳食纤维得率的影响。
1.3.5 可溶性膳食纤维制备工艺优化响应面试验
在单因素试验的基础上,以SDF得率为响应值,根据Box-Behnken试验设计原理,选取5因素3水平进行响应面优化试验,因素与水平见表1。
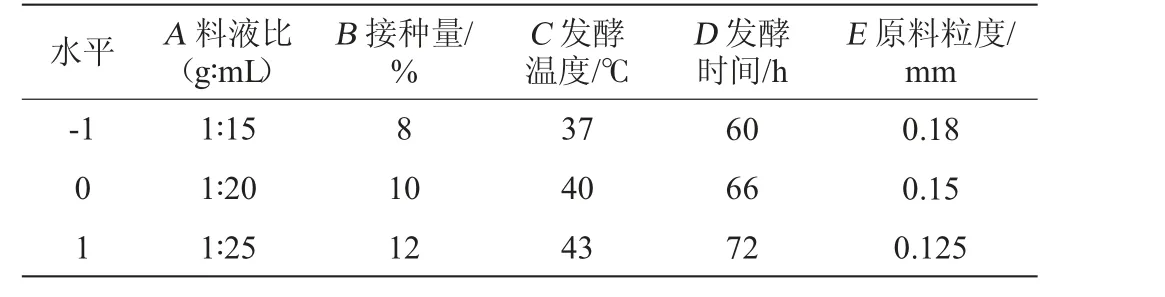
表1 可溶性膳食纤维制备工艺优化响应面试验因素与水平Table 1 Factors and levels of response surface tests for soluble dietary fiber preparation process optimization
1.3.6 可溶性膳食纤维理化性质的分析
持水力:参考LIU X等[11]的方法稍作修改。取可溶性膳食纤维1.00 g(m1),20 ℃条件下在蒸馏水中浸泡1 h,采用滤纸过滤,称质量(m2),计算持水力(water holding capacity,WHC),其计算公式为:WHC=(m2-m1)/m1。
溶胀性:参考MA R等[12]的方法稍作修改。精确称取烘干后所得的可溶性膳食纤维0.200 g(m),置于20 mL量筒中,测其体积V1。20 ℃下精确移取10 mL蒸馏水加入膳食纤维中轻微振荡,使其保持均匀状态,24 h后读取液体中可溶性膳食纤维的体积V2,计算溶胀性(swelling ability,SW),其计算公式为:SW=(V2-V1)/m。
持油力:参考HUANG H等[13]的方法稍作修改。称取膳食纤维样品1.00 g(W1),室温下置于离心管中,加入适量豆油,1 h后过滤,收集过滤后的沉淀,称取沉淀湿质量(W2),计算持油力,其计算公式为:持油力=(W2-W1)/W1。
1.3.7 可溶性膳食纤维的扫描电镜分析
取干燥后的发酵前后的可溶性膳食纤维样品,研磨后,压实,采用扫描电子显微镜观察其显微结构。
1.3.8 数据统计分析
数据采用“平均值±标准差”表示,每组试验重复3次;用OriginPro9.0软件绘图;SPSS25.0软件进行差异显著性分析。
2 结果与分析
2.1 可溶性膳食纤维制备工艺优化单因素试验
2.1.1 料液比对可溶性膳食纤维得率的影响
由图1可知,随着料液比的减小,可溶性膳食纤维得率呈先上升后下降的趋势。当料液比达到1∶20(g∶mL),可溶性膳食纤维的得率达到最大,为11.12%。此时发酵瓶中的发酵条件充分满足菌种的要求。随着料液比的逐渐减小,红枣刺梨果渣可溶性膳食纤维的得率开始慢慢降低,分析原因可能是由于菌种和果渣接触面积不充分,导致发酵不彻底[14-15],因此确定最佳料液比为1∶20(g∶mL)。
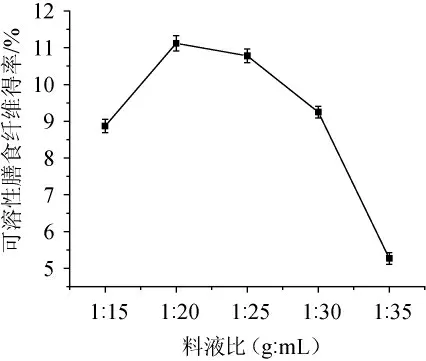
图1 料液比对可溶性膳食纤维得率的影响Fig. 1 Effect of solid-liquid ratio on soluble dietary fiber yield
2.1.2 接种量对可溶性膳食纤维得率的影响
由图2可知,随着菌种接种量的增加,可溶性膳食纤维的得率呈先上升后下降的趋势。当接种量为10%时,可溶性膳食纤维的得率达到最高,为11.30%。分析原因可能是当接种量>10%以后,由于接种量过高,碳源及氧气供不应求,导致发酵条件不足,最后可溶性膳食纤维产量降低。同时菌种的增加,导致大量代谢物慢慢积聚在一起,抑制了菌种的生长以及产物的生成[16-18]。因此,确定最优的接种量为10%。
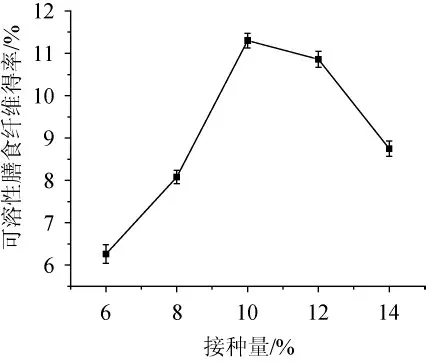
图2 接种量对可溶性膳食纤维得率的影响Fig. 2 Effect of inoculum on soluble dietary fiber yield
2.1.3 发酵温度对可溶性膳食纤维得率的影响
由图3可知,随着发酵温度的升高,可溶性膳食纤维的得率呈现先上升后下降的趋势。当发酵温度在40 ℃时,可溶性膳食纤维的得率最大,为11.39%。说明此时温度增加到适宜菌种生长的温度之后,菌种开始生长和代谢。当发酵温度低于40 ℃之前,环境温度达不到两种菌种的生长温度,发酵速度较慢,菌种不生长代谢,此时的膳食纤维只能由原料本身代谢,SDF得率较低;当发酵温度高于40 ℃之后,可溶性膳食纤维得率下降,这可能是由于温度升高,超过菌种的适宜环境,高温在一定程度上抑制菌种的生长以及产物的活性,所以膳食纤维的得率降低[19-21]。因此确定最佳发酵温度为40 ℃。
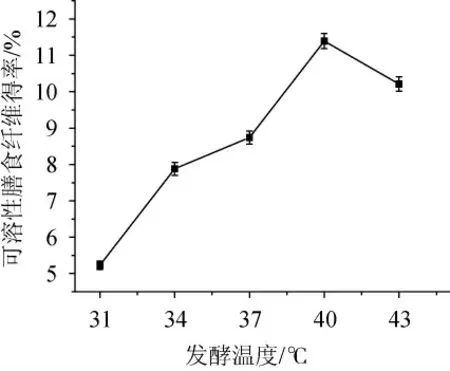
图3 发酵温度对可溶性膳食纤维得率的影响Fig. 3 Effect of fermentation temperature on soluble dietary fiber yield
2.1.4 发酵时间对可溶性膳食纤维得率的影响
由图4可知,随着发酵时间的增加,可溶性膳食纤维得率呈先上升后下降的趋势。当发酵时间为66 h时,可溶性膳食纤维的得率最高,为11.41%。分析原因可能是当发酵时间较短时,可溶性膳食纤维中的原果胶不能充分溶解;当发酵时间过长时,发酵产物堆积,导致发酵环境pH值减小,进而影响菌体的生长及产物的产量[22],同时,随着发酵时间的不断增加,菌种慢慢增长致使发酵产物不断的积累,然后导致体系原料粒度不断下降,抑制菌体的自身生长或产生菌体自溶,使菌体产酶效果下降从而导致发酵能力的下降[23]。因此,确定最优发酵时间为66 h。

图4 发酵时间对可溶性膳食纤维得率的影响Fig. 4 Effect of fermentation time on soluble dietary fiber yield
2.1.5 原料粒度对可溶性膳食纤维得率的影响
由图5可知,随着原料粒度的增加,可溶性膳食纤维的得率呈现先上升后下降的趋势。当原料粒度为0.15 mm时,可溶性膳食纤维得率达到最高,达到11.43%。当原料粒度>0.15 mm之后,可溶性膳食纤维得率迅速下降。粒度决定比表面积,在合适的范围内粒度变小,可溶性膳食纤维的比表面积较大,易于溶出;反之难于溶出。但如果粒度<0.15 mm,破坏了膳食纤维的内部结构,同样导致难于溶出[24-25]。因此,确定最佳粒度为0.15 mm。
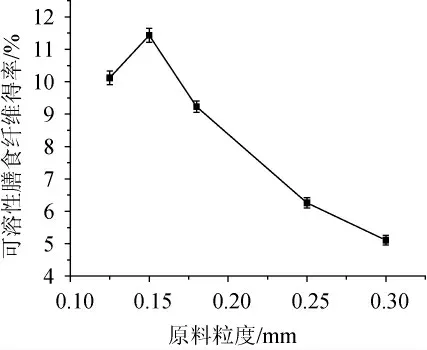
图5 原料粒度对可溶性膳食纤维得率的影响Fig. 5 Effect of raw material granularity on SDF yield
2.2 可溶性膳食纤维制备工艺优化响应面试验结果与分析
可溶性膳食纤维制备工艺优化响应面试验设计及结果见表2,方差分析结果见表3。
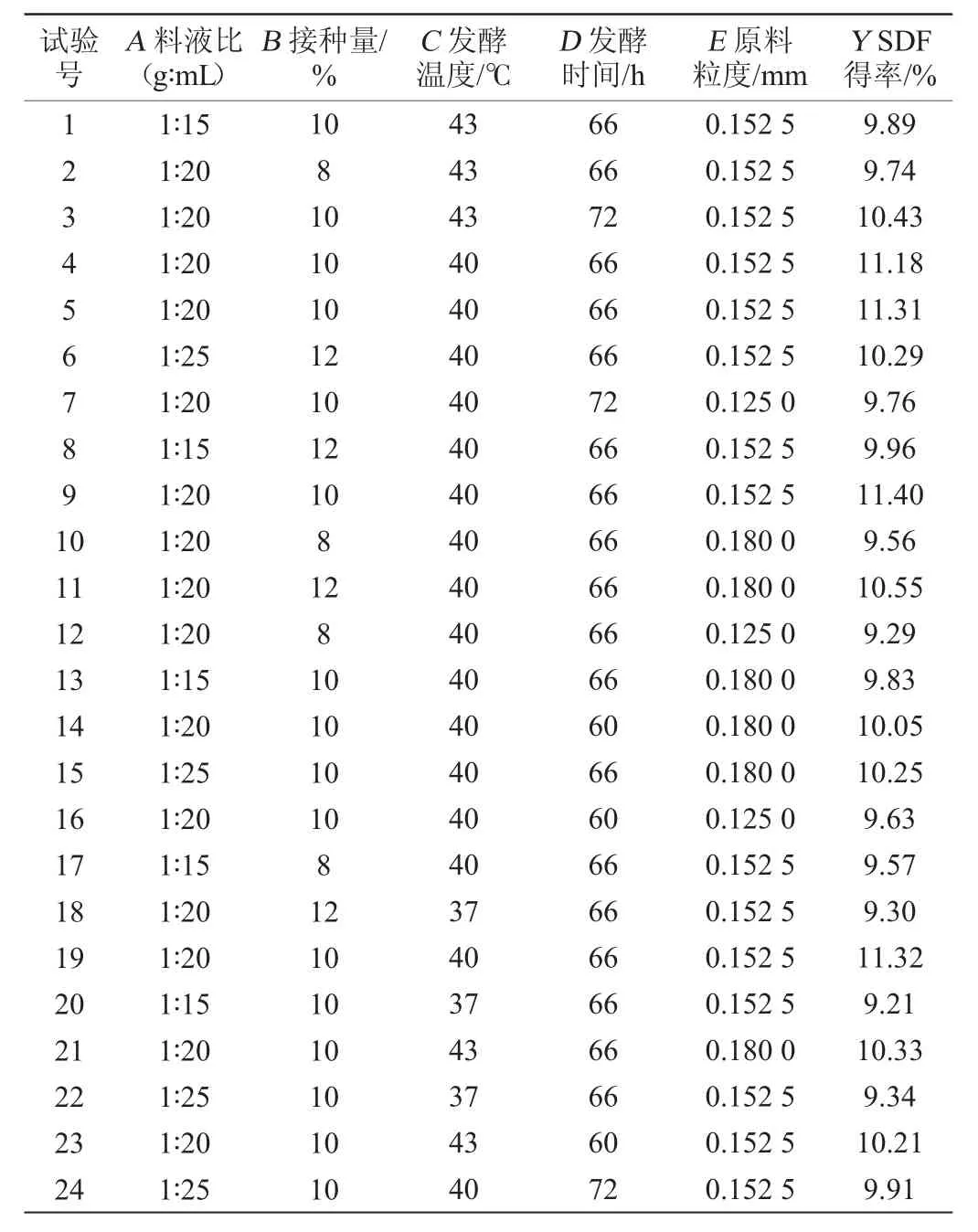
表2 Box-Behnken试验设计及结果Table 2 Design and results of Box-behnken tests

续表

表3 响应面试验方差分析结果Table 3 Variance analysis of response surface tests

续表
采用Design Expert 11软件,选用Box-Behnken模型,对表2中的结果进行回归拟合分析,得到回归方程Y=11.33+0.063A+0.34B+0.43C+0.069D+0.2E+0.13AB+0.032AC+0.12AD+0.12AE+0.037BC-0.049BD+0.19BE+0.044CD-0.14CE+0.053DE-0.83A2-0.83B2-0.79C2-0.69D2-0.67E2。
由表3可知,模型极显著(P<0.000 1),失拟项不显著(P>0.05),说明该模型的拟合程度较好。模型的决定系数R2=0.942 7,调整决定系数R2Adj=0.962 2,说明该模型试验值与预测值间相关性较高。由表3亦可知,一次项B、C、E及二次项A2、B2、C2、D2、E2均对SDF得率的影响极显著(P<0.01);一次项D及交互项AB、BE、CE对SDF得率的影响显著(P<0.05),其余项对SDF得率的影响不显著(P>0.05),说明试验因素对SDF得率的影响不是简单的线性关系[26]。
为考察交互项AB、BE、CE对SDF得率的影响,利用Design-Expert 11软件做出两因素交互作用的响应面及等高线图,结果见图6。
由图6可知,交互作用AB、BE、CE的响应面呈凸面,等高线呈椭圆形,对可溶性膳食纤维得率的影响显著,该结果与方差分析结果一致。采用Design-Expert 11软件对回归方程进行求解,得到发酵法制取红枣刺梨果渣SDF的最佳工艺参数为料液比1∶22(g∶mL)、接种量10.39%、发酵温度40.25 ℃、发酵时间65.28 h、原料粒度0.16 mm,在此条件下,SDF得率的理论值为11.44%。为便于实际操作,将最佳工艺参数调整为料液比1∶22(g∶mL)、菌株接种量10%、发酵温度40 ℃、发酵时间65 h、原料粒度0.16 mm。在此条件下进行验证试验,经过3次平行试验验证,得到刺梨-红枣果渣SDF的得率为(11.47±0.04)%,与模型预测结果基本一致,进一步说明了该模型适用于预测发酵法制备可溶性膳食纤维的研究。
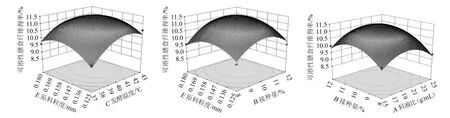
图6 各因素交互作用对可溶性膳食纤维得率影响的响应面及等高线Fig. 6 Response surface plots and contour lines of the effect of interaction between various factors on soluble dietary fiber yield
2.3 可溶性膳食纤维特性分析
新鲜果渣与发酵后果渣中可溶性膳食纤维的特性分析结果见表4。

表4 发酵前后刺梨-红枣果渣中可溶性膳食纤维特性分析结果Table 4 Analysis result characteristics of soluble dietary fiber from Rosa roxburghii-jujube pomace before and after fermentation
由表4可知,经微生物发酵处理后刺梨-红枣果渣中可溶性膳食纤维的持水力为18.22 g/g、膨胀力为14.13 mL/g、持油力为3.21 g/g,均显著高于新鲜果渣可溶性膳食纤维。说明利用发酵法制备的刺梨-红枣果渣可溶性膳食纤维品质有明显的提升。
2.4 可溶性膳食纤维扫描电镜分析
新鲜果渣与发酵后果渣中可溶性膳食纤维的扫描电镜结果见图7。

图7 发酵前后刺梨-红枣果渣中可溶性膳食纤维的扫描电镜图Fig. 7 Scanning electron microscopy of soluble dietary fiber from Rosa roxburghii-jujube pomace before and after fermentation
由图7可知,刺梨-红枣果渣经保加利亚乳杆菌和嗜热链球菌(1∶1)发酵后可溶性膳食纤维表面较新鲜果渣中可溶性膳食纤维疏松,形成了较多孔隙,SDF的比表面积增大,并呈现出复杂的束状多孔性空间网络结构,暴露出更多的亲水亲油基团,这利于水分渗入,直接导致了持水性、持油性和吸附能力的显著增加。这与李天等[27-28]的膳食纤维改性的结果相符。由图7d亦可知,刺梨-红枣果渣中可溶性膳食纤维的平均粒径为100 μm。
3 结论
以保加利亚乳杆菌和嗜热链球菌(1∶1)为发酵菌种,采用响应面法优化得到刺梨-红枣果渣膳食纤维的最优发酵制备条件:料液比1∶22、接种量10%、发酵温度40 ℃、发酵时间65 h、原料粒度0.16 mm,在此条件下,可溶性膳食纤维的得率为11.47%。本试验制备的可溶性膳食纤维持水力、膨胀力和持油力分别为18.22 g/g、13.14 mL/g、3.21 g/g,均显著高于未发酵刺梨-红枣果渣可溶性膳食纤维(P<0.05)。经扫描电镜分析,SDF呈疏松、束状多孔的内部结构,较原有的SDF结构更为疏松,渗水性更好,平均粒径为100 μm。本试验为推动刺梨-红枣果渣资源的充分利用,开发新型膳食纤维产品提供基本思路,同时证明利用微生物发酵法可获得高品质膳食纤维提供理论依据。

