原发性中枢神经系统弥漫性大B细胞淋巴瘤诊疗进展*
张汝江,张运周,高岱佺
(1.云南省瑞丽市人民医院,云南 瑞丽 678600;2.首都医科大学宣武医院,北京 100053)
原发性中枢神经系统淋巴瘤(Primary Central Nervous System Lymphoma,PCNSL)是一种罕见的原发性结外非霍奇金淋巴瘤(Non-Hodgkin's Lymphoma,NHL)的亚型,进展快,恶性程度高,病变主要累及大脑、小脑、脑干、脑膜、眼和脊髓等部位,排除其他系统淋巴瘤,约占原发性脑肿瘤的4%[1],其中80%~90%为弥漫性大B细胞淋巴瘤(Diffuse Large B-Cell Lymphoma,DLBCL)[2].近年来原发性中枢神经系统弥漫性大B细胞淋巴瘤(Primary Central Nervous System Diffuse Large B-Cell Lymphoma,PCNS-DLBCL)的发病率呈上升趋势,其发病机制尚不明确,临床表现及影像学特点缺乏特异性.组织病理学检查是确诊的金标准,但早期诊断困难,误诊率高且预后差,目前认为化疗是PCNS-DLBCL的一种有效治疗方式.为进一步增强对PCNS-DLBCL的认识,笔者拟对PCNS-DLBCL的发病机制、临床表现、诊断方法以及治疗措施进行综述.
1 流行病学
研究报道,PCNSL每年发病率为0.4/10万~0.5/10万[3],国外报道PCNSL发病中位年龄为65岁[4],而国内报道,免疫力正常患者的患病年龄较宽(24~77岁),中位年龄53~66岁,男女发病比例为1.2∶1~1.5∶1,约33.3%患者属于急性起病,53.3%患者属于亚急性起病,患者从发病到就诊时间均小于6个月[5-6].PCNSL的主要危险因素为获得性免疫缺陷(HIV)或先天性免疫缺陷,如共济失调血管扩张症、Wiskott-Aldrich综合征患者中发生PCNSL的风险率为4%[7];同时,医源性免疫缺陷亦可能导致PCNSL,如研究发现,器官移植患者中有1%~7%患者发生移植后淋巴增生性疾病,继而累及中枢神经系统[8-9];还有研究发现,长期使用免疫抑制剂进行免疫修饰治疗的结缔组织病如系统性红斑狼疮、干燥综合征、结节病或其他免疫性血管病患者更容易患PCNSL[10];此外,炎症、颅脑外伤和遗传等因素也可能与PCNSL的发生有关[11-12].
2 发病机制
目前,PCNSL的发病机制尚未明确[10,13].有研究在免疫功能低下的PCNSL患者体内检测到EB病毒,因此认为具有致癌作用的EB病毒可能与PCNSL的发病机制有关,但是在免疫力功能正常的PCNSL患者体内却未检测到EB病毒基因组DNA[14-15].还有研究发现,粘附分子CD44和细胞外基质分子如跨膜受体蛋白Fas(CD95)可参与PCNSL的播散[16-17].9p24.1号染色体的扩增,导致程序性死亡配体1(PD-L1)和程序性死亡配体2(PD-L2)的表达增加,而PD-L1和PD-L2可参与PCNSL的免疫逃避和调节机制[11,18].CD79B基因突变可激活NF-κB,促进恶性B细胞的增殖,MYD88基因突变可激活Toll样受体(TLR)信号通路,而MYD88基因突变和CD79B基因突变共同激活B细胞受体信号通路使PCNSL表现出致癌性[19-20].
3 临床表现
研究表明,PCNSL患者通常不出现盗汗、发热、体重减轻等全身性症状[21].PCNS-DLBCL的临床表现缺乏特异性,临床表现由病灶所累及的部位决定.在PCNS-DLBCL中,80%以上患者病变表现为脑实质侵犯并出现块状占位性表现,15%~25%患者病变表现为侵犯眼睛,会出现视力下降、视力模糊或眼前有漂浮物等眼部症状,11%~20%患者病变表现为侵犯软脑膜,6.7%患者病变表现为侵犯小脑,胸髓也是脊髓中最常受累的部位[5,22-24].研究报道,在发病数周内,56%~70% PCNS-DLBCL患者出现局灶性神经功能缺损症状(运动障碍、感觉障碍、言语障碍、共济失调等),其中32%~43%患者出现精神行为改变,32%~33%患者出现头痛、恶心、呕吐等颅内压增高症状,11%~14%患者出现癫痫发作[21,25].
4 诊断方法
由于PCNSL的临床表现缺乏特异性,及时诊断困难.对于可能患有PCNSL的患者,医生在详细询问患者病史的基础上,还应对患者进行一系列身体检查,检查指标可参考国际PCNSL协作小组(IPCG)制定的评估疾病程度的检查指标[26]:(1)体格检查、淋巴结检查、睾丸检查、全面的神经系统检查;(2)实验室检查:血常规、血清乳酸脱氢酶水平、血清HIV抗体;(3)脑脊液检查:白细胞数,蛋白质,葡萄糖,细胞学、流式细胞学、IgH基因重排;(4)骨髓评估:骨髓抽吸和活检;(5)眼科检查:裂隙灯检查;(6)MRI检查:脑和脊髓(如果有临床症状);(7)PET-CT:胸部、腹部和骨盆;(8)睾丸超声;(9)认知/功能评估:MMSE.PCNSL诊断的金标准是病理学检查.
4.1 MRI检查
磁共振成像(MRI)增强扫描是PCNSL患者的首选检查方式,对于不宜接受MRI的患者,可以选择增强CT检查.国内研究报道,PCNSL病变以单发病灶为主,其中76.7%~88%患者病变部位位于幕上,6%~8.3%患者病变部位同时累及幕上、幕下,6%~9.3%患者病变部位累及幕下[5,27].PCNSL在MRI T1加权像呈等或稍低信号,在T2/FLAIR加权像呈等或稍高或高信号,病灶与周围组织分界不清,病灶周围出现不同程度水肿带;病灶增强可表现为团状、结节状、环状、半开环状或厚环样等不规则均匀或不均匀强化.耿承军等[28]认为PCNSL瘤内新生血管少,肿瘤细胞缺乏血供破坏血脑屏障导致对比剂外渗是病灶强化的机制;弥散加权成像(DWI)和FLAIR上呈不同程度的高信号(如图1、图2所示);磁共振波谱(MRS)常显示Lip峰高耸,Cho峰明显升高,NAA峰和Cr峰明显降低;灌注加权成像(PWI)均见病灶强化区呈低灌注,即平均通过时间(MTT)、达峰时间(TTP)延长,脑血容量(CBV)和脑血流量(CNF)下降[6].PCNSL病灶在(18F-FDG)PET/CT上主要表现为高代谢,PET/CT目前已被应用于淋巴瘤的分期、疗效评估和预后判定[29].

图1 MRI显示PCNSL病灶T1WI(1A)、T2WI(1B)、FLAIR(1C)均呈等或稍长信号,水肿明显,DWI(1D)呈稍高信号;增强扫描(1E、1F),病灶不均匀强化
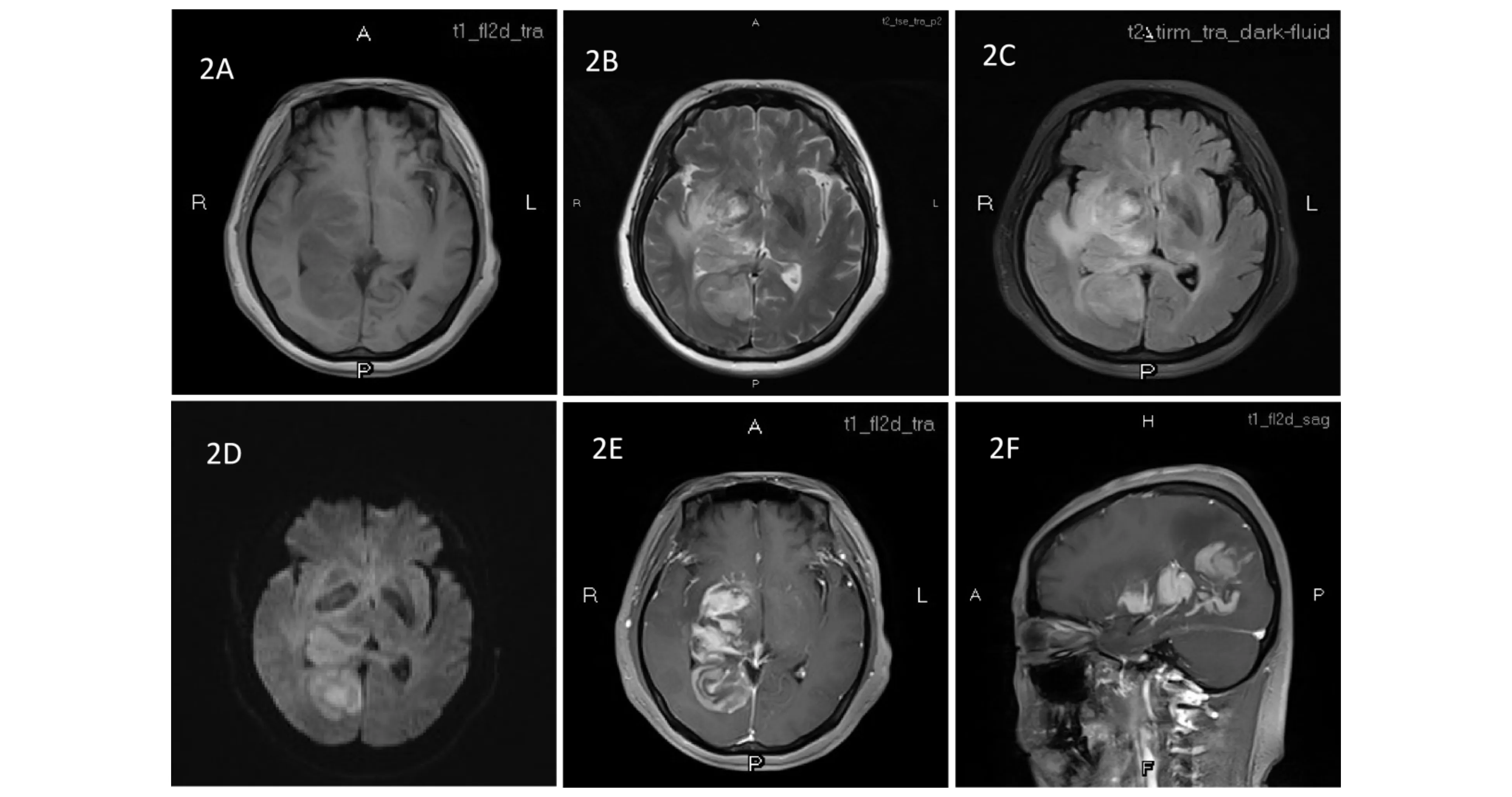
图2 MRI显示PCNSL病灶T1WI(2A)为略低信号;T2WI(2B)、FLAIR(2C)为片状、团块状不规则等高信号,边界不清,病灶周围见水肿带,局部脑组织肿胀;DWI(2D)呈稍高信号;增强扫描(2E、2F):病灶呈片状、“握拳状”强化,右侧顶枕叶软脑膜,大脑镰,小脑幕线状强化,右侧侧脑室见条片状强化
4.2 脑脊液检查
对于可能患有PCNSL患者的脑脊液检查应包括细胞计数、蛋白质、葡萄糖、细胞学、流式细胞术、IgH基因重排试验和二代测序检查.PCNSL患者脑脊液典型表现为蛋白质升高,葡萄糖正常,以淋巴细胞占优势的白细胞增多;研究发现,40% PCNSL患者脑脊液可检测出恶性淋巴细胞[30].Roy等[31]报道通过流式细胞仪找到κ或γ限制性表达的B细胞也有助于诊断PCNSL,但阳性检出率较低;Song等[32]研究发现当CSF中IL-10/IL-6大于0.72,对诊断PCNSL有较高的特异性和敏感性;Chukwueke和Nayak[30]研究发现通过检测脑脊液中IgH基因重排和克隆B细胞亚群有助于评估PCNSL的预后及是否累及软脑膜的诊断;除了上述几种检测方式,代测序也正逐步应用于PCNSL的诊断和随访中[33].
4.3 病理学诊断
组织病理学检查是PCNSL诊断的金标准,对于可能患有PCNSL且能耐受手术活检的患者应尽早进行立体定向活检.研究报道,立体定向活检可避免神经损害,降低死亡率[30].在组织病理学上,PCNSL表现为具有高度恶性、较高增殖能力的B淋巴细胞主要围绕血管浸润生长,形成“袖套样”结构.免疫组化显示PCNSL肿瘤细胞表达泛B细胞标记物,包括CD20,CD79a,MUM1,BCL6,IRF4,CD10,BCL2等标记物,绝大多数的PCNSL属于非生发中心型[34-35].研究报道,PCNSL的预后效果与BCL2和Myc的高表达有关[36-37].在确保安全的情况下,为最大限度地提高活检的诊断质量,应尽量避免使用皮质类固醇激素,因为使用皮质类固醇激素短期治疗会导致病变消失[38-39],不利于诊断PCNSL.
5 治疗措施
研究报道,50~69岁的PCNSL患者进行治疗后平均总体生存期(OS)为35月,大多数患者不能治愈,未经治疗的PCNSL患者病情发展迅速,平均OS仅为6周[40].研究认为,BCL6的重排和q22的缺失会缩短OS[41].
5.1 诱导期治疗
新诊断PCNSL的标准诱导治疗方案包括大剂量甲氨蝶呤化疗和全身放疗(WBRT).由于WBRT的远期神经毒性严重影响认知功能,会增加死亡率,因此WBRT在PCNSL的治疗中应用较少.目前,大剂量甲氨蝶呤单药或联合其他化疗药物的治疗方案被认为是最有效和最佳的诱导方案[42,29].研究表明,甲氨蝶呤剂量为3~8 g/m2时能使血清和脑脊液血药浓度达到治疗浓度,临床上最常用的甲氨蝶呤剂量是3~3.5 g/m2[43].Rubenstein等[29]研究表明,诱导期采用大剂量甲氨蝶呤(8 g/m2)合并利妥昔单抗和替莫唑胺治疗,可提高患者预后;Ferreri等[44]比较了3种诱导方案的治疗效果,即甲氨蝶呤/西塔拉宾、甲氨蝶呤/西塔拉宾/利妥昔单抗和甲氨蝶呤/西塔拉宾/利妥昔单抗/噻吩、MATRIx(利妥昔单抗+噻替哌+MTX+阿糖胞苷),证实了MATRIx在总体生存、无进展生存(PFS)和总体反应率方面均优于其他诱导方案.Morris等[45]和Shah等[46]研究表明大剂量甲氨蝶呤、利妥昔单抗、丙卡巴肼和长春新碱联合应用可使60%患者获得CR(完全缓解).Reni等[47]研究发现,接受高剂量甲氨蝶呤化疗的患者中,大约30%~60%患者实现了CR.
5.2 巩固期治疗
PCNSL患者经过以大剂量甲氨蝶呤化疗为基础的诱导治疗后,60%患者能够实现CR,但考虑到疾病复发的风险,仍然需要进一步巩固治疗.巩固治疗方案包括WBRT、自体干细胞移植(ASCT)和使用通过血-脑脊液屏障的新型药物等.研究发现,患者经过高剂量甲氨蝶呤诱导治疗后再进行高剂量(45Gy)全脑放疗可以延长无症状生存期,但不能改善OS,且神经毒性明显增加,而采用高剂量甲氨蝶呤诱导治疗结合低剂量(23.4Gy)全脑化疗的措施可以降低远期神经毒性发生率[45,48-49].患者接受诱导期大剂量甲氨蝶呤与利妥昔单抗、丙卡巴肼和长春新碱联合治疗后,继续接受低剂量WBRT巩固治疗,患者的中位PFS和OS分别提高至3.3年和6.6年[45-46].Illerhaus等[50]研究发现大剂量甲氨蝶呤+阿糖胞苷+噻替哌+利妥昔单抗的诱导治疗后,采用大剂量卡莫司汀/噻替哌和ACST巩固治疗,可以获得CR,总反应率达91%,2年生存率达87%.患者在诱导期接受大剂量甲氨蝶呤合并利妥昔单抗和替莫唑胺治疗后,巩固期使用依托泊苷和阿糖胞苷治疗可达到CR,在中位PFS为4.9年的随访患者中,65.9%患者达CR,继续进行巩固治疗,中位PFS为2.4年[29].大量研究表明,与WBRT或单独化疗相比,ASCT合并大剂量化疗的疗效更好.有研究比较了以噻替哌为基础的化疗联合ASCT或WBRT两种治疗方式对PCNSL的疗效差异,发现两种治疗方法均有效,两年期PFS无显著性差异,但采用ASCT治疗的患者血液学毒性更高,WBRT治疗的患者认知障碍更明显.虽然WBRT治疗存在远期神经毒性的风险,但在有全身治疗禁忌症的患者中,巩固期可以选择使用低剂量WBRT治疗[45].
5.3 复发性/难治性PCNSL治疗
临床和影像学随访的疾病监测指南推荐,在患者达到CR的前2年,医护人员每3个月对其随访1次,在接下来的3年里,每6个月随访1次,之后每年随访1次,至少坚持5年.研究报道,诱导和巩固治疗后,治疗后1年内复发的患者生存率较低,而大多数患者病情会在治疗后5年复发[51-52].Langner-Lemercier等[53]研究发现,大剂量甲氨蝶呤化疗和自体造血干细胞移植措施可用于治疗复发性/难治性PCNSL,3年无症状生存率为53%,OS为64%.尽管PCNSL对放疗敏感,全脑放疗中位OS为11~16月,但由于全脑放疗有远期神经毒性,目前使用较少[54].Soussain等[55]报道在最初治疗过程中没有进行自体移植的患者,可以选择以噻替哌为基础的化疗联合ASCT的治疗方案.其他治疗方案包括施用大剂量阿糖胞苷和培美曲塞等.有研究发现,一些新的靶向药物在复发性/难治性PCNSL治疗中显示出令人鼓舞的效果,包括BTK抑制剂(依鲁替尼)以及免疫调节药物(利那度胺和泊马度胺)[56].同时,一些免疫靶向抑制剂如派姆单抗和纳武单抗,目前正被用于治疗复发性/难治性PCNSL[57].此外,Tu等[58]研究发现嵌合体抗原T细胞受体在治疗复发性/难治性PCNSL中具有潜在的安全性和有效性.
6 展望
PCNS-DLBCL是一种罕见的NHL变异型,会累及中枢神经系统的任何部位,临床表现缺乏特异性,对于临床高度怀疑的患者必须及时进行预处理评估和及时启动治疗.目前,大剂量施用甲氨蝶呤单药或联合其他化疗药物的治疗方案被认为是最佳诱导方案.复发性/难治性PCNS-DLBCL的治疗依然面临很大的困难和挑战,但随着PCNS-DLBCL发病机制的分子和遗传机制、信号通路和生物标记物等研究的进步,未来将会出现新的治疗方法,进一步提高PCNS-DLBCL的治疗效果和预后.

