褐煤微生物成气的影响因素与菌群变化的关系分析
丁超,韩作颖,杨秀清*
(1.山西大学 生物技术研究所 化学生物学与分子工程教育部重点实验室,山西 太原 030006;2.煤与煤层气共采国家重点实验室,山西 晋城 048000)
0 引言
国民经济的高速发展促使我们在煤炭石油等不可再生资源外寻找可替代的优质清洁能源,煤层气作为一种非常规天然气,正凭借其自身的优势获得越来越多的关注[1]。褐煤等煤化程度较低的煤,直接燃烧效益不高且会对环境造成污染。但是其中氧含量及侧链官能团较多,适合微生物利用,为生物产气提供了物质基础[2]。生物成因煤层气是由产甲烷菌等厌氧菌代谢煤或煤层物质产生的以甲烷(CH4)为主要成分的气体。微生物增产煤层气技术已成为煤层气开采、增产领域的研究热点[3]。
研究结果表明,多种因素影响产甲烷菌群将煤转化为煤层气的效率。林海等[4]发现从含氧低的污泥中富集得到的厌氧微生物能利用褐煤产气,当菌种经褐煤驯化后,产气周期明显缩短且产气量提高。王艳婷等[5]经过筛选得到温度、pH、NaCl浓度、煤浆浓度4个因素对褐煤产气影响较为显著。Green等[6]以粉河盆地产出水中富集的产甲烷菌群为研究对象,证明温度、pH、煤的颗粒度等理化因素均会对产气速率有显著影响。但是目前国内外关于产气影响因素、微生物菌群结构和产气情况之间的关系特别是菌群结构变化与产气的关联性分析并不多见。
煤层气相关微生物多样性分析常见于克隆文库、T-RFLP、DGGE、高通量测序等,PCR-DGGE技术凭借其精确性、高效性、便捷性等优点被视作较为合适的选择。但是PCR-DGGE本身存在一些缺点,如需要一定的实验周期对多样性分析过程中DGGE条带克隆及测序,从而无法对DGGE条带种属地位进行快速直观地表征。为了克服这些缺点,Mavragani等[7]在研究核腔菌污染样品时引入物种参照,不仅提高结果的精确性,避免克隆的偏好性,而且不需要切胶克隆,可以节省大量时间。Nalepa等[8]在研究生鲜奶和奶酪中的微生物时,根据样品中微生物开发了一套物种DNA Marker,研究结果同样证实了Mavragani的结论。本课题组在前期工作的基础上,开发了2套煤层气微生物物种DNA Maker[9-10](发明专利,已公开),为快速批量分析煤层水样或生物成气过程中煤微生物多样性,及时反馈调控生物成气提供了极大的方便。本文我们引入煤层气微生物物种DNA Maker,通过PCR-DGGE对样品种群结构进行快速分析,研究不同影响因素对应的产气情况,并对微生物菌群结构变化和产气进行关联性分析,以期加速信息反馈进而指导产气调控,同时为生物成因煤层气的增产提供借鉴。
1 材料和方法
1.1 褐煤样品采集
褐煤煤样取自内蒙古锡林浩特市神华胜利煤田。依据后期颗粒度单因素实验需要,将褐煤样本经破碎后筛分至不同粒度。实验所用菌种分离自山西寺河矿区煤层气井中产出水样富集驯化后的培养液。
1.2 主要试剂及仪器
核糖核酸酶A溶液、去离子甲酰胺、尿素、琼脂粉、琼脂糖N、4S Red Plus核酸染色剂(10 000X水溶液)、过硫酸铵(APS)、四甲基乙二胺(TEMED)、SanPrep柱式质粒DNA小量抽提试剂盒、SanPrep柱式DNA胶回收试剂盒,生工生物工程(上海)股份有限公司;EasyTaq®DNA Polymerase、DNA Ladder,北京全式金生物技术有限公司。
基本培养基、褐煤产气培养基、微量元素及维生素的配方参照梁祺[11]的相关报道。
机械振荡器Mini-Beadbeater,美国Biospec公司;YQX-Ⅱ型厌氧手套箱,上海海向仪器设备厂;气相色谱仪,安捷伦6890N;DYY-6C型电泳仪,北京六一生物科技有限公司;T100™Thermal Cycler PCR仪、DCode™通用突变检测系统,美国BIORAD公司;Thermo Scientific Nicolet iS50傅立叶变换红外(FT-IR)光谱仪。
1.3 褐煤生物成气单因素实验
以500 mL厌氧瓶作为褐煤产气实验反应容器。在厌氧工作站中按设置分装好煤粉、菌液和培养基,35℃恒温培养。利用气相色谱仪检测气体组分并记录产气量。
(1)煤颗粒度因素设置40目、80目、120目、160目和对照(不加煤)共5组实验,除颗粒度外其余参数相同(固液比1∶15,接种量20%),每组3个重复;
(2)固液比因素设置1∶10(30 g煤粉+300 mL液体)、1∶15(20 g煤粉+300 mL 液体)、1∶20(15 g煤粉+300 mL液体)和对照(不加煤)共4组实验,除固液比外其余参数相同(颗粒度120目,接种量20%),每组3个重复;
(3)接种量因素设置5%(286 mL培养基+14 mL菌液)、10%(273 mL培养基+27 mL菌液)、15%(261 mL培养基+39 mL菌液)、20%(250 mL培养基+50 mL菌液)和对照(不加接种物)共5组实验,除接种量外其余参数相同(颗粒度120目,固液比1∶15),每组3个重复。
1.4 PCR-DGGE指纹图谱分析
1.4.1 微生物总基因组DNA提取
在发酵周期的前中后阶段取样,并提取基因组,具体方法参照文献[12]。
1.4.2 PCR扩增
提取的样品基因组作为模板,用细菌V3区和古菌V3-V4区通用引物进行目的片段的扩增。在质量分数1.5%的琼脂糖凝胶中检测目的片段。
1.4.3 煤地质微生物物种DNA Marker的制备
所用煤地质微生物细菌和古菌物种PCR-DGGE DNA Marker参照杨秀清等方法[9-10]制备,并结合各泳道内DNA Marker条带数和条带间距等要素作出适当的修改。
1.4.4 变性梯度凝胶电泳(DGGE)分析
采用BIO-RAD Dcode系统对样品16S rRNA基因片段PCR产物进行DGGE指纹图谱分析。样品电泳时,将煤层微生物物种DNA marker和样品16S rRNA基因片段PCR产物上样于同一块变性胶上。变性梯度40%~60%,温度60℃、电压85 V条件下电泳12 h。凝胶成像仪采集胶图信息并用定量软件Quantity One进行后续操作。
1.5 数据分析
单因素实验产气结果以平均值±标准偏差计;统计分析软件SPSS Statistics 22中的单因素方差分析(One-way ANOVA)方法分析颗粒度等因素对产气的影响,显著性水平设定为0.05;应用生态学数据处理软件Canoco 5中的冗余分析(RDA)方法分析各因素样本、环境因子与微生物群落之间的关系。
1.6 褐煤FTIR分析及分峰拟合
取KBr载体置于玛瑙研钵中,加入少许煤样,充分研磨、混匀、装模,用压片机把样品压制成透明薄片。固定薄片进行扫描测试,扫描波数范围为650 cm-1~4 000 cm-1,分辨率为 4 cm-1,累加扫描次数为16次。
使用Origin 8.5软件对红外光谱谱图进行分段分峰拟合(Gaussian Fitting)。
2 结果与讨论
2.1 褐煤生物成气单因素优化实验
2.1.1 煤颗粒度对甲烷产量的影响
煤颗粒度对产气的影响结果如图1所示,随着煤颗粒目数的增大(即粒径的减小),90 d发酵周期内甲烷累计产量不断增加。当颗粒度为160目时,最大甲烷产气量达到543 mL。
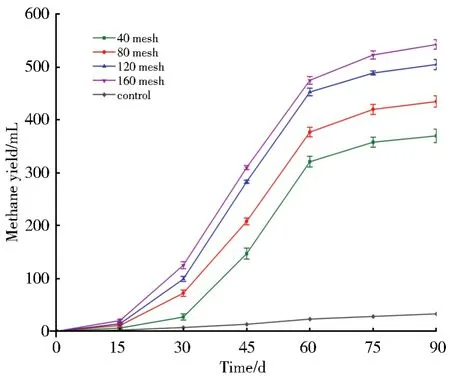
图1 不同煤颗粒度对甲烷产量的影响Fig.1 Effects of different coal particle size on methane production
有报道称褐煤利用外源产甲烷菌群的产气周期,可以分为产气速率显著增高、缓慢增高、趋于停止3个阶段[13]。本实验中各因素所对应的产气情况符合这一趋势。前期产气较慢可能因为煤本身是一种复杂的生物大分子。当煤经降解成为小分子物质时,才易于被微生物利用。随着煤粒径目数的增大,煤表面破碎程度也增大,某些难降解的复杂结构被打碎,适合产甲烷菌群的降解[14]。煤的比表面积也相应提升,固液之间接触面积越大,相应的固液传质速率越快,即煤中有机质溶出速率越快。单因素方差分析结果显示,高目数组(160目)的产气值与低目数组(40目)相比存在显著性差异(P<0.01)。
2.1.2 固液比对甲烷产量的影响
不同固液比对甲烷产量的影响如图2所示。固液比为1∶20,即煤粉添加量15 g时,累计产甲烷量为510 mL,此时产气情况最好。
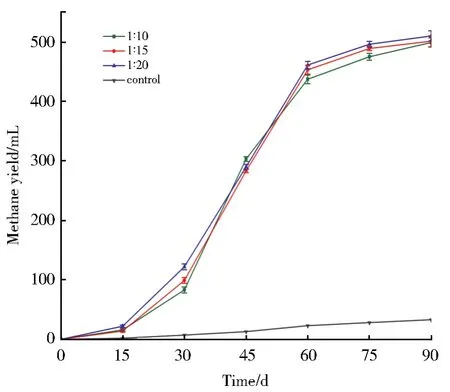
图2 不同固液比对甲烷产量的影响Fig.2 Effects of different solid-liquid ratio on methane production
煤可被微生物利用的有机物有限。随着煤量增加,理论上微生物能够利用的底物也随之增加,从而导致产气量的增长。但是当煤粉添加量突破一定限度,如本实验中添加量至15 g以上时,煤粉颗粒可能产生堆积,有效参与传质的比表面积并未增加。单因素方差分析固液比因素对产气的影响,低煤粉添加量组(1∶20)对应产气值相比高添加量组(1∶10)不存在显著性差异(P>0.05)。
2.1.3 接种量对甲烷产量的影响
接种量因素对甲烷产量的影响见图3,甲烷产量随接种量的增加而小幅上升。接种量为20%时,产气情况最好,发酵周期内累计产甲烷504 mL。
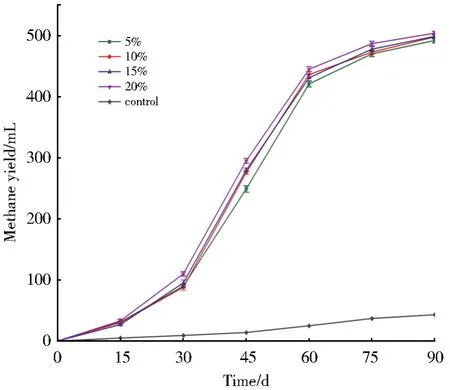
图3 不同接种量对甲烷产量的影响Fig.3 Effects of different inoculation amount on methane production
在厌氧发酵中,加入一定量的微生物作为接种物是必要的。该组实验中,不接种的对照处理组产气情况差,而接种量越大,启动越快,CH4累积量越多。比较低接种量组与高接种量组产气数据,单因素方差分析结果表明二者存在显著性差异(P<0.05)。
2.2 PCR—DGGE指纹图谱分析
2.2.1 样品基因组的提取及16S rRNA目的片段扩增
质量分数0.7%琼脂糖凝胶电泳检测所提基因组,质量完好,可用于后续实验。质量分数1.5%琼脂糖凝胶电泳检测16S rRNA目的片段扩增产物,条带符合理论预期,可用于DGGE分析。
2.2.2 DGGE分析
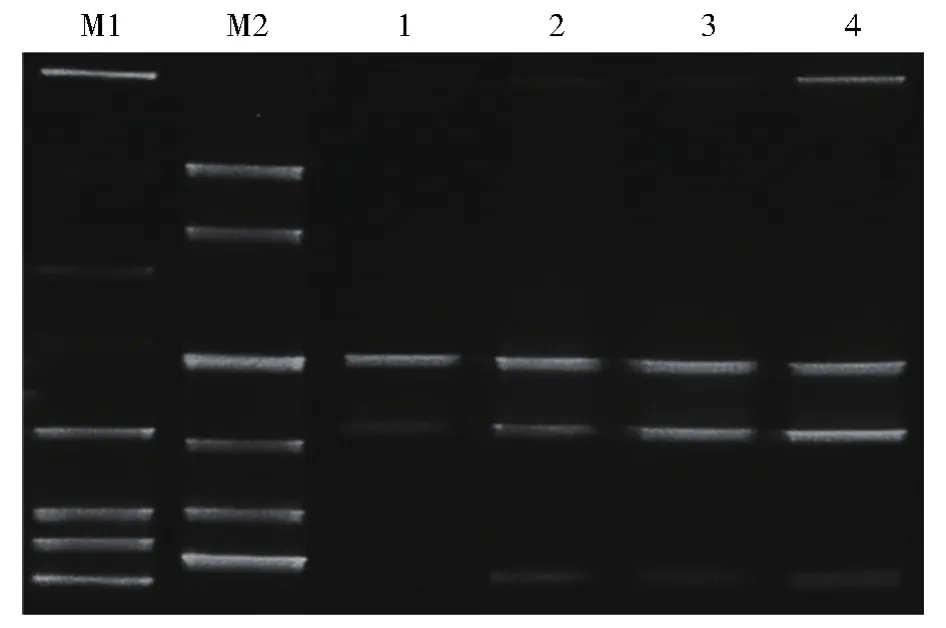
鉴于颗粒度对产气影响极显著,我们以颗粒度样品为例,进行成气过程中菌群结构的分析。细菌16S rRNA V3区PCR-DGGE图谱见图4。本文引入煤地质微生物细菌物种DNA Marker,根据DGGE能将片段大小相同而碱基组成不同的DNA片段分开的特性,认为样品中与Marker处于同一水平位置的条带所属菌属地位与对应的Marker相同。分析DGGE指纹图谱,与煤地质微生物细菌物种DNA Marker相匹配的有Clostridium、Tissierella、Desulfovibrio、Proteus、Citrobacter、Syntrophus、Lutaonella和Parabacteroides等属菌种,它们分属厚壁菌门、变形菌门和拟杆菌门等三个细菌门类。
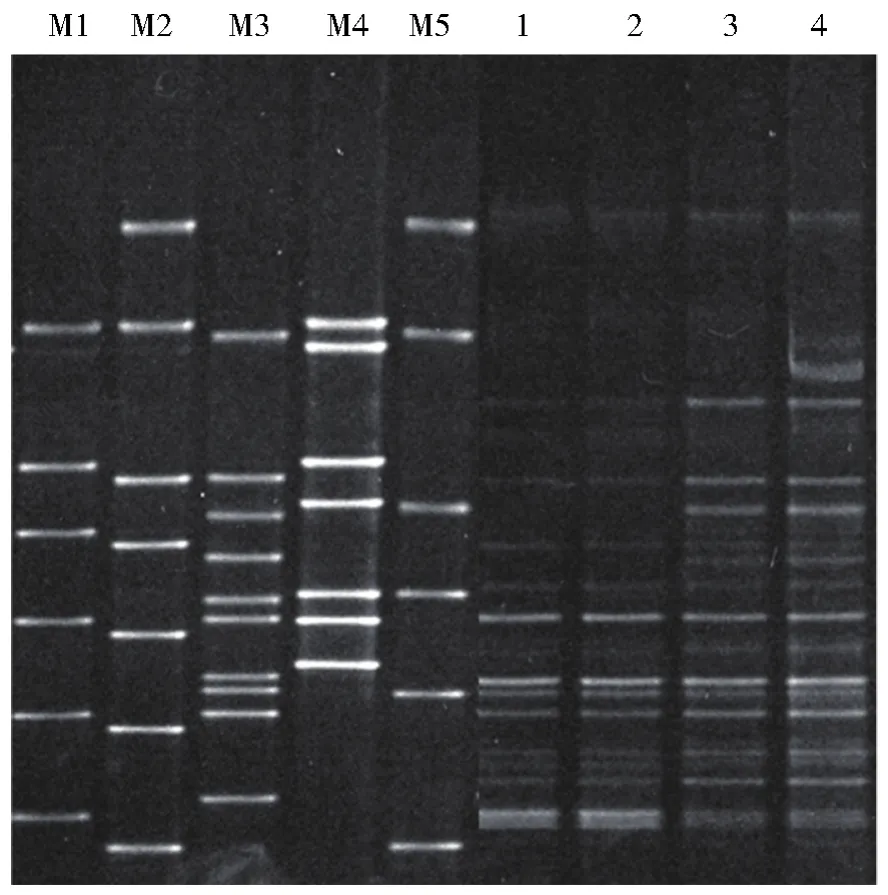
注:M1-M5:细菌物种DNA Marker 1—4分别代表颗粒度组目数为40目、80目、120目和160目的样品图4 细菌16S rRNA V3区PCR-DGGE图谱M1-M5:Bacterial species DNA Marker 1-4 represents samples with a particle size of 40 mesh,80 mesh,120 mesh,and 160 mesh,respectivelyFig.4 PCR-DGGE fingerprint of bacterial 16S rRNA V3 region
厚壁菌门(Firmicutes)中的微生物主要参与生成部分混合酸、醇和中性物质,Clostridium菌属在一些淀粉、纤维质和几丁质的解聚过程中起到关键作用[15],Tissierella菌属可以利用有机物代谢产生乙酸、丁酸、氨氮和二氧化碳等物质[16]。变形菌门(Proteobacteria)是细菌中最大的一门,所有变形菌门细菌均为革兰氏阴性菌,其外膜主要由脂多糖组成。Desulfovibrio为硫酸盐还原菌,为微生物提供能量同时减轻对甲烷菌的竞争性抑制及毒害作用[17]。Proteus是一类兼性厌氧细菌,以氧化和发酵形式分解糖类产酸产气。Citrobacter菌属具有降解长链烷烃和还原硫酸盐等功能[18-19]。Syntrophus菌属具有降解烷烃和长链脂肪酸等功能[20-21]。拟杆菌门(Bacteroidetes)是一大类化能自养型微生物,样品中属于该门的菌属有Lutaonella、Parabacteroides等,它们主要参与蛋白质、糖、纤维素等大分子物质的降解,发酵产生甲酸、氢气和二氧化碳等。各样品细菌相对物种丰度情况如图5所示,细菌群落多样性较为丰富,样品间细菌种类相对丰度有较明显差异。
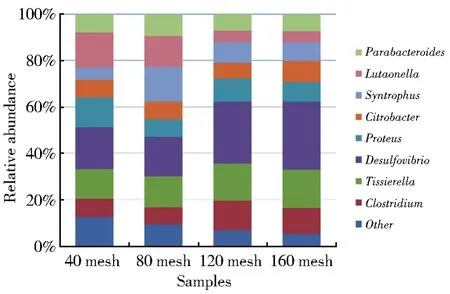
图5 细菌菌群相对丰度柱状图Fig.5 Histogram of relative abundance of bacterial flora
古菌16S rRNA V3-V4区PCR-DGGE图谱见图6。本实验中引入煤地质微生物古菌物种DNA Marker,认为样品中与Marker处于同一水平位置的条带所属菌属地位与对应的Marker相同。与煤地质微生物古菌物种DNA Marker相匹配的有Methanosarcina、Methanoculleus和Methanobacterium属的菌种。需要说明的是,DGGE图谱显示样品内共有4组古菌条带,经过匹配,其中两组均为Methanosarcina菌属,可以认为它们是甲烷八叠球菌属下的不同种。产甲烷菌代谢类型主要包括氢营养型、乙酸营养型、甲基营养型和混合营养型,最新报道中可利用甲氧基的芳香族化合物直接产甲烷[22-23]。分类学上产甲烷菌被分为甲烷杆菌纲、甲烷球菌纲、甲烷微菌纲和甲烷火菌纲4纲7目。本文与煤地质微生物古菌物种DNA Marker相匹配的菌种均为广古菌门(Euryarchaeota),从属水平分析可以发现群落中甲烷八叠球菌目的甲烷八叠球菌属(Methanosarcina)和甲烷微菌目的甲烷囊菌属(Methanoculleus)占据绝对优势。另外,还有丰度较低的甲烷杆菌目的甲烷杆菌属(Methanobacterium)。
注:M1-M2:古菌物种DNA Marker 1—4分别代表颗粒度组目数为40目、80目、120目和160目的样品图6 古菌16S rRNA V3-V4区PCR-DGGE图谱M1-M2:Archaea DNA Marker 1-4 represents samples with a particle size of 40 mesh,80 mesh,120 mesh,and 160 mesh,respectivelyFig.6 PCR-DGGE fingerprint of Archaea 16S rRNA V3-V4 region
甲烷八叠球菌目是形态最丰富的一个目,在自然界分布广泛,极端严格厌氧。当生长于H2时,CH4由甲醇和甲基胺还原而来;还可以代谢H2+CO2或乙酸,但从不利用甲酸。氮源为氨、甲基胺和N2,硫化物和元素硫可作为硫源[24-25]。Methanobacterium极端严格厌氧,能量代谢来源于还原CO2为CH4,电子供体只有H2、甲酸盐、二元醇和CO,不能代谢甲基胺和乙酸,可在水田、沉积物或其他缺氧的且除CO2外无其他无机电子受体(如硝酸盐或硫酸盐)存在的环境分离到。Methanoculleus属于甲烷微菌纲,以H2+CO2作为代谢底物,大部分也可以利用甲酸盐为电子供体来还原CO2[26]。各样品古菌相对物种丰度情况如图7所示,古菌群落多样性较为单一,样品间古菌种类相对丰度存在较大差异,Methanosarcina和Methanobacterium的含量随煤样目数增加而增加,Methanoculleus的含量则呈现下降趋势。
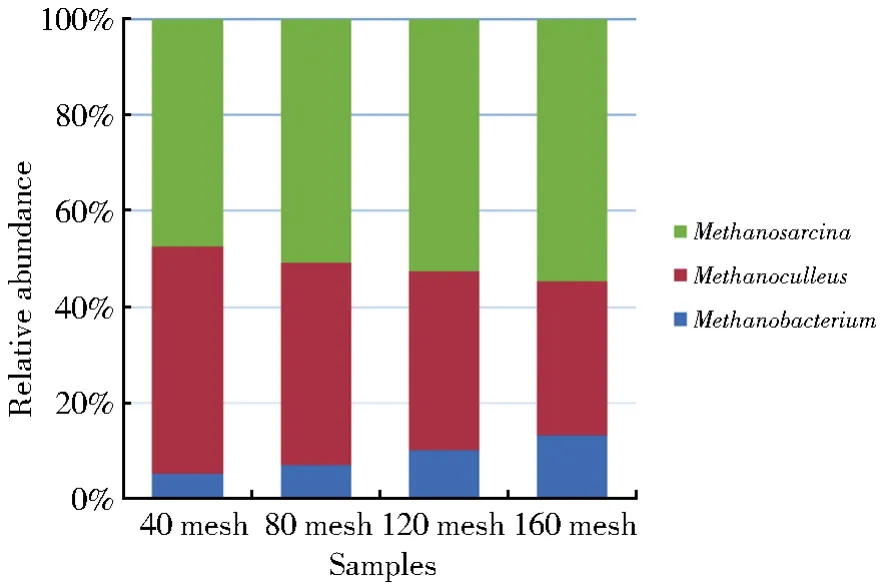
图7 古菌菌群相对丰度柱状图Fig.7 Histogram of relative abundance of Archaea
2.3 影响因素、菌群结构与产气量的关联性分析
RDA分析可以检测环境因子、样品、菌群三者之间的关系或者两两之间的关系。基于细菌物种和古菌物种进行的RDA分析结果见图8和图9。从图8可知,3种环境因子间无明显交互作用。Citrobacter、Lutaonella、Parabacteroides、Syntrophus与接种量因素成正相关关系,且Lutaonella的响应程度较大。Clostridium、Desulfovibrio、Tissierella、Proteus与颗粒度因素成正相关关系,且Clostridium和Tissierella的响应程度较大。Parabacteroides、Syntrophus、Proteus、Tissierella与固液比因素成正相关关系,Tissierella的响应程度较大。
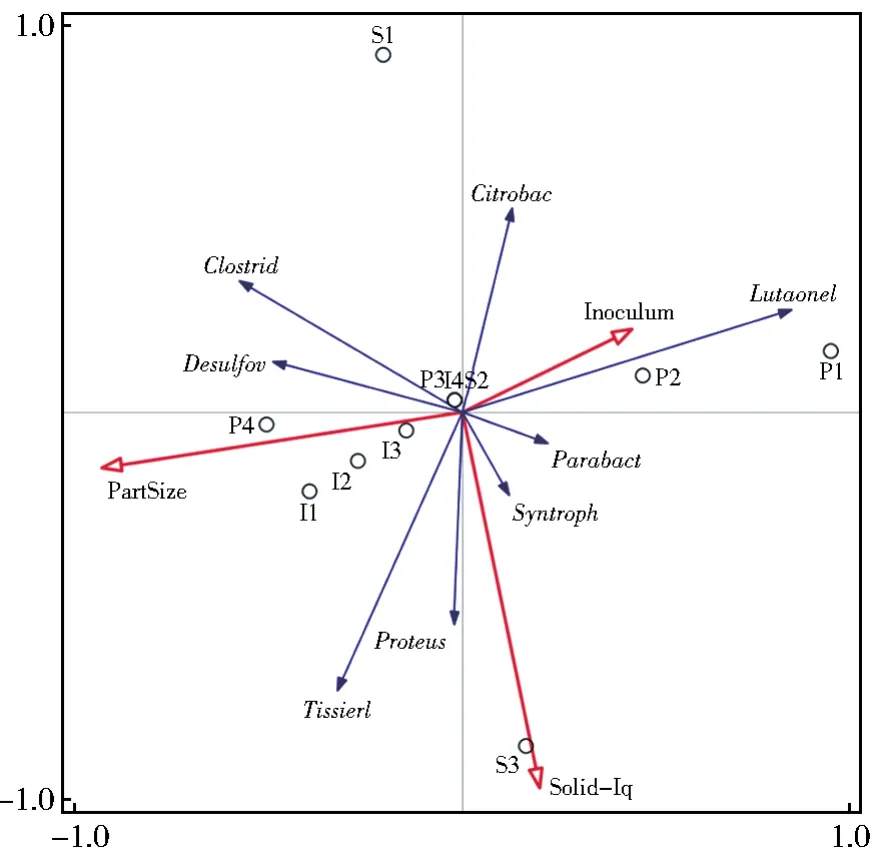
注:圆圈表示不同单因素条件下的样本组(P:颗粒度,S:固液比,I:接种量);红色箭头表示环境因子;蓝色箭头表示不同属的细菌/古菌物种。图中部分菌种名采取简写形式。图8 基于细菌物种进行的RDA分析Circles indicate sample groups under different single factor conditions(P:granularity,S:solid-liquid ratio,I:inoculation amount);red arrows indicate environmental factors;blue arrows indicate bacteria/archae species of different genera;species and environment.Some strain names in the picture are abbreviated.Fig.8 RDA analysis based on bacterial species
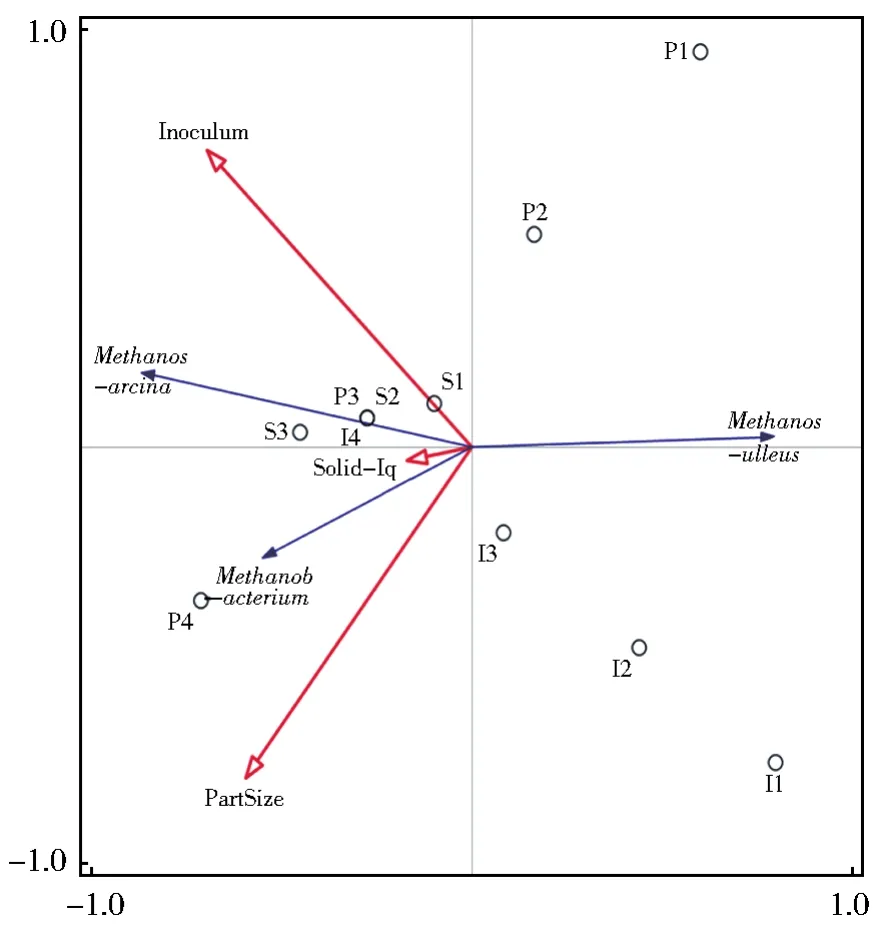
图9 基于古菌物种进行的RDA分析Fig.9 RDA analysis based on archaea species
观察图9结合分析导出结果,颗粒度因素对古菌物种的影响具有显著性(P<0.05),可以认为是驱动群落变异的主要因子。环境因子层面,固液比与接种量,固液比与颗粒度之间都是正相关关系。Methanoculleus与三个环境因子间均为负相关关系,Methanosarcina与Methanobacterium与三个环境因子间均为正相关关系。颗粒度因素组的四个样本(P1:40目,P2:80目,P3:120目,P4:160目)随着煤粒径目数的增大,Methanosarcina与Methanobacterium的含量也增多。结合古菌菌群结构变化和颗粒度因素组产气数据绘制气泡图,结果如图10所示,横纵坐标分别对应Methanosarcina与Methanobacterium两种古菌类型在相应目数样品中的含量,气泡的大小指代产气量的高低。不难发现随着煤样样品目数的增大,产甲烷菌Methanosarcina与Methanobacterium的含量增多,产气量也呈上升趋势。
2.4 褐煤FTIR分析及分峰拟合
2.4.1 褐煤FTIR分析
利用傅里叶变换红外光谱(FTIR)对颗粒度组实验采集的煤样的化学结构进行了研究。红外光谱结果见图11。从图11可以看到经微生物菌群作用后的褐煤与原煤的红外光谱图相比各峰吸光度降低,说明煤被微生物消耗,煤中的物质被微生物利用。降解前后的褐煤在红外结构方面无明显差异,只是某些基团相对增加或减少。这与佟威等[27]研究成果相类似。据报道,在3 693 cm-1/3 620 cm-1和1 033 cm-1/1 010 cm-1附近的吸收峰分别来自黏土矿物中的O—H和铝硅酸盐中的Si—O的拉伸振动[28-30],并且上述峰的面积与煤中的矿物含量有明确的关系[31]。如图11所示,随着粒径的减小,上述峰面积(接近3 693 cm-1/3 620 cm-1和1 033 cm-1/1 010 cm-1)呈上升趋势,说明颗粒越大,矿物含量越低。2 921 cm-1,2 850 cm-1和 1 440 cm-1附近的吸收峰分别归因于烷烃中CH2的不对称拉伸振动和CH3的不对称变形振动,并随着粒径的减小而减小[32-33]。这表明较大的颗粒可能含有更多的脂肪族氢。此外,随着粒径的减小,在798 cm-1和750 cm-1附近的吸光度峰增强,这是由于每个环上有3个和4个相邻氢的芳香族结构中的平面外形变振动=C—H所致[34],意味着较大的颗粒在有机物中含有较少的芳香氢。
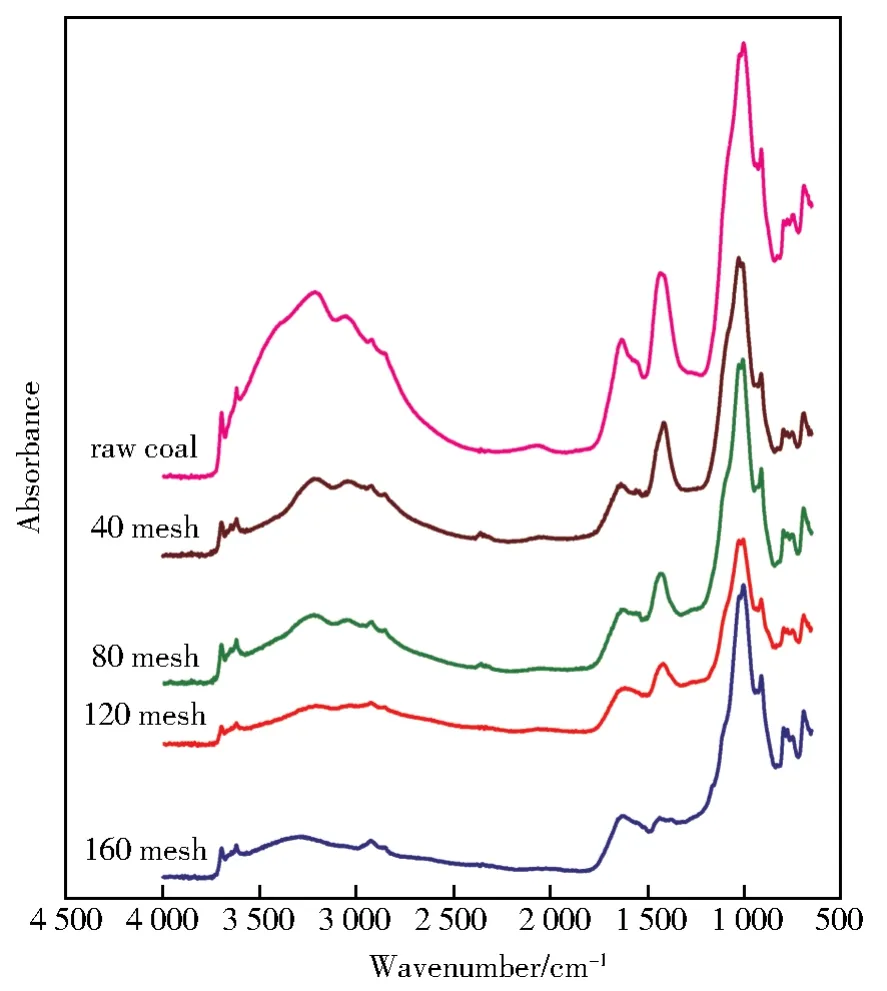
图11 颗粒度组样品红外光谱Fig.11 Infrared spectra of particle size group
综上所述,可知,与对照组原煤煤样相比,经微生物降解作用后的褐煤某些基团发生改变,说明产气过程中微生物影响了煤样的化学结构;同时,某些基团随着影响因素(颗粒度目数)的改变而规律性变化。由于吸收峰重叠,很难从图中获得额外有价值的信息。
2.4.2 褐煤红外光谱分峰拟合
曲线拟合技术用于定量分析红外结构参数。Origin 8.5软件用于分离重叠的吸收峰并计算峰面积。根据已报道的方法[35-37],每个红外光谱分为4个波数带,以颗粒度组160目样品为例展示分段分峰拟合结果(图12),其余目数组处理方法相同。共包括a)羟基吸收带(3 600 cm-1~3 000 cm-1)[38],b)脂肪族吸收带(3 000 cm-1~2 800cm-1)[39],c)含氧官能团吸收带(1 800 cm-1~1 000 cm-1)[40]和d)芳香族吸收带(900 cm-1~700 cm-1)[40]。分峰拟合可以得到各波段内拟合峰的具体位置、半峰全宽、最大高度和峰面积等信息。
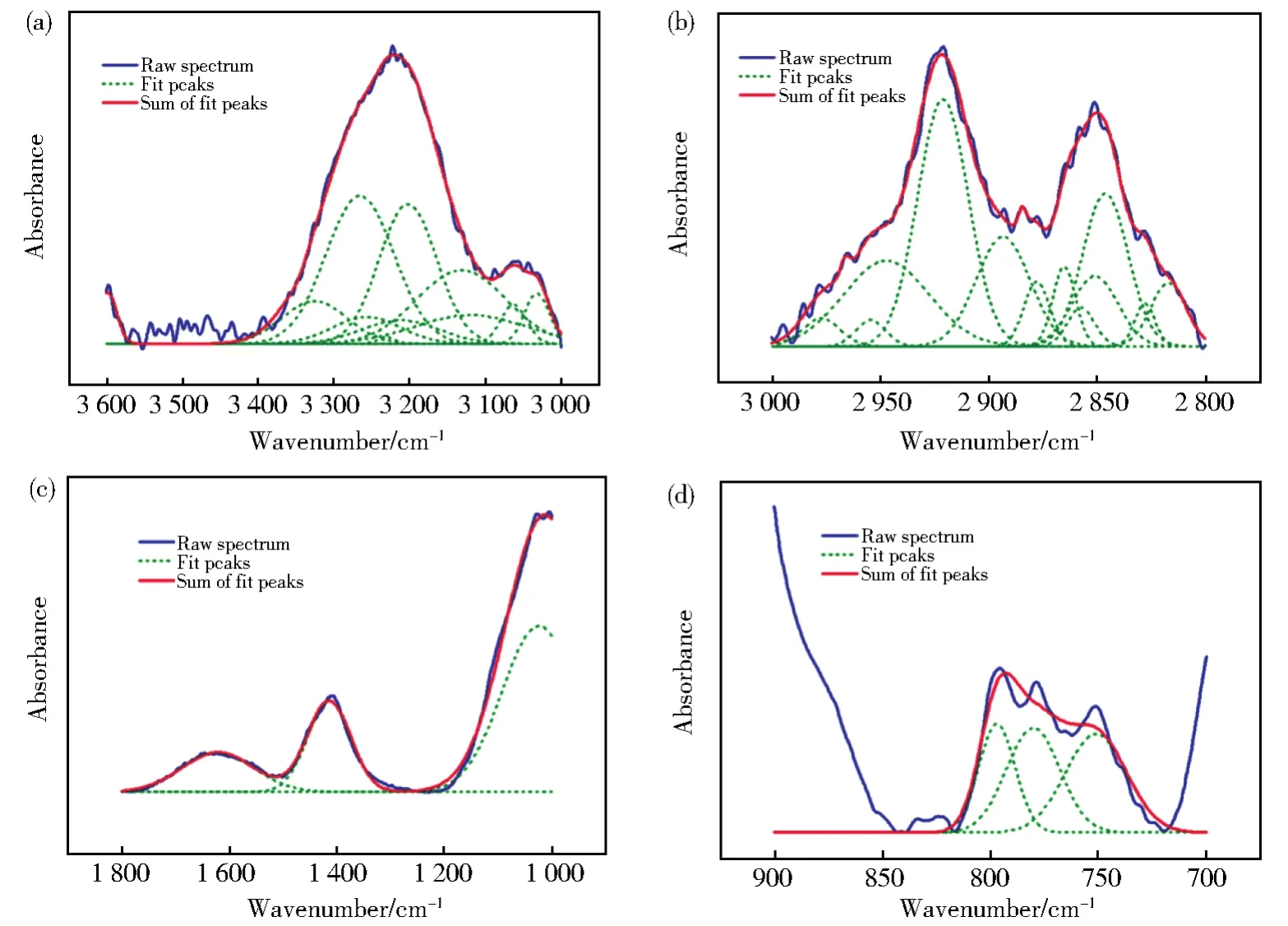
图12 160目样品不同波段的分峰拟合结果Fig.12 Fitting results of different wave bands of 160 mesh samples
2.4.3 褐煤红外结构参数化
为在模拟实验中直接观察微生物引起煤样品的化学和结构变化,引入与红外结构有关的参数:芳香环缩合(I1[35]),脂肪链分支度(I2[41]),脱氧指数(I3[42])和羟基含量(I4[43])。利用参考文献中的方法,计算出不同目数样品所对应的I1—I4值,绘制图13。结合图像可知,I1随粒径的减小而逐渐降低;I2参数越大,表明样品中脂肪链越长。随着微生物对煤的降解,煤中脂肪链发生断裂,形成短链或其他小分子物质,脂肪链支链化程度逐渐降低。粒径的减小加速或有利于微生物对煤的降解;I3指含氧官能团的变化,煤中侧链及多数官能团均在反应中逐步脱落,造成煤中含氧官能团的减少。较小的粒径可能有助于侧链和官能团的脱落;I4随煤粒径的减小而明显减小,进一步证实了羟基是重要的可用于甲烷产生的含氧官能团。结合颗粒度组产气数据分析得到,产气情况最好的高目数组(160目)在褐煤化学结构方面与其他组相比芳香环缩合程度最低,脂肪链分支度最低,羟基等含氧官能团脱落程度最高。
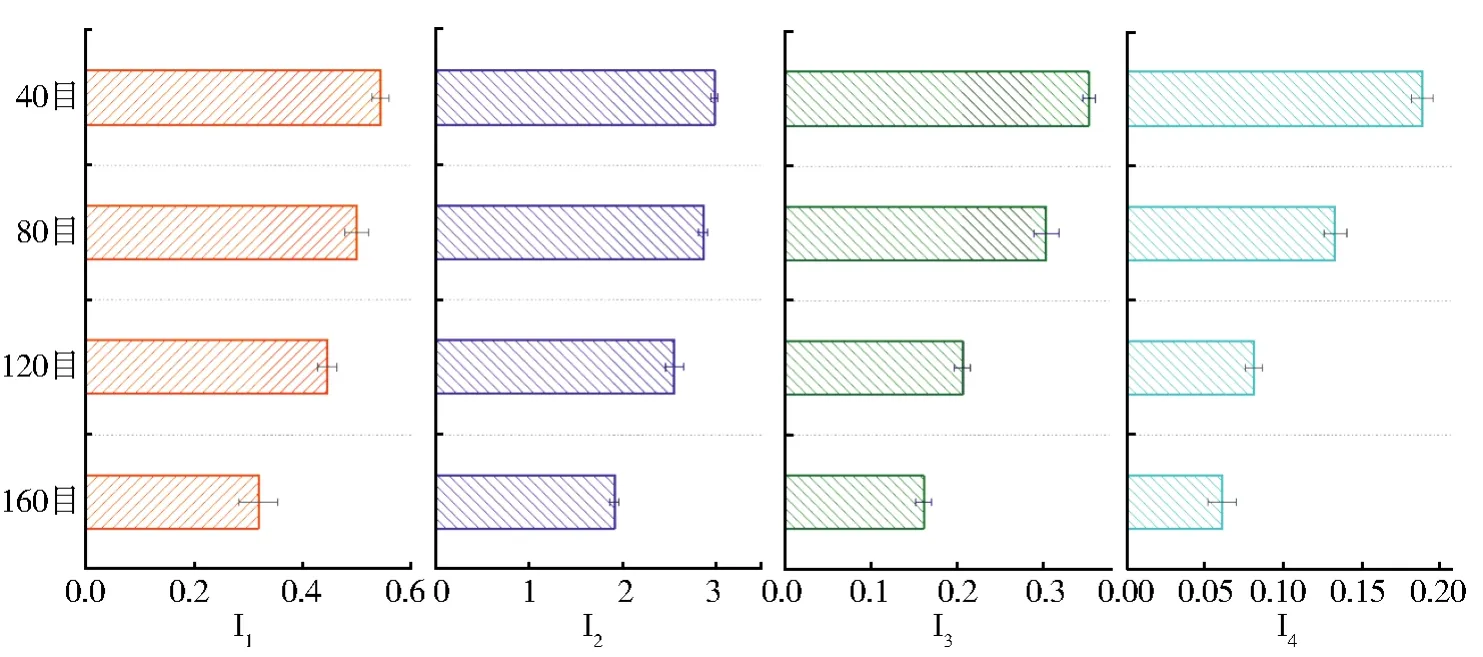
图13 四个样品的I1—I4值Fig.13 I1—I4values of four samples
3 结论
(1)山西寺河矿区的煤层微生物可以利用内蒙古胜利褐煤进行产气,对产气影响最显著的环境因子是颗粒度。
(2)褐煤颗粒度因素是驱动群落变异的主要因子。随煤颗粒目数的增大,产甲烷菌属Methanosarcina与Methanobacterium的含量增多,产气量显著提高。
(3)生物成气过程中微生物影响了煤样的化学结构。随煤颗粒目数的增大,红外结构中芳香环缩合程度降低,脂肪链支链化程度降低,含氧官能团减少。

