铌酸盐改性钛酸纳米片对水中Pb(II)的去除研究
丁庆伟,隋睿,刘晓娜,钱天伟
(1.太原科技大学 环境与安全学院,太原 030024;2.太原理工大学 环境科学与工程学院,晋中 030600)
0 引言
随着现代工业社会的快速发展,水体重金属污染问题已成为一项日益严峻的环境挑战。由于重金属污染的持久性,难于的生物降解以及通过食物链在活组织中的加速作用,即使重金属含量较低,也可能具有剧毒和致癌性[1-3]。铅(Pb)是一种众所周知的有毒重金属,广泛存在于饮用水和环境系统中[4-5]。
从水溶液中去除重金属的常用方法包括化学沉淀法[6],膜过滤法[7],电子技术[8]和吸附法[9]。其中,吸附法由于其简单,灵活和在工业应用中的高效率而成为最具成本效益和最有前途的方法[10-11]。吸附过程的关键是寻找一种低成本,有效的吸附剂。传统上,许多天然材料和副产品已用于去除水中的重金属,例如沸石[12],膨润土[13],钙铁矿[14],生物质[15],贝壳[16]和锯末[17]。然而,由于它们的吸附容量低,平衡时间长和再生过程复杂,仍然迫切需要寻找具有较高吸附容量的再生吸附剂。近年来,钛酸盐纳米材料由于其特殊的理化性质而引起了环境修复领域的极大兴趣,如表面积大,离子交换性能好,纳米级结构细小均匀,光照下量子效应好等。此外,钛酸盐纳米材料可以很容易地通过对商业TiO2的碱性水热处理来合成,并且可以通过调节水热条件来操纵它们的形态,因此被广泛应用于重金属的吸附去除领域[18-21]。铌酸盐具有与钛酸盐相似的离子交换性能,已被证明是放射性核素的有效吸附剂[22]。本研究将铌酸盐负载钛酸盐,利用一步水热法合成铌酸盐/钛酸盐纳米薄片(Nb/TiNFs),并用于对水体中Pb(II)的吸附去除。通过批实验评估Nb/TiNFs对水体中Pb(II)的去除性能,测试各种水化学条件下Nb/TiNFs对Pb(II)的有效性,并进一步研究Pb(II)在Nb/TiNFs上的吸附行为和机制。
1 材料与方法
1.1 实验材料
二氧化钛(TiO2,80%锐钛矿和20%金红石,平均粒径21 nm,Sigma-Aldrich);五氧化二铌(Nb2O5,国药集团,分析纯);硝酸铅(Pb(NO3)2,天津津北公司,分析纯);氢氧化钠(NaOH,天津大茂,优级纯);盐酸(HCl,北京化工,分析纯);腐殖酸(HA(C6H10O5)n,天津科密欧);氯化钙(CaCl2,天津恒兴,分析纯)。用去离子水(DI)制备所有溶液,并配制Pb(II)储备液(1 000 mg·L-1)以备用。
1.2 实验仪器
电感耦合等离子体发射光谱仪(ICP-OES,Perkin Elmer Optima 7300,美国)、离心机(CF 16RXI I,日本)、电子分析天平(CP A225D 型,感量为 10-6g,德国)、扫描电镜(SEM,JSM-7001F,日本)、透射电镜(TEM,JEM-2020,日本)、X 射线衍射仪(XRD,D8 ADVANCE,德国)、pH 计(梅特勒S220,上海)、Zetasizer(Nano-ZS90,美国)。
1.3 Nb/TiNFs的合成
Nb/TiNFs采用一步温和水热法合成[23]。具体步骤为:取1.2 g TiO2和0.1 g Nb2O5置于烧杯中,混合后加入80 mL浓度为10.0 mol·L-1的NaOH,磁力搅拌器搅拌12 h后转移到聚四氟乙烯内衬的不锈钢反应釜中,130°C条件下水热反应72 h。然后,反应釜自然冷却,用去离子水反复洗涤生成的白色沉淀物至近中性,用无水乙醇分散于培养皿中,在105°C下烘箱干燥4 h,研磨后即得到Nb/TiNFs粉末。
1.4 Nb/TiNFs的表征
用美国Bruker(D8 advance)X射线衍射光谱仪(XRD)分析合成的Nb/TiNFs样品的物相组成、矿物晶体结构及矿物种类等。XRD测定条件为:Cu靶,Ka辐射(40 kV,40 mA),停留时间0.01,步长0.01,扫描范围5o< 2θ<70o。
用SEM和TEM表征Nb/TiNFs的形貌和结构。用Zetasizer测量各种pH值下的Zeta电位以获得零点电荷的pH。
1.5 吸附动力学测定
在锥形瓶中配制初始浓度为50 mg·L-1和100 mg·L-1的Pb(II)溶液(100 mL),0 min时刻取初始样,将20.0 mg的Nb/TiNFs加入溶液中混合均匀,用稀NaOH或稀HCl调节溶液pH=5,放置转速为150 r·min-1摇床振荡(25 °C),在预设的时间点取样(0~240 min),用 0.22 μm 膜过滤,最后用电ICP-OES 测定样品溶液中 Pb(II)的浓度。Pb(II)的吸附量计算公式为:
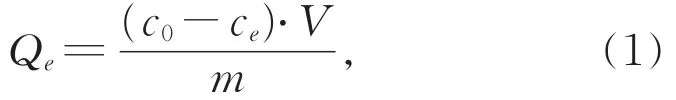
其中,Qe(mg·g-1)为反应到达平衡时的吸附量,c0和ce(mg·L-1)分别为溶液中初始Pb(II)浓度和反应到达平衡时溶液中Pb(II)浓度(mg·L-1),V(L)为反应溶液液的体积,m(g)为Nb/TiNFs的质量。
实验动力学数据利用准一级和准二级动动力学模型[式(2)和式(3)]进行模拟,用于解释吸附动力学行为[24]:
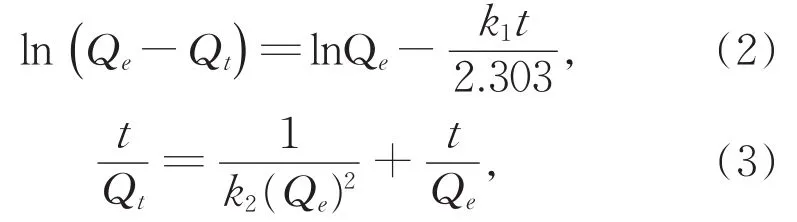
式中,Qt和Qe(mg·g-1)分别是反应时间为t(min)和反应到达平衡时 Nb/TiNFs的吸附容量,k1(min-1)和k2[g·(mg·min)-1]分别为准一级和准二级动力学常数。
1.6 吸附等温线测定
分别配制 Pb(II)离子浓度为 10 mg·L-1~200 mg·L-1的溶液(40 mL),投加 0.2 g·L-1的 Nb/TiNFs,用 HCl/NaOH(0.1 mol·L-1)调节反应溶液 pH = 5,置于摇床上(25 °C,150 r·min-1)振荡240 min后,取样,过0.22 μm膜测定。
分别利用经典的Langmuir方程和Freundlich方程[式(4)和式(5)]解释吸附等温线数据,具体公式如下[25-26]:
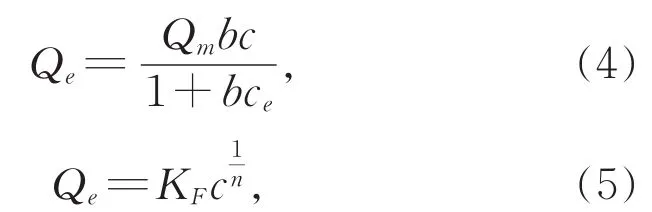
式中,Qe为平衡吸附量(mmol·g-1),Qm代表理论最大单层吸附容量(mmol·g-1),ce为金属离子的平衡浓度,b是代表吸附位点结合能相关的Langmuir常数(L·mmol-1)。KF是与吸附量有关的Freundlich常数(L·mmol-1),n是表示吸附剂的吸附强度的异质性因子。
基于Langmuir模型,引入无量纲常数来评估吸附强度,其定义为分离因子(RL)[26]:

其中c0(mg·L-1)是Pb(II)的初始浓度。因此,可将吸附分为不可逆(RL=0),良好(0<RL<1),线性(RL=1)和不利(RL>1)。
1.7 溶液pH的影响
利用储备液配置40 mL重金属离子使用液(50 mg·L-1),0 min时刻取初始样,然后,在溶液中加入0.2 g·L-1的 Nb/TiNFs(8.0 mg),用 HCl/NaOH(0.1 mol·L-1)调节溶液 pH 至 2~10,将溶液置于150 r·min-1的摇床上振荡240 min后,取样过0.22 μm膜后进行ICP测定。
1.8 常规无机离子和腐殖酸(HA)的影响
配制 Pb(II)(初始浓度 50 mg·L-1)与水中常见无机离子 Na+、Ca2+(浓度设定为 1 mmol·L-1~10 mmol·L-1)的混合溶液40 mL,混合溶液中投加 8.0 mg 的Nb/TiNFs,调节溶液 pH 为 5,于 150 r·min-1摇床上(25°C)振荡240 min后,取样过膜待测。
将0.1 g的HA(C元素的质量分数为56.95%)溶于0.1 mol·L-1的 NaOH 溶液(20 mL)中,用蒸馏水将溶液定容至100 mL,即得到浓度为1 mg·L-1的HA溶液,置于冰箱中备用。配制Pb(II)(50 mg·L-1)与 HA(1 mg·L-1~50 mg·L-1)的 混合溶液,向其中加入Nb/TiNFs(8.0 mg),调节体系 pH=5后,将溶液放置于摇床上(25°C,150 r·min-1)振荡240 min,取样过膜并测定。
2 结果与讨论
2.1 表征分析
图1为Nb/TiNFs的TEM,HRTEM和SEM表征图,与在相同条件下合成但不添加Nb的TNTs 的管状结构[27]不同,Nb/TiNFs表现为纳米薄片,且层状结构可见,结晶层间距离为0.81 nm(图1 b)。这些弯曲的钛酸盐纳米片可以设想为是TNTs合成过程中从纳米片到纳米管的过渡态。显然,在水热处理过程中,加入一小部分Nb(Nb2O5形式)作为共同前驱体影响了所得复合材料的形态和结构。

图1 Nb/TiNF的TEM(a),HRTEM(b)和SEM图(c)Fig.1 TEM,high resolution TEM(HRTEM),and SEM images of Nb/TiNFs
图2显示了吸附前后的Nb/TiNFs的XRD图案。由图2可看出,对于Nb/TiNF材料,在大约2θ为10°时出现的衍射峰代表材料的层间距离[20]。2θ≈24.5°,28.5°,48.1°和 62.0°时的初级衍射峰对应钛酸钠晶体,其可以用化学式NaxH2-xTi3O7·nH2O表示(x取决于钠含量)[20,28]。因此,钛酸盐纳米薄片由三钛酸盐组成,层状波纹带由三重的[TiO6]八面体(骨架)和夹层中可交换的H+/Na+组成[20,29-30]。而大约2θ为22.8°和32.5°处的弱峰分别与铌酸钠的(110)和(510)的晶面一致[22]。铌酸钠符合化学式Na2Nb2O6·H2O,其结构框架由[NbO6]和[NaO6]八面体以及通道中可交换的Na+离子组成[31]。因此,Nb/TiNFs是钛酸盐和铌酸盐的复合材料,以三钛酸盐为主要晶相。
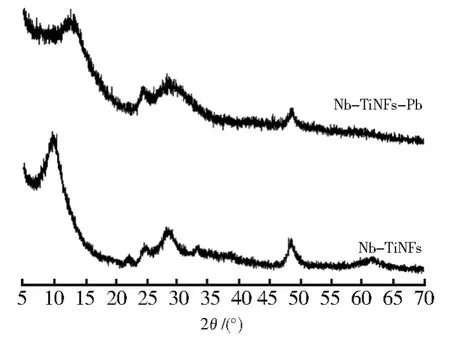
图2 Nb/TiNFs的XRD图Fig.2 XRD patterns of Nb/TiNFs
2.2 吸附动力学
Nb/TiNFs对初始浓度c0为50 mg·L-1和 100 mg·L-1的 Pb(II)的吸附动力学如图 3 所示。很明显,Nb/TiNFs能够从溶液中快速吸附Pb(II)。反应主要发生在刚开始的10 min,且在20 min(c0=50 mg·L-1)和60 min(c0= 100 mg·L-1)时达到吸附平衡。对于c0= 50 mg·L-1的情况,平衡时 Pb(II)的去除率达到99.8%,平衡吸附量(qe)为232.6 mg·g-1;对于c0= 100 mg·L-1,平衡时 Pb(II)的去除率达到92.5%(qe=467.2 mg·g-1)。Nb/TiNFs对Pb(II)的快速吸附可归因于材料的薄片状结构(利于快速传质并易于进入离子交换位点)和大比表面积(146.6 m2·g-1)[32]。
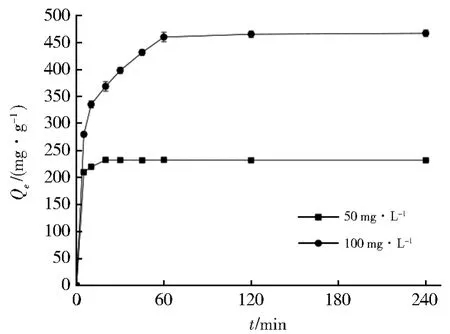
图3 Nb/TiNFs对水中Pb(II)的吸附动力学Fig.3 Adsorption kinetics of Pb(II)onto Nb/TiNFs
利用准一级动力学与准二级动力学模型拟合的参数见表1,可以看出准二级动力学模型更好地描述了动力学数据(R2>0.99)。且表中准二级动力学拟合得出的平衡吸附量与实际测得的数据基本一致(偏差<2%),这表明了Nb/TiNFs对Pb(II)离子的吸附属于化学吸附过程,Pb(II)在Nb/TiNFs上的吸附可能是Nb/TiNFs中—ONa基团和Pb(II)之间的表面相互作用的结果,例如层间Na+与Pb(II)的离子交换和表面络合[32-34]。
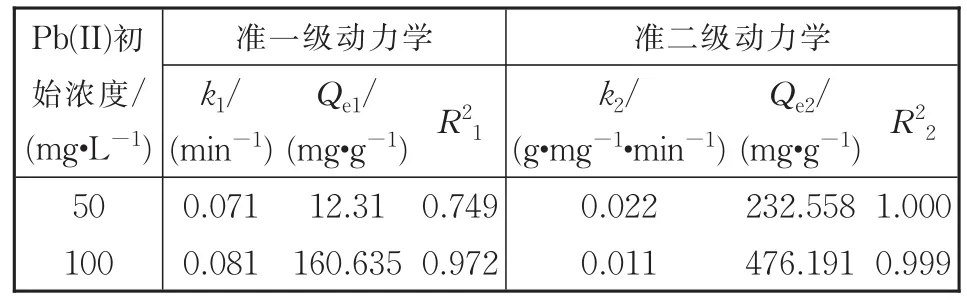
表 1 Nb/TiNFs吸附水中Pb(II)的动力学参数Table 1 Kinetics parameters of adsorption of Pb(II)on Nb/TiNFs
2.3 吸附等温线
Nb/TiNFs对 Pb(II)的吸附等温线见图4。从Langmuir和Freundlich模型拟合后的吸附等温线参数(表2)可以看出,Langmuir模型提供了比Freundlich模型更好的拟合结果(R2=0.994),这与均匀的单层离子交换和表面络合机制一致,并表明吸附的Pb2+离子之间没有相互作用。理论最大吸附量Qmax为 488.323 mg·g-1,比传统吸附剂高得多,如改性二氧化硅(38 mg·g-1)[35],膨润土(53 mg·g-1)[14],活性氧化铝(83 mg·g-1)[36],合成离子交换树脂(84 mg·g-1)[37]和 沸石负 载的零价铁纳米粒 子(105.5 mg·g-1)[38]。考虑到这种基于离子交换的吸附的单层吸附性质,Nb/TiNFs的高吸附容量可归因于高比表面积和丰富的官能团(—ONa和—OH)[20]。
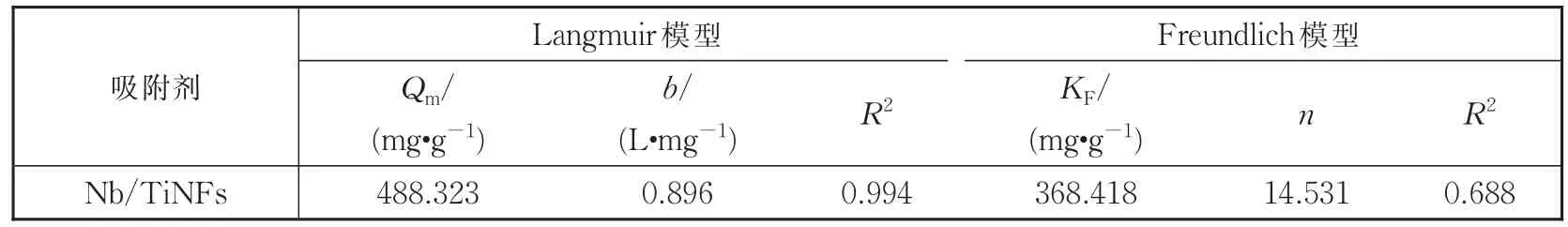
表2 吸附等温拟合参数Table 2 Parameters of isotherms for adsorption
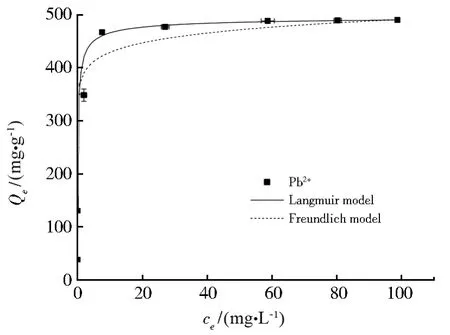
图4 Nb/TiNFs对水中Pb(II)的吸附等温线Fig.4 Adsorption isotherms of Pb(II)by Nb/TiNFs
基于Langmuir模型,进一步计算得出分离因子RL,当Pb(II)的初始浓度c0=50 mg·L-1和100 mg·L-1时,RL分别为0.022和0.011,表明Nb/TiNFs对Pb(II)的吸附是非常有利的。
2.4 溶液pH值对Nb/TiNFs吸附Pb(II)的影响
溶液 pH 对重金属Pb(II)离子在Nb/TiNFs上的吸附影响如图5所示。由于TNTs的等电点为2.56(图6),因此当pH 较低时(pH=2),Nb/TiNFs的表面带正电,与Pb2+正电荷表面的静电斥力作用会阻碍Pb(II)离子的吸附。此外,在强酸性条件下,溶液中大量存在的H+会与Pb(II)产生竞争吸附,竞争Nb/TiNFs的吸附位点[39],因此pH=2下Pb(II)的吸附量较低(qe为166.88 mg·g-1)。随着pH 的升高(3~5),Nb/TiNFs的表面转而带负电,且暴露的带负电的活性位点随着pH的升高而增加,这会增强Nb/TiNFs与Pb2+的吸引。另一方面,由于水中OH-浓度的增大,H+的竞争作用也随之减少,从而导致Pb(II)离子吸附量的显著增加,在pH=5时达到最高值。溶液pH值继续升高(5~6),虽然Nb/TiNFs暴露了跟多的活性位点,但同时吸附在Nb/TiNFs上的带正电的金属与自由金属离子的静电排斥作用会抑制金属离子的持续吸附[39],因此,吸附量在pH=6时略有下降,吸附率由pH 5时的99.8%降到了99.5%。pH值继续升高,Nb/TiNFs几乎能完全去除溶液中所有的Pb(II)(去除率>99%)。值得注意的是,当pH>8时,溶液中开始出现Pb(OH)2沉淀[38]。所以,在碱性条件下,Pb(II)的去除是由于沉淀和吸附的共同作用。因此,为了保证重金属离子的去除主要由吸附所导致而非沉淀,金属阳离子的吸附实验选择溶液pH为5。
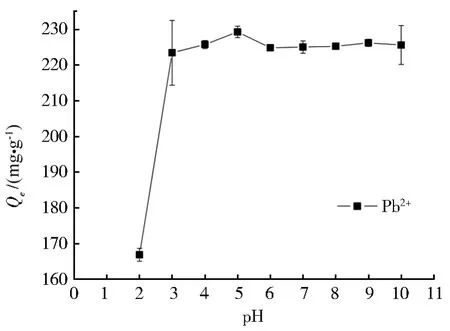
图5 pH对Nb/TiNFs吸附Pb(II)的影响Fig.5 Effect of pH on adsorption of Pb(II)by Nb/TiNFs
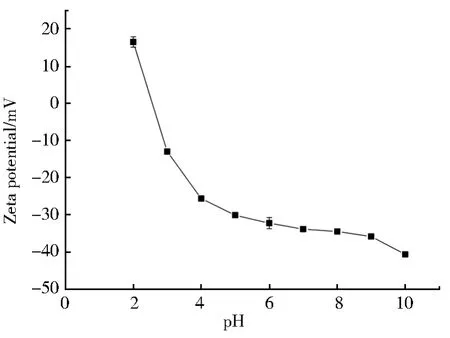
图6 Nb/TiNFs在不同pH下的Zeta电势Fig.6 Zeta potentials of Nb/TiNFs at various pH levels
2.5 无机金属阳离子对Nb/TiNFs吸附重金属的影响
图7显示了离子强度和共同离子Na+和Ca2+对Pb(II)吸附的影响。由图7可以看出,不同强度单价Na+对Pb(II)吸附几乎没有影响,从0增加至10 mmol·L-1时,Pb(II)的去除率从99.97%降为99.93%,抑制作用不明显;10 mmol·L-1二价Ca2+离子的存在使Pb(II)的吸附去除率由99.93%降至99.11%,有轻微的抑制作用。因此,Nb/TiNFs可用于淡盐水的处理,并且在高浓度的Na+和Ca2+阳离子存在下可以很好地发挥作用。
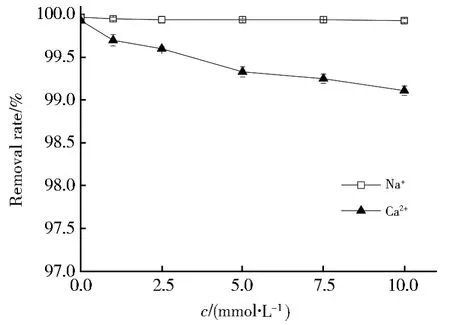
图7 无机离子(Na+和Ca2+)对Pb(II)的吸附的影响Fig.7 Effect of inorganic ions(Na+and Ca2+)on adsorption of Pb(II)
共存无机离子(Na+,和Ca2+)的影响机制主要表现为:(1)与 Pb(II)离子竞争活性吸附位点;(2)降低Pb(II)离子的活性,从而使其向Nb/TiNFs表面的迁移受阻[40];(3)改变Nb/TiNFs的双电极层结构即造成的双电层压缩,从而导致Nb/TiNFs的团聚而不利于吸附[41]。因此无机离子的存在会抑制金属阳离子在Nb/TiNFs上的吸附,且这种抑制作用会随着无机离子浓度的增加而加强。Ca2+的作用比Na+更明显是因为二价离子更易与吸附位点相结合,同时导致双电层压缩作用更为显著[42]。本研究Na+和Ca2+的抑制作用对于Pb(II)比较弱的原因是由于Nb/TiNFs 对Pb(II)具有强亲和力[27]。
2.6 腐殖酸(HA)的影响
腐殖酸(HA)是土壤中广泛存在的一种天然有机物,易溶于碱性溶液。图8是不同浓度的腐殖酸对Nb/TiNFs吸附Pb(II)的影响,从图8可以看出,随着HA的加入,Pb(II)的吸附受到一定程度的抑制;当HA的浓度达到50 mg·L-1时,Nb/TiNFs对Pb(II)的去除率由不添加HA时的99.97%降至93.52%。一般来说,HA或DOM可通过多种竞争方式影响金属的吸附。HA或DOM携带各种强配体基团(供体原子如N,O,S,P和其他官能团,如酚类和羧酸基团,可通过路易斯酸碱相互作用与重金属强烈络合[38]。因此,溶液相HA或DOM将与Nb/TiNFs目标金属发生吸附竞争,抑制了Pb(II)的吸附。
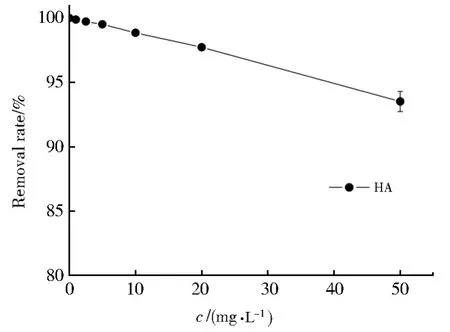
图8 HA对Nb/TiNFs吸附Pb(II)的影响Fig.8 Effect of HA on adsorption of Pb(II)by Nb/TiNFs
2.7 吸附机制及影响因素分析
在实验 pH=5.0,Pb(II)的主要存在形式为Pb2+,Nb/TiNFs对 Pb(II)的吸附主要归因于 Pb2+与钛酸钠和铌酸盐复合材料中间层中可交换Na+离子间的离子交换,离子交换过程可描述如下:
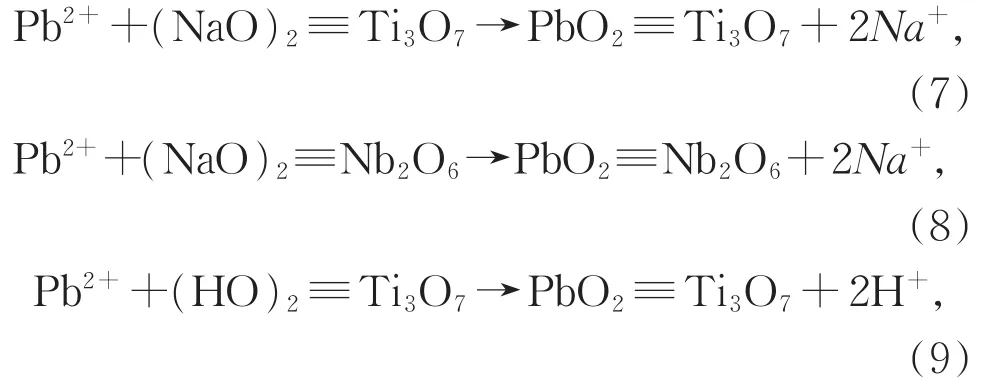
其中“(NaO)2≡Ti3O7”或“(HO)2≡Ti3O7”代表钛酸盐的功能基团,“(NaO)2≡Nb2O6”表示铌酸盐的功能基团。
在实验条件下,Nb/TiNFs对金属阳离子的吸附是通过以下三个步骤来完成:(1)水合金属离子解离为裸露离子;(2)游离金属离子迁移到带负电的Nb/TiNFs表面;(3)裸露金属离子与层间H+/Na+进行离子交换[33]。金属离子的水合能越小,越容易解离为自由离子与Nb/TiNFs的相应位点发生离子交换[43],而Pb(II)的水合能(1 481 kJ·mol-1)[27]很低,Nb/TiNFs对Pb(II)具有高亲和力,即Pb(II)极容易被Nb/TiNFs吸附,这也是共存Na+和Ca2+对Pb(II)的吸附的抑制作用较弱的原因。
根据前人的研究,当满足以下两个条件时:1)目标金属阳离子应具有较大的离子半径,可与[TiO6]单元中的末端氧原子作用;2)钛酸盐纳米材料具有“亚稳”结构,如钛酸盐纳米纤维和钛酸盐纳米片。钛酸盐基材料在中吸附过程中可能会形成钛酸盐晶格隧道结构[33-44]。本研究合成的钛酸盐纳米薄片是钛酸盐的亚稳相,并且Pb(II)具有较大的离子半径[27]。因此,在吸附过程中Pb(II)物质容易被捕获在晶格隧道中。类似的,据报道,铌酸钠也会发生相变,导致吸附阳离子的隧道结构[22]。
图2中吸附后的Nb/TiNFs的XRD图谱中,2θ≈10°处的层间峰的位移,钛酸盐峰(2θ≈24.5°,28.5°,48.1°和 62.0°)的减弱,以及铌酸盐峰(2θ为22.8°和32.5°)的消失,也证明了隧道结构的形成。在反应过程中Pb(II)在钛酸盐和铌酸盐晶格隧道结构中的捕获,可能将有利于防止Pb(II)被解吸。
3 结论
(1)Nb/TiNFs是钛酸盐和铌酸盐的复合材料,以三钛酸盐为主要晶相。
(2)Nb/TiNFs能快速吸附水中Pb(II),去除率高达 99.8%(初始 Pb(II)50 mg·L-1,材料用量 0.2 g·L-1)。准二级动力学模型可以更好地解释吸附动力学(R2>0.999)。Pb吸附由表面反应控制,而不是扩散控制。
(3)Nb/TiNFs对 Pb(II)的吸附等温线符合Langmuir模型,Langmuir最大吸附容量为488.323 mg·g-1,远高于常规吸附剂。
(4)Nb/TiNFs对重金属 Pb(II)在广泛的 pH范围下都具有较好的吸附效果,强酸性环境(pH=2)中吸附受到抑制,吸附量随pH值升高而增加,pH=5时达到最高值。碱性条件下,由于吸附和沉淀作用,溶液中Pb(II)的去除率仍>99%。
(5)无机离子Na+对Pb(II)吸附几乎没有影响,Ca2+离子的存在对Pb(II)的吸附有轻微的抑制作用;可溶性腐殖酸(HA)对Pb(II)在Nb/TiNFs上的吸附产生了一定的抑制。

