绿球藻多糖的抑菌活性及成分分析
李旭东,冯佳,吕俊平,刘琪,南芳茹,刘旭东,谢树莲
(山西大学 生命科学学院,山西 太原 030006)
0 引言
多糖是生物体内重要的生物大分子。研究表明,多糖有特殊的生物活性,能提高机体的免疫功能,在预防医学、临床医学、保健食品等方面发挥有作用。过去对多糖的研究多集中于高等植物或海洋大型藻类,而对微藻多糖活性的研究很少[1-2]。
在各类疾病发生率中,食源性疾病高居第二位[3]。在250多种食源性疾病中,食品致病菌引起的食物中毒事件约占2/3[4]。2007—2013年我国就有3 900多起食源性疾病事件发生[5],食品致病菌已成为食品污染的重大源头。随着生活水平的日益提高,人们对食品的安全性关注度越来越高,特别是食品添加剂成了焦点,各种合成防腐剂使用易引起致癌、致畸及食物中毒的问题[6-7]。
一些生物富含杀菌、抑菌活性物质受到关注,成为食品工业研究的热点。报道较多的是植物类,特别是香辛料和一些中草药植物类,也有少量动物和微生物[8]。近年来人们逐步认识到微藻是一类具有抑菌潜力的宝贵天然生物资源,在医药、化妆、洗浴用品及食品防腐保鲜等领域具有广阔的应用前景,如小球藻多糖和紫球藻多糖对细菌与真菌都显示了不同程度的抑制作用,抗菌谱极广,海带多糖对氧自由基吸收能力、ABTS+自由基清除能力和还原力等均有较显著的抗氧化能力,杜氏盐藻、集胞6803、三角褐指藻、发状念珠藻、螺旋藻、鱼腥藻7120、栅藻等的粗多糖均具有抑菌活性,而且螺旋藻多糖和小球藻多糖以不同质量比例制得的复合多糖,其抑制效果和抗氧化活性优于单一多糖[9]。本文研究了绿球藻多糖对常见致病菌的抑菌活性,并对其单糖组成进行了分析,以期为天然食品抑菌剂新资源开发提供基础资料。
1 材料与方法
1.1 实验材料、试剂与仪器
绿球藻(Chlorococcumsp.GD),采自山西省关帝山(37°49′N,111°27′E,海拔1 861 m)。藻种由山西大学藻类学实验室分离、保藏并培养。
供试细菌5种,金黄色葡萄球菌(Staphylococcusaureus)、大肠杆菌(Escherichiacoli)、枯草芽孢杆菌(Bacillussubtilis)、变形杆菌(Proteusspecies)和产气杆菌(Acrobacteraerogenes)。菌种由山西大学生命科学学院微生物实验室提供,以牛肉膏蛋白胨培养基培养。
甘露糖、鼠李糖、半乳糖醛酸、葡萄糖、半乳糖、木糖、阿拉伯糖和岩藻糖(质量分数>99%,上海生工生物工程有限公司);三氟乙酸(质量分数>99%,天津致远化学试剂有限公司);右旋糖酐(D1、D2、D3、D4、D5、D6、D7、D8、D9、D10,标准分子量分别为 180、2 500、4 600、7 100、10 000、21 400、41 100、84 400、133 800、2 000 000 Da,中国药品生物制品检定所);1-苯基-3-甲基-5-吡唑啉酮(质量分数>99%,国药集团化学试剂有限公司);甲醇和乙腈(色谱纯,美国Tedia公司);氯化钠、盐酸、氯仿、NaOH和无水乙醇(分析纯,国药集团化学试剂有限公司);牛肉膏、蛋白胨和琼脂(生化纯,北京奥博星生物技术有限责任公司)。
电热鼓风干燥箱(DHG-9070A,上海一恒科学仪器有限公司),电热恒温水浴锅(HH-2,常州国华电器有限公司);电热恒温培养箱(DH4000Ⅱ,天津市泰斯特仪器有限公司),旋转蒸发仪(RF-02,上海普渡生化科技有限公司),高效凝胶渗透色谱(P230II型,广州艾欣科学仪器有限公司),高效液相色谱仪(Waters e2695,费尔伯恩精密仪器(上海)有限公司),色谱柱温箱(HT-330,上海吉理科学仪器有限公司),色谱柱(TSK-gel G-4000 PWXL,北京金欧亚科技发展有限公司),示差折光检测器检测仪(Shodex RI-201,天津琛航科苑科技发展有限公司),液相色谱柱(Agela Venusil XBP-C18,杭州纽蓝科技有限公司),电子天平(TB-214,北京赛多利斯仪器系统有限公司),便携式多参数分析仪(雷磁DZB-718,上海仪电科学仪器股份有限公司),微孔滤膜(0.22 μm,岛津遐迩(上海)商贸有限公司)。
1.2 实验方法
1.2.1 绿球藻多糖及菌悬液的制备
依照有关文献的方法制备绿球藻干粉[10]。称取绿球藻粗多糖(CCP)0.2 g,用最少量的蒸馏水溶解。上层析柱(50 cm×2.6 cm),用蒸馏水洗至无糖检出,依次用 0、0.1、0.3、0.5 mol/L NaCl洗脱,洗脱速度为1 mL/min,分管收集,每管5 mL,洗脱时间为4 h。收集各洗脱峰部分,浓缩、透析、冷冻干燥。
取上述洗脱峰部分最多的多糖2 mg,溶于1 mL蒸馏水,上层析柱(100 cm×1.5 cm),用蒸馏水以0.2 mL/min速度洗脱,按每管5 mL接洗脱液。绿球藻粗多糖经除蛋白、柱纯化,得到绿球藻纯多糖(CPP)。称取一定量的绿球藻多糖,用灭菌蒸馏水准确配制成浓度为30 mg/mL的抑菌液,在4℃保存备用。
将菌种接入到已经备好的斜面试管中(15 mm×150 mm)活化,细菌37℃培养24 h,真菌28℃培养48 h。在无菌条件下,勾一环单菌落于50 mL新配制的相应培养基中进行培养,制成菌悬原液。采用10倍稀释法将菌悬原液稀释至10-1~10-8倍的菌悬液,选取合适浓度菌悬液涂平板,通过平板菌落计数法确定菌悬液浓度,并配制浓度1×106CFU/mL的菌悬液备用。
1.2.2 抑菌活性的测定
采用琼脂孔注入法测定抑菌活性。取20 mL灭菌的培养基倒入培养皿制成平板,冷却10 min,吸取100 μL菌悬液均匀涂布于平皿表面,静置10 min,用直径6 mm打孔器在平板表面打孔,每板3个孔(1个为无菌水对照,1个为3 mg/mL绿球藻粗多糖液,1个为3 mg/mL绿球藻纯多糖液)。将平皿置于恒温培养箱培养,细菌37℃培养24 h。采用十字交叉法测定抑菌圈直径[11],每组重复3次,取平均值。
最低抑菌浓度(MIC)的测定参照罗爱国的方法[12],略做修改。将绿球藻纯多糖溶液稀释成浓度为20、10、5、2.5、1.25、0.625、0.313、0.156、0.078、0.039 mg/mL浓度梯度,每个浓度取1 mL,菌悬液取0.1 mL,加入60℃左右的固体培养基,充分混匀,待冷却凝固后,置于恒温培养箱中培养,观察并记录菌落生长情况,以不长菌的最低绿球藻多糖溶液浓度为最低抑菌浓度。
细菌生长曲线的测定,以金黄色葡萄球菌为代表。取菌悬液按体积分数1%接种于含30 mg/mL绿球藻纯多糖的液体培养基中,37℃培养。分别于0 h、3 h、6 h、9 h、12 h、15 h、18 h、21 h、24 h取样,在波长600 nm处测定菌悬液吸光度,绘制生长曲线[13-14]。以无菌蒸馏水代替多糖作为对照。
细胞膜通透性的测定是将培养至对数生长期的金黄色葡萄球菌于5 000 r/min离心10 min,收集菌体。用灭菌生理盐水洗涤3次后重新悬浮,使悬液 OD630nm=0.6[15],即为金黄色葡萄球菌悬液。向其中加入绿球藻纯多糖,使其浓度达到1/2 MIC、MIC、2 MIC及4 MIC,以未加绿球藻多糖的菌悬液为对照。37 ℃培养,分别于2、4、6、8、10和12 h时取样,离心10 min(4 000 r/min),取上清液,测定不同培养时间的OD260nm。实验重复3次,取平均值。
溶解氧的测定是向处于对数生长期的金黄色葡萄球菌的菌悬液分别加入绿球藻纯多糖,使其浓度达到MIC、2 MIC和4 MIC,以未加入绿球藻纯多糖的菌悬液为对照,37°C振荡培养24 h,每隔2 h记录溶氧[16]。
1.2.3 绿球藻多糖分子量测定和单糖组成分析
将不同分子量的系列葡聚糖标准品和待测绿球藻纯多糖样品配置成5 mg/mL溶液,采用高效凝胶渗透色谱法测定多糖分子量[17]。流动相:超纯水;柱温:(35±0.5)℃;进样量:20 μL;运行时间:30 min;流速:1.0 mL/min;手动进样。精密称取右旋糖酐分子量分别为180、2 500、4 600、7 100、10 000、21 400、41 100、84 400、133 800和2 000 000 Da的10种标品,配成质量浓度为5 mg/mL的标准溶液,经0.22 μm的微孔滤膜过滤,进样。记录保留时间,代入回归方程求分子量。
绿球藻纯多糖中单糖组成采用1-苯基-3-甲基-5-吡唑啉酮柱前衍生高效液相色谱法进行分析[18-20]。液相色谱柱:Agela Venusil XBP-C18(250 mm×4.6 mm,5 μm),流动相:A相为磷酸二氢钾缓冲液83%(pH=6.7),B相为乙腈17%,流速1.0 mL/min,进样量 20 μL,柱温 35 ℃,检测波长250 nm。称取5 mg绿球藻纯多糖置于水解管中,加入2 mol/L三氟乙酸3 mL,溶解,密封,置于120℃烘箱,加热水解2 h。取出放置至室温,转移至25 mL圆底烧瓶。45℃减压,反复加入少量甲醇,取出残余的三氟乙酸。准确称取甘露糖、半乳糖醛酸、葡萄糖、半乳糖、木糖、阿拉伯糖、岩藻糖、鼠李糖对照品 0.09 g、0.097 g、0.09 g、0.09 g、0.075 g、0.075 g、0.082 g、0.091 g,放入同一个 10 mL离心管中,加5 mL超纯水,溶解并混匀,终浓度100 mmol/L,得混合标准品母液。取1 mL浓度为100 mmol/L的混合标准品,加入9 mL超纯水,稀释成10 mmol/L,置于20 mL量筒中,加水溶解至刻度,得混合标准品溶液。取混合标准品溶液200 μL至2 mL EP管中,与240 μL 0.5 mol/L1-苯基-3-甲基-5-吡唑啉酮及0.2 mL 0.3 mol/L NaOH溶液混合,充分振摇,放置于恒温金属浴中,70℃、300 r/min反应70 min。冷却至室温,加入200 μL 0.3 mol/L HCl中和,加入1 mL氯仿萃取,离心,弃去有机层。重复萃取3次,得上层水液,经0.22 μm微孔滤膜过滤,备用。准确吸取多糖水解液200 μL,进行高效液相分析。根据单糖标准品出峰的保留时间分析样品的单糖组成。
1.2.4 统计分析
所有试验均重复3次,结果以±SD表示,采用SPSS 17.0软件进行方差分析处理,并以Duncan′s多重比较检验,比较绿球藻多糖对不同菌种的抑制效果,已t-检验比较绿球藻多糖对金黄色葡萄球菌细胞膜渗透性的影响。当P<0.05时被认为具有显著性差异,当P<0.01时被认为具有极显著性差异。
2 结果与讨论
2.1 绿球藻多糖的抑菌效果
绿球藻多糖对5种细菌均表现出明显的抑制作用(表1)。从形成的抑菌圈直径可看出,纯多糖的抑菌效果普遍好于粗多糖,且差异显著(P<0.05)。纯多糖对细菌抑制作用大小顺序依次为:金黄色葡萄球菌=枯草芽孢杆菌>产气杆菌=变形杆菌>大肠杆菌。绿球藻纯多糖对金黄色葡萄球菌和枯草芽孢杆菌的抑制作用较强,抑菌圈直径分别达到16.57 mm和16.41 mm,显著高于粗多糖的11.94 mm和10.42 mm(图1)。罗爱国等[21]曾报道过7种可食藻水提物和醇提物的抑菌效果,与其比较,绿球藻多糖的抑菌效果明显优于除钝顶螺旋藻Arthrospiraplatensis外的其他6种可食藻。

图1 绿球藻多糖对细菌的抑菌效果a:金黄色葡萄球菌;b:大肠杆菌;c:枯草芽孢杆菌;d:变形杆菌;e:产气杆菌;①:对照;②:绿球藻粗多糖;③:绿球藻纯多糖Fig.1 Antibacterial effects of Chlorococcus sp.polysaccharides on bacteriaa:Staphylococcus aureus;b:Escherichia coli;c:Bacillus subtilis;d:Proteus vulgaris;e:Acrobacter aerogenes;①:Control;②:Bacteriostatic circle of Chlorococcus sp.crude polysaccharide;③:Bacteriostatic circle of Chlorococcus sp.pure polysaccharide
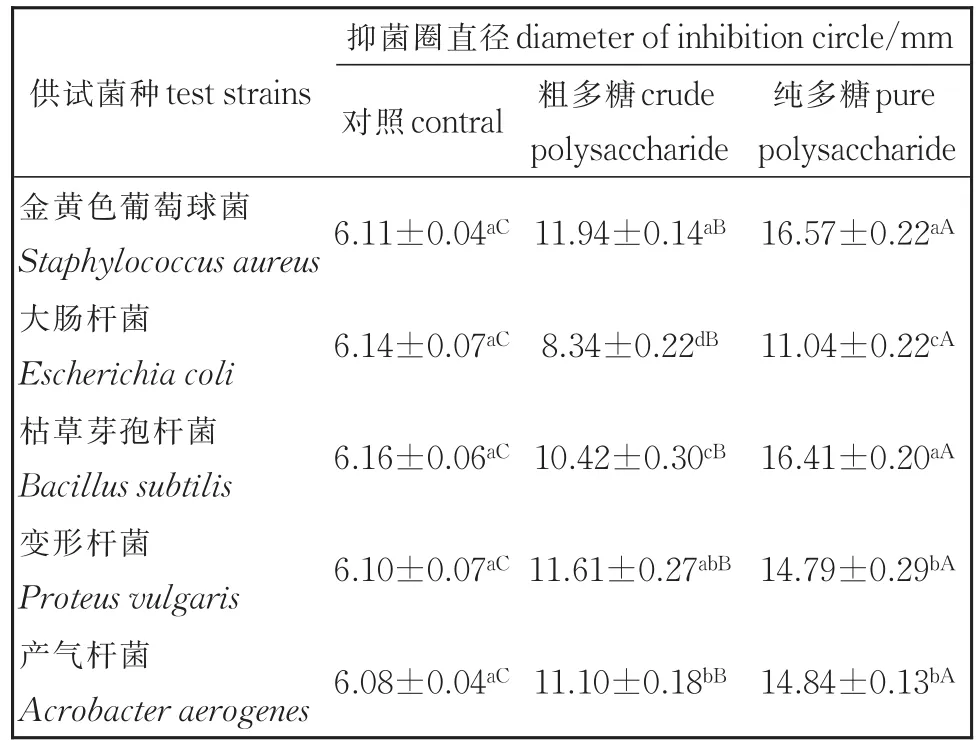
表1 绿球藻多糖的抑菌效果Table 1 Antibacterial effects of polysaccharide from Chlorococcus sp.(n=3)
2.2 绿球藻多糖的最低抑菌浓度(MIC)
CPP对5种细菌均有抑制作用,敏感性顺序由弱到强依次为:大肠杆菌、变形杆菌、产气杆菌、枯草芽孢杆菌、金黄色葡萄球菌,其MIC依次分别为20 mg/mL、20 mg/mL、10 mg/mL、5 mg/mL,2.5mg/mL。可见,供试细菌中对革兰氏阳性菌金黄色葡萄球菌的抑菌作用较强。与之前文献报道相比[12],钝顶螺旋藻水提物对金黄色葡萄球菌的MIC为1.25 mg/mL,对大肠杆菌的MIC为2.5 mg/mL,本研究绿球藻纯多糖对金黄色葡萄球菌的MIC为2.5 mg/mL,对大肠杆菌的MIC为20 mg/mL,说明绿球藻纯多糖抑菌效果较钝顶螺旋藻略差(表2)。

表2 绿球藻多糖最低抑菌浓度Table 2 Minimum inhibitory concentration of polysaccharide from Chlorococcus sp.
2.3 绿球藻多糖对金黄色葡萄球菌生长曲线的影响
绿球藻多糖对金黄色葡萄球菌的抑制效果最好,故以金黄色葡萄球菌为例,研究了绿球藻多糖对其生长曲线的影响。由图2可知,与对照组相比,处理组生长进入对数期的时间明显延后,且吸光度值降低,粗多糖和纯多糖处理组分别较对照组降低了5.4%和15.2%,说明绿球藻多糖抑制了金黄色葡萄球菌细胞的正常生长,菌体细胞生长代谢被延缓。从实验结果也可以看出,纯多糖的抑菌效果明显优于粗多糖,这是因为粗多糖中含有一些非多糖类杂质,如脂类,影响了其抑菌活性。这一结果与有关文献对钝顶螺旋藻的研究结果一致[12]。

图2 绿球藻多糖对金黄色葡萄球菌生长曲线的影响Fig.2 Effects of polysaccharide from Chlorococcus sp.on growth curve of Staphylococcus aureus
2.4 绿球藻多糖对金黄色葡萄球菌细胞膜渗透性的影响
细胞内容物在260 nm有吸收,表明细胞膜受到了破坏[22]。图3是不同浓度的CPP对金黄色葡萄球菌作用下,细胞上清液的OD260nm值。当用1/2 MIC浓度的CPP作用于金黄色葡萄球菌时,在所检测的时间范围内,上清液OD260nm与对照相比,没有显著性差异(P>0.05)。当用MIC的CPP作用于金黄色葡萄球菌时,上清液OD260nm与对照相比,有显著差异(P<0.05)。当用2 MIC和4 MIC的CPP作用于金黄色葡萄球菌时,上清液OD260nm与对照相比,有极显著差异(P<0.01)。可见,CPP会导致金黄色葡萄球菌OD260nm特征吸收物质的泄露,而且这种现象与浓度有关。本实验说明了绿球藻纯多糖是破坏了金黄色葡萄球菌细胞的完整性,使细胞膜通透性增加,导致胞内核酸物质流出,细胞代谢发生紊乱,OD260nm值增加。随后,OD260nm减小,可能是CPP使释放出的DNA、mRNA变性所致。总体来看,不同浓度的CPP对金黄色葡萄球菌的影响也不同。
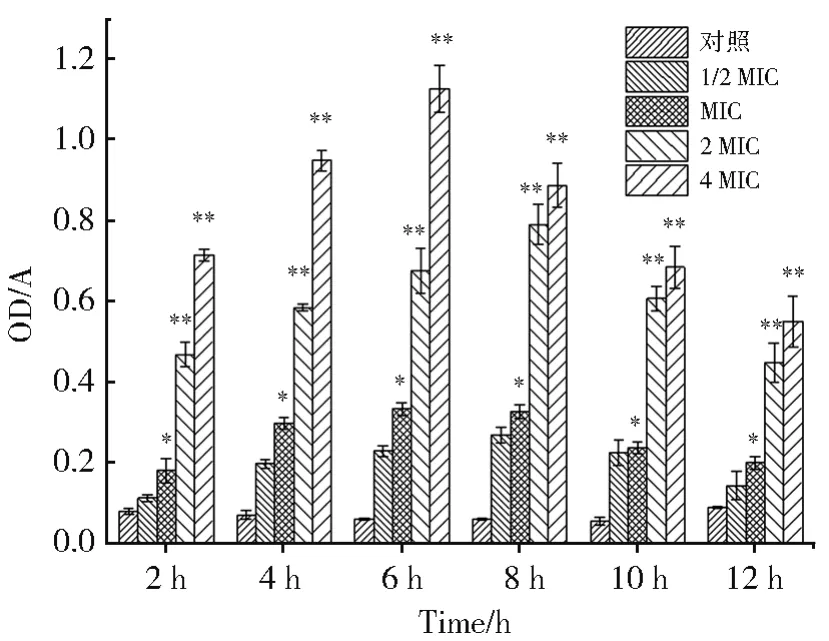
图3 绿球藻多糖对金黄色葡萄球菌细胞膜渗透性的影响(对照为无绿球藻多糖处理时金黄色葡萄球菌上清液的OD260 nm值;1/2 MIC、MIC、2 MIC和4 MIC分别表示绿球藻纯多糖的处理浓度为1/2最低抑菌浓度、最低抑菌浓度、2倍最低抑菌浓度和4倍最低抑菌浓度;与对照组相比,*P<0.05为差异显著,**P<0.01为差异极显著)Fig.3 Effects of polysaccharide from Chlorococcus sp.on cell permeability of Staphylococcus aureus(The control is the OD260 nmvalue of Staphylococcus aureus supernatant without Chlorococcus sp.polysaccharide;1/2 MIC,MIC,2 MIC and 4 MIC respectively indicated that the treatment concentration of pure polysaccharide of Chlorococcus sp.is 1/2 of the minimum inhibitory concentration,the minimum inhibitory concentration,the double minimum inhibitory concentration and the four times minimum inhibitory concentration;Compared with the control group,*P <0.05 means the difference is significant,**P<0.01 means the difference is very significant)
2.5 绿球藻多糖对金黄色葡萄球菌液溶氧量的影响
由图4可知,没有绿球藻多糖处理的对照中,金黄色葡萄球菌菌体大量生长,呼吸作用较强,培养液中溶解氧显著下降。而添加绿球藻多糖的金黄色葡萄球菌菌体生长受到抑制,呼吸作用减弱,培养液中溶解氧较对照高。未经CPP处理的菌体在最初的12 h内,呼吸作用较强,培养基中的溶氧量显著下降(P<0.05)。当培养时间为12 h,培养基中的溶氧量达到最低,12 h之后溶氧量又显著升高。用MIC和2 MIC浓度的CPP作用于金黄色葡萄球菌时,培养基中的溶氧量在16 h内显著下降(P<0.05)。培养时间为16 h,培养基中的溶氧量达到最低,16 h之后溶氧量又缓慢升高。用4 MIC浓度的CPP作用于金黄色葡萄球菌时,培养基中的溶氧量在8 h内略微下降。培养时间为8 h,培养基中的溶氧量达到最低,8 h之后溶氧量又缓慢升高,菌体耗氧量变化幅度很小。可以推断,该系统中细菌的呼吸作用由于受到绿球藻多糖的影响而大大减弱。这一结果也与有关文献的报道类似[23]。
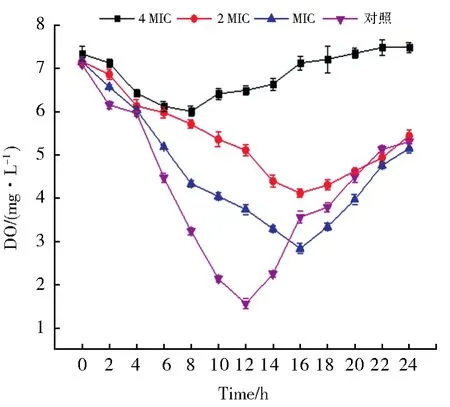
图4 绿球藻多糖对金黄色葡萄球菌液溶氧量的影响(对照为无绿球藻多糖处理,MIC、2 MIC和4 MIC分别表示绿球藻纯多糖的处理浓度为最低抑菌浓度、2倍最低抑菌浓度和4倍最低抑菌浓度)Fig.4 Effects of polysaccharide from Chlorococcus sp.on dissolved oxygen of Staphylococcus aureuss(The control is the treatment without Chlorococcus sp.polysaccharide.MIC,2 MIC and 4 MIC respectively indicate that the treatment concentration of Chlorococcus sp.polysaccharide is the minimum inhibitory concentration,2 times the minimum inhibitory concentration and 4 times the minimum inhibitory concentration)
2.6 绿球藻多糖的分子量
采用高效凝胶渗透色谱法测定已知分子量葡聚糖,结果见表3。以表3数据回执标准曲线,并做回归处理,得到的回归方程为:Log分子量=—1.129t+13.973(R2= 0.990 6)。
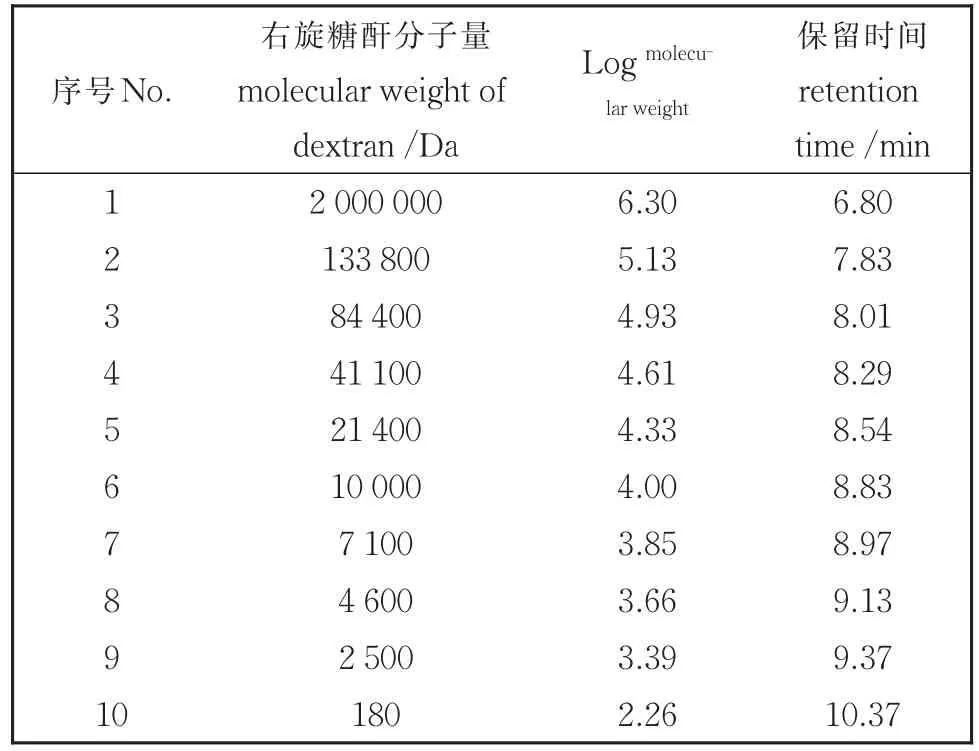
表3 右旋糖酐分子量分析Table 3 Molecular weight analysis of dextrose radicals
将5 mg/mL绿球藻纯多糖溶液,通过高效凝胶色谱进行测定,记录色谱峰保留时间(图5)。可以看出,绿球藻多糖在高效凝胶渗透色谱上呈单一对称峰,说明其纯度较高。根据样品测定的保留时间,通过前述回归方程,计算得绿球藻多糖的分子量为8 090.31 Da,小于钝顶螺旋藻多糖和雨生红球藻(Haematococcuspluvialis)多糖的分子量[12,24]。有文献报道,分子量相对较低的多糖可能具有更高的生物活性[25-26]。可见绿球藻多糖其它生物活性是值得进一步深入研究的。
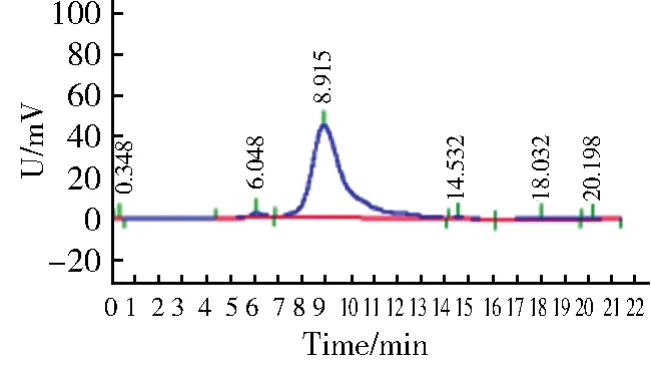
图5 绿球藻多糖的高效凝胶渗透色谱图Fig.5 High-performance gel permeation chromatogram of polysaccharide from Chlorococcus sp.
2.7 绿球藻多糖的组成
多糖生物活性与其单糖组成有关,因此,确定多糖中的单糖组分是分析多糖结构的基础[6]。图6是标准单糖溶液色谱图和绿球藻纯多糖样品测试结果,可以看出,色谱峰分离效果较好,保留时间稳定,能够准确定性和定量。通过分析比较可知,绿球藻多糖组成主要为甘露糖、鼠李糖、葡萄糖、半乳糖和木糖,还含有少量的半乳糖醛酸和岩藻糖。通过计算得出,绿球藻多糖中甘露糖、鼠李糖、半乳糖醛酸、葡萄糖、半乳糖、木糖和岩藻糖的摩尔比为1.68∶3.26∶0.09∶1.00∶4.56∶8.11∶0.28。这与钝顶螺旋藻的单糖组成(木糖、岩藻糖、鼠李糖醇、阿拉伯糖醇、半乳糖、葡萄糖和甘露醇)[12],有一定差异。
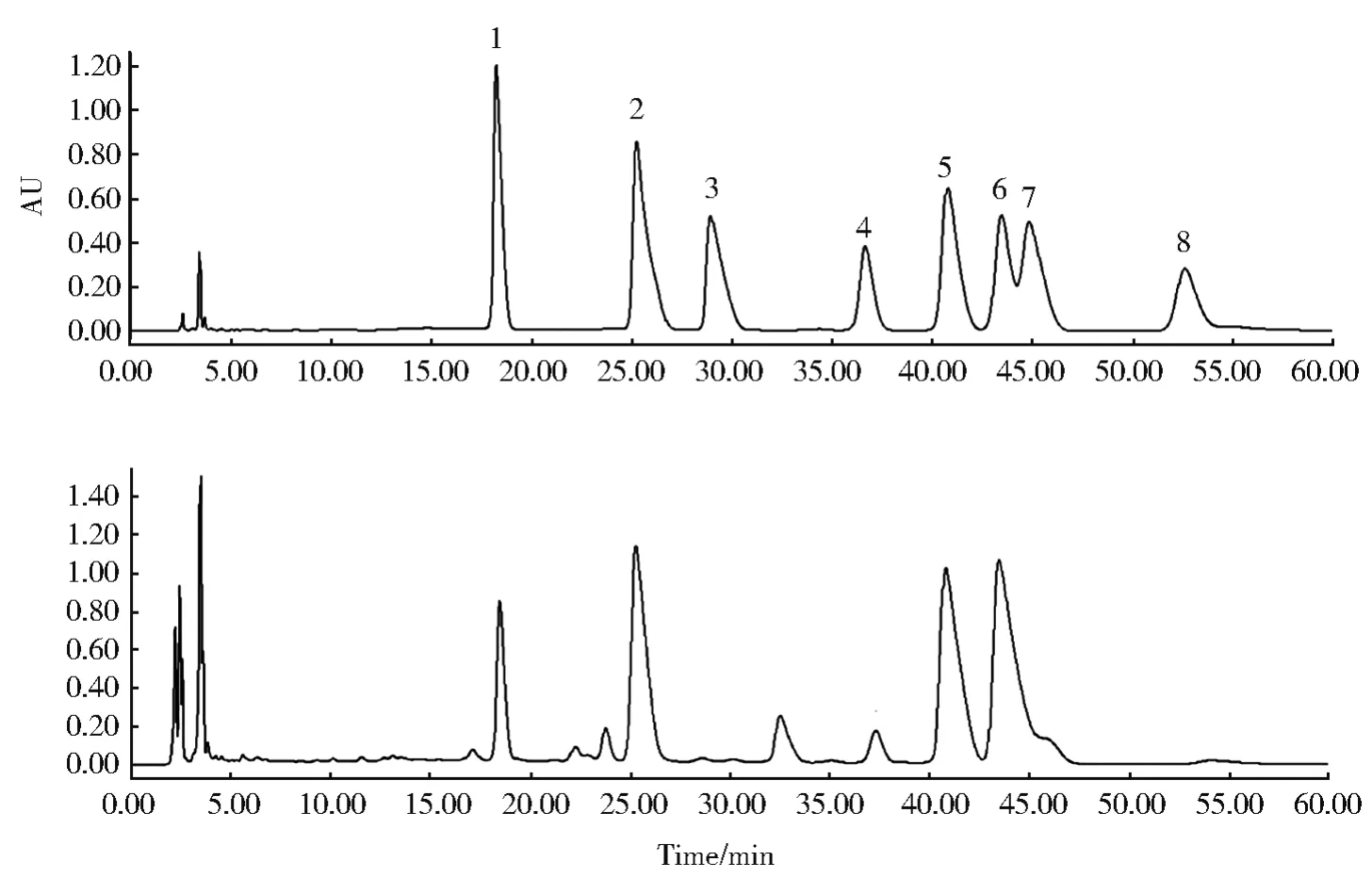
图6 单糖标准品(上)和绿球藻纯多糖(下)色谱图1:甘露糖;2:鼠李糖;3:半乳糖醛酸;4:葡萄糖;5:半乳糖;6:木糖;7:阿拉伯糖;8:岩藻糖。Fig.6 Chromatogram of standard chromatogram of monosaccharide and polysaccharide from Chlorococcus sp1:Mannose;2:Rhamnose;3:Galacturonic acid;4:Glucose;5:Galactose;6:Xylose;7:Arabinose;8:Fucose
3 结论
(1)绿球藻多糖具有明显的抑菌活性,且纯多糖抑菌效果好于粗多糖,其中对金黄色葡萄球菌和枯草芽孢杆菌抑制效果最强。绿球藻多糖的抑菌效果也优于常见微藻钝顶螺旋藻水提物和醇提物的抑菌效果,与钝顶螺旋藻纯多糖相似。
(2)绿球藻纯多糖分子量为8 090.31 Da,单糖组成包括甘露糖、鼠李糖、半乳糖醛酸、葡萄糖、半乳糖、木糖和岩藻糖。绿球藻多糖的分子量小于钝顶螺旋藻和雨生红球藻,推测具有较强的生物活性。
(3)绿球藻多糖可作为天然食品防腐剂和新型食品抑菌剂,在食品生产应用方面具有重要潜力。

