黑豆皮中天然产物抗氧化及降糖活性筛选
李勇,芦冬涛,董川,梁文婷
(山西大学 环境科学研究所,山西 太原 030006)
0 引言
黑豆为豆科大豆属植物,广泛分布于华北和东北地区。其营养丰富,是蛋白质、不饱和脂肪酸、膳食纤维、矿物质、维生素和其他生物活性化合物(如异黄酮)的良好来源[1]。黑豆皮为黑豆的干燥成熟种皮,又称料豆衣、乌衣等,对治疗阴虚烦热、眩晕、盗汗、头痛、风痹等症有良效,且有解毒利尿、明目益精、养血疏风之功效[2]。现代药理研究发现,黑豆具有多种生物活性,包括抗氧化[3]、抗炎[4]、修复DNA 损伤[5]和降脂活性[6],这些药理作用与其生物活性成分异黄酮和花青素有着直接关系,而黑豆皮中含有大量的异黄酮和花青素,因此研究黑豆皮中黄酮类活性天然产物及其活性有着重要的意义。
目前,国 内外在黑豆皮[Glycinemax(L.)Merr.]提取物研究中,对黑豆皮花色苷类成分和药理活性报道较多。如,2017年李旭升等[7]从黑豆皮中得到了一系列花色苷类化合物,天竺葵素-3-O-芸香糖苷(Pelargonidin-3-O-rutinosie)、矢车菊素-3-O-葡萄糖苷(Cyanidin-3-O-glucoside)、芍药色素-3-O-葡萄糖苷(Peonidin-3-O-glucoside)和锦葵素-3-葡萄糖苷-4-乙醛(Vitisin B);国内外药理活性研究可以看出,花色苷有降低血糖[8]、抗癌[9]、消炎[10]、修复生殖损伤[11]、修复皮肤损伤[12]等作用。鉴于黑豆皮活性成分研究多限于水提物部分,黑豆皮其他化学成分及其相应活性有待进一步深入研究。因此开展黑豆皮中其他种类提取物研究具有重要的应用价值。
本研究通过对山西产豆科植物黑豆皮醇提物进行系统化学成分研究,利用体外抗氧化和降糖活性筛选平台,筛选出较强活性部位,通过各种色谱及波谱技术,发现了6个具有一定ABTS+和DPPH+自由基清除作用和α-葡萄糖苷酶抑制活性的化合物。这些研究结果,进一步为明确黑豆皮活性成分奠定了基础,并且为其在抗氧化和降血糖方面应用提供了依据。
1 材料与方法
1.1 材料与试剂
黑豆皮选购于太原田禾批发市场。
常规试剂石油醚、乙酸乙酯、乙醇、正丁醇均为北京化工分析纯试剂。ABTS(2,2′-联氨-双-3-乙基苯并噻唑啉-6-磺酸),色谱甲醇,DPPH(阿卡波糖水合物,1,1-二苯基-2-苦基肼),4-MUG(4-甲基伞形酮-β-D-葡萄糖苷),α-D-葡萄糖苷酶[EC 3.2.1.20]为Sigma产品。
1.2 仪器
HPLC-1200高效液相色谱仪(美国Agilent公司),半制备HPLC色谱仪(北京创新通恒有限公司),Agela半制备柱(10 mm×250 mm,美国Dikma公司);Bruker-Avance-500 FT核磁共振仪(瑞士Bruker公司);LCMS-2010液质联用仪(日本Shimadzu公司)。
2 抗氧化及降糖活性部位筛选及其天然产物分离、纯化
2.1 抗氧化及降糖活性部位筛选
2.1.1 抗氧化活性分析
将待测组分采用前期建立的ABTS+和DPPH+两种模型[13]进行抗氧化活性筛选,分析不同浓度组分清除率。
图1为ABTS+和DPPH+自由基紫外吸收图谱,表1和表2为黑豆皮乙酸乙酯部分I—Ⅸ抗氧化能力结果分析。从粗提物I—Ⅸ作用于ABTS+模型及DPPH+模型后的清除率可以看出,乙酸乙酯部分Ⅳ在浓度 500 μg/mL、200 μg/mL、50 μg/mL 下对ABTS+清除率分别为 90%、80% 和 60%,对DPPH+清除率分别为92%、83%和65%。

表2 黑豆皮乙酸乙酯粗提物I—Ⅸ不同浓度下对DPPH+清除率Table 2 Scavenging ability of DPPH+by ethyl acetate extractI—Ⅸ from black soybean hulls
2.1.2 降糖活性分析
将待测组分采用前期建立的α-葡萄糖苷酶抑制模型[13]进行降糖活性筛选,分析不同浓度组分抑制率。
分别对乙酸乙酯部分I—Ⅸ进行了α-葡萄糖苷酶抑制作用筛选,结果表明乙酸乙酯部分Ⅳ在浓度500 μg/mL、200 μg/mL、50 μg/mL 下对 α-葡萄糖苷酶抑制率分别为93%、89%和65%。

表3 α-葡萄糖苷酶抑制作用筛选Table 3 Inhibitory activity of α-Glucosidassebyethyl acetate extract of black soybean hulls
2.2 分离与纯化
将6 kg干燥黑豆皮,用50 L 90%乙醇室温浸泡72 h。提取液浓缩,得总提物约325 g。所得总提物分散于水中,用石油醚萃取后得石油醚(PE)部分30 g,用乙酸乙酯萃取后得乙酸乙酯(EtOAc)部分10 g,用正丁醇溶液萃取后得正丁醇(nBuOH)部分7.5 g和水(H2O)部分230.5 g。
EtOAc萃取部分10 g,经硅胶(200目~300目)减压柱[PE:EA(10∶1→6∶1→3∶1→1∶1)]分离,得到I—Ⅸ9个组分。Ⅳ(1.7 g)组分由Sephadex LH-20柱色谱分离,甲醇洗脱,TLC检测合并为6部分(4—1~4—6),经ODS柱色谱,使用甲醇/水体系进行分离,最后经半制备HPLC[MeOH-H2O(60∶40)]分离,得化合物 1—6。
3 结构鉴定
利用NMR和MS对化合物1—6进行表征。
3.1 纯度检测
EtOAc部分Ⅳ和化合物 11— 66 HPLC图谱如图2所示。以归一法计算峰面积,纯度达到98%以上。
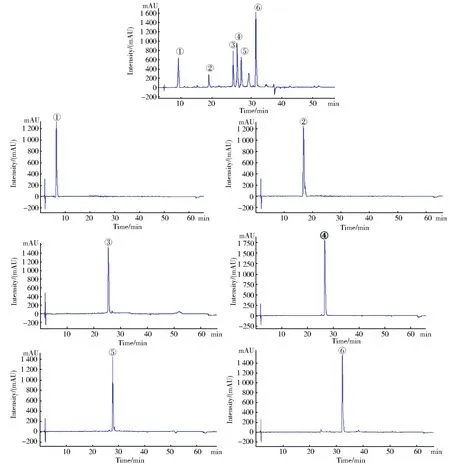
图2 EtOAc部分Ⅳ和化合物1-6 HPLC图谱Fig.2 HPLC chromatograms ofethyl acetate extractⅣand compounds 1-6
3.2 化合物 11— 66理化和波谱数据
化合物 11,无色针晶(甲醇)。ESI-MS:m/z=191.2[M+Na]+,确定其分子量为 168,分子式:C8H8O4;1H NMR 谱(DMSO,500 MHz):δ7.44(1H,d,J=2.1 Hz,H-2),6.85(1H,d,J=8.8 Hz,H-5),7.43(1H,dd,J=8.8,2.1 Hz,H-6),3.81(3H,s,CH3O)。13C NMR谱(DMSO,500 MHz):δ122.4(C-1),115.4(C-2),147.6(C-3),151.5(C-4),113.2(C-5),123.9(C-6)),167.9(COOH),56.0(CH3O)。波谱资料与文献对照一致[14]。
化合物 22,无色针晶(甲醇)。ESI-MS:m/z=205.3[M+Na]+,确定其分子量为 182,分子式:C9H10O4;1H NMR 谱(DMSO,500 MHz):δ7.37(1H,d,J=1.9 Hz,H-2),6.81(1H,d,J=8.1 Hz,H-5),7.36(1H,dd,J=8.1,1.9 Hz,H-6),4.23(2H,q,J=8.1 Hz,CH2O),1.29(3H,t,J=7.1 Hz)。13C NMR 谱(DMSO,500 MHz):δ122.2(C-1),115.8(C-2),145.6(C-3),150.9(C-4),116.7(C-5),121.2(C-6),166.2(COOH),60.6(CH2O),14.7(CH3)。波谱资料与文献对照一致[14]。
化合物 33,黄色粉末。ESI-MS:m/z=255.2[M+H]+,确定其分子量为 254,分子式:C15H10O4;1H NMR 谱(DMSO,500 MHz):δ8.27(1H,s,H-2),7.93(2H,d,J=8.8 Hz,H-5),6.81(1H,d,J=2.1 Hz,H-8),6.93(1H,dd,J=8.8,2.1 Hz,H-6),7.38(2H,d,J=8.7 Hz,2′,6′-H),6.83(2H,d,J=8.7 Hz,3′,5′-H)。13C NMR 谱(DMSO,500 MHz):δ153.1(C-2),123.0(C-3,1′),175.2(C-4),130.5(C-5),121.3(C-6),164.3(C-7),102.5(C-8),158.1(C-9),116.1(C-10),130.5(C-2′,6′),160.6(C-4′),115.4(C-3′,5′)。波谱资料与文献对照一致[15]。
化合物 44,黄色晶体(甲醇)。ESI-MS:m/z=303.1,确定其分子量为 302,分子式:C15H10O7;1H NMR 谱(DMSO,500 MHz):δ7.66(1H,d,J=2.2 Hz,H-2′),7.54(1H,dd,J=8.20,2.20 Hz,H-6′),6.87(1H,d,J=8.20 Hz,H-5′),6.39(1H,d,J=2.20 Hz,H-8),6.17(1H,d,J=2.2 Hz,H-6);13C NMR 谱(DMSO,500 MHz):δ176.3(C-4),166.8(C-7),161.1(C-5),156.7(C-9),148.5(C-4′),147.0(C-2),145.8(C-3′),136.3(C-3),122.4(C-1′),120.3(C-6′),116.2(C-5′),115.5(C-2′),103.0(C-10),99.0(C-6),93.9(C-8)。波谱资料与文献对照一致[16]。
化合物 55,黄色粉末。ESI-MS:m/z=271.1[M+H]+,确定其分子量为 270,分子式:C15H10O5;1H NMR 谱(DMSO,500 MHz):δ8.27(1H,s,H-2),7.36(2H,d,J=8.60 Hz,H-2′,6′),6.81(2H,d,J=8.60 Hz,H-3′,5′),6.32(1H,s,H-8),6.17(1H,s,H-6);13C NMR 谱(DMSO,500 MHz):δ180.4(C-4),166.3(C-7),162.4(C-5),158.2(C-9),154.1(C-2),157.9(C-4′),130.6(C-2′,6′),122.6(C-1′),121.8(C-3),115.5(C-3′,5′),104.4(C-10),99.8(C-6),94.3(C-8)。波谱资料与文献对照一致[17]。
化合物 66,黄色晶体(甲醇)。ESI-MS:m/z=317.1[M+H]+,确定其分子量为 316,分子式:C16H12O7;1H NMR 谱(DMSO,500 MHz):δ6.35(1H,d,J=1.5 Hz,H-6),6.71(1H,s,H-8),7.73(1H,s,H-2′),6.90(1H,d,J=8.36 Hz,H-5′),7.59(1H,J=7.26 Hz,H-6′),3.88(3H,s,OCH3);13C NMR 谱(DMSO,500 MHz):δ145.6(C-2),136.3(C-3),176.5(C-4),160.9(C-5),97.9(C-6),165.3(C-7),92.3(C-8),156.5(C-9),104.5(C-10),122.3(C-1′),115.7(C-2′),148.3(C-3′),147.7(C-4′),116.1(C-5′),120.5(C-6′),56.5(-OCH3)。波谱资料与文献对照一致[18]。
4 化合物1—6抗氧化活性及降糖活性分析
4.1 化合物 11— 66抗氧化活性分析
实验结果:化合物 11— 66表现出较强ABTS+和DPPH+自由基清除作用( 44> 66> 55> 33> 11>Vc> 22),化合物 44自由基清除能力最高(IC50=6.01 μg/mL和9.21 μg/mL)。槲皮素表现出的高活性是由于其可以抑制脂质过氧化物的生成,使谷胱甘肽过氧化物酶、过氧化氢酶和超氧化物歧化酶活性分别增加1.71、2.19和 1.68 倍[19]。
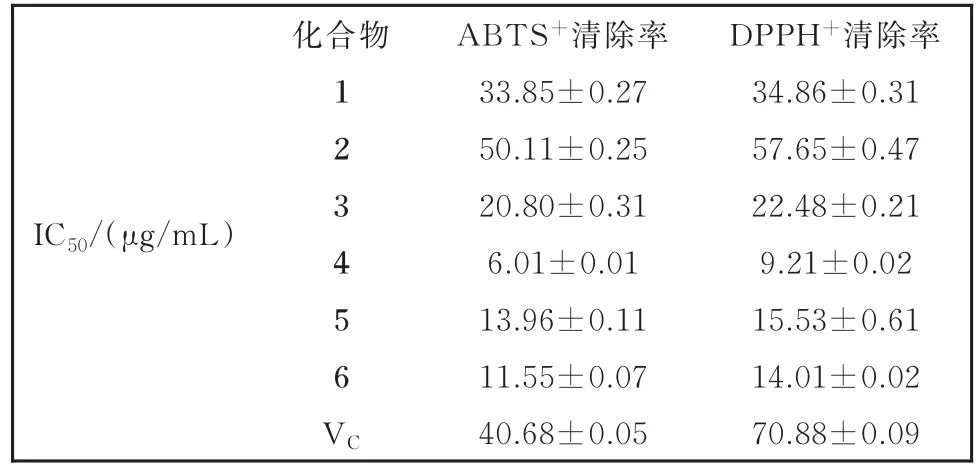
表4 化合物1-6对ABTS+和DPPH+自由基的清除活性分析Table 4 Free radical scavenging activity of compound 1-6
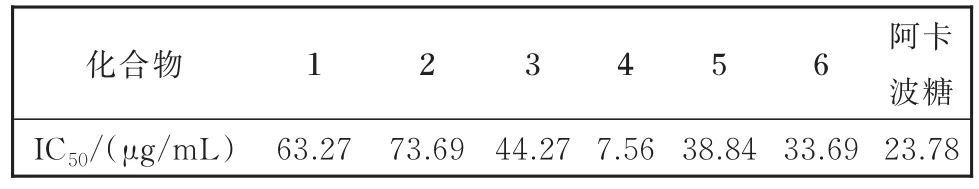
表5 α-葡萄糖苷酶抑制作用筛选Table 5 Inhibitory activity of α-glucosidasse by compound 1-6 from black soybean hulls
4.2 化合物 11— 66降糖活性分析
实验结果:化合物 11— 66表现出α-葡萄糖苷酶抑制活性( 44>阿卡波糖> 66> 55> 33> 11> 22)。因此得出结论,槲皮素( 44)是黑豆皮提取物中具有较强α-葡萄糖苷酶抑制活性成分(IC50=7.56 μg/mL)。槲皮素的高抑制活性是由于槲皮素通过非竞争性的抑制肠道葡萄糖转运蛋白GLUT2转运葡萄糖和果糖,从而抑制细胞对葡萄糖和果糖的吸收,起到降血糖的作用[20]。
如图 3 所示,化合物 44(50 μg/mL)加入后,4-MU(4-甲基伞形酮)荧光强度变小。这表明化合物4具有对α-葡萄糖苷酶活性的抑制能力,进一步抑制4-MUG的水解,减少4-MU产生。
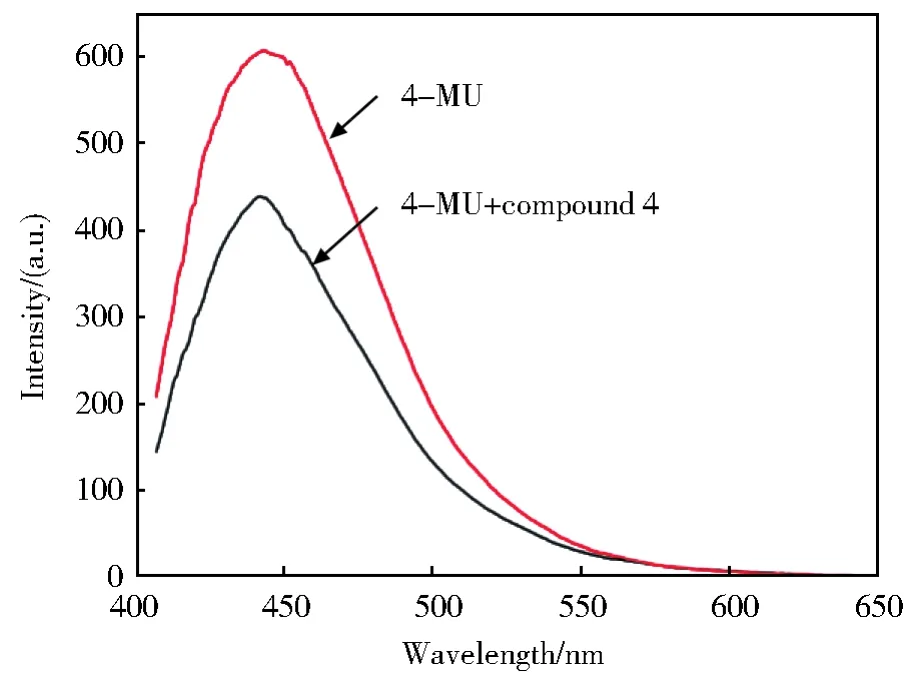
图3 化合物4加入前后4-MU荧光变化Fig.3 Fluorescence changes of 4-MU by adding compound 4(50 μg/mL)
5 结论
本文采取色谱技术对山西产黑豆皮醇提物进行了分离和鉴定。以活性筛选为导向,发现活性部位Ⅳ表现出很强的ABTS+和DPPH+自由基清除作用和α-葡萄糖苷酶抑制活性,并且从中分离和鉴定了酚酸类化合物 11— 66。其中,异鼠李素首次从黑豆皮中分得。对六种黑豆皮天然产物的抗氧化和α-葡萄糖苷酶抑制活性进行评价,得出槲皮素抗氧化活性和α-葡萄糖苷酶抑制活性能力最强。本研究进一步明确了黑豆皮活性成分,并且为其在抗氧化和降血糖方面的应用提供了依据。

